南瓜多糖水解工艺优化研究
杜秉健,李全宏
(中国农业大学食品科学与营养工程学院,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
南瓜多糖水解工艺优化研究
杜秉健,李全宏*
(中国农业大学食品科学与营养工程学院,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
南瓜资源丰富,本实验从利用南瓜中的重要成分南瓜多糖入手,研究了时间(x1)、温度(x2)和酸浓度(x3)对酸水解南瓜多糖制备低聚糖工艺的影响,通过响应面法优化的最佳工艺为:时间171min;温度64℃;硫酸浓度7.3%。在这个条件下获得的总糖含量为33.362mg/mL,同时平均聚合度为3000,达到了保护多糖含量的同时实现南瓜多糖的可控降解的目的,为南瓜的深加工利用和提高附加值提供了新的途径。
南瓜,多糖,酸水解,响应面
1 材料与方法
1.1 材料与仪器
南瓜 新鲜、无病虫害、充分成熟,市售;3,5-二硝基水杨酸显色剂(DNS试剂) 取3,5-二硝基水杨酸6.3g,氢氧化钠21g,溶于酒石酸钾钠的热溶液(182g酒石酸钾钠溶于500mL热水)中,再加5g苯酚,5g无水亚硫酸钠,搅拌加热溶解,冷却后定容至1000mL,置棕色瓶内保存,7d后标定和使用;葡聚糖标准品 Sigma公司;其它试剂 均为分析纯。
食物调理机 德国BROWN公司;RE-52A型旋转蒸发仪、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;PHS-3C型精密pH计 上海雷磁仪器厂; Hitachi Himac CR22g高速冷冻离心机 日本日立株式会社;S22-2磁力搅拌器 上海司乐仪器有限公司; DK-98-1型电热恒温水浴锅 上海精宏精密实验设备有限公司;UV757CRT紫外可见分光光度计 普析通用;高效液相色谱仪 德国KNAUER公司;冷冻干燥机。
1.2 实验方法
1.2.1 南瓜多糖的提取 新鲜南瓜,-18℃缓冻24h,洗净,切块,打磨成浆。以料液比1∶4(w/v)加入去离子水,于85℃水浴中浸提4h,4200r/min离心15min,收集上清液,残渣用1∶4(w/v)的去离子水在85℃水浴中再浸提3h,离心,合并两次上清液。向上清液中加入三倍体积的无水乙醇,搅拌30min,然后在4℃冰箱静置12h,4800r/min离心10min,分离醇沉物,冻干作为多糖样品[8]。
1.2.2 单因素实验
1.2.2.1 时间对南瓜总糖含量和聚合度的影响 取1g多糖于20mL 7.5%(V/V)的硫酸溶液中,在70℃下分别水解 60、120、180、240、300、360min后,用0.5mol/L的NaOH溶液中和至中性,测定还原糖与总糖含量。
1.2.2.2 温度对南瓜总糖含量和聚合度的影响 取1g多糖于20mL 7.5%(V/V)的硫酸溶液中,分别在40、50、60、70、80℃下水解180min后,用0.5mol/L的NaOH溶液中和至中性,测定还原糖与总糖含量。
1.2.2.3 硫酸浓度对南瓜总糖含量和聚合度的影响
取1g多糖分别于20mL 2.5、5.0、7.5、10.0的12.5% (V/V)硫酸溶液中,在70℃下水解180min后,用0.5mol/L的NaOH溶液中和至中性,测定还原糖与总糖含量。
1.2.3 优化实验设计 依据 Design Expert 7.0.0软件,采用Central Composite Design建立数学模型,以时间X1、温度X2和硫酸浓度X3三个因子为自变量。其中,Xi为自变量的真实值,xi为自变量的编码值,按方程xi=(Xi-Xo)/ΔX对自变量进行编码。Xo为实验中心点处自变量的真实值,ΔX为自变量的变化步长。以平均聚合度和总糖含量为响应值,建立回归方程模型。
根据单因素实验结果,采用三因素五水平的响应面法,实验因子编码及水平见表1。

表1 响应面三因素五水平实验设计
1.2.4 分析方法
1.2.4.1 总糖含量的测定[9]总糖含量的测定采用苯酚-硫酸法。标准曲线的制作如下:称取葡萄糖1.00g溶于去离子水,定容至100mL,取1mL定容至100mL,即制得100μg/mL标准葡萄糖溶液。分别移取配制的100μg/mL标准葡萄糖溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mL于试管,以去离子水定容至1.0mL,即得不同浓度葡萄糖标准溶液(0、10、20、30、40、50、60、70、80、90、100μg/mL),加入1.0mL的6%苯酚溶液,然后加入浓硫酸5.0mL,室温静置20min,以0管为空白,于490nm波长处测定其他各管溶液的吸光度值,以葡萄糖浓度为横坐标,以490nm吸光度值为纵坐标,绘制出标准曲线,其方程为Y=0.00986x-0.0392。
将多糖水解液稀释合适的倍数,取稀释液1.0mL,按照上述步骤操作,测定吸光值,以标准曲线方程计算总糖含量。
1.2.4.2 还原糖含量的测定[10]还原糖含量的测定采用DNS法。标准曲线的制作如下:取8支干净的试管分别加入0、0.2、0.4、0.5、0.6、0.7、0.8、1.0mL的1mg/mL葡萄糖标准液、3.0mL DNS试剂,补充去离子水到4.0mL,沸水浴反应10min后,迅速放入冰水浴中冷却,稀释至 20.0mL,以蒸馏水做空白,在540nm处测定溶液的吸光值,以葡萄糖浓度为横坐标,以540nm吸光度值为纵坐标,绘制出标准曲线,其方程为Y=0.8564x-0.0142。
将多糖水解液稀释合适的倍数,取稀释液1.0mL,按照上述步骤操作,测定吸光值,以标准曲线方程计算还原糖含量。
1.2.4.3 平均聚合度的计算[11]见下式:
平均聚合度=总糖/还原糖
1.2.4.4 软件分析 本实验统计分析软件采用SPSS16.0,作图软件采用Origin 8.0。
2 结果与讨论
2.1 不同水解程度南瓜多糖的平均聚合度
从图1中可以看出,降解后得到的不同平均聚合度的糖样品的分子量分布明显不同。图中a为未降解的南瓜多糖样品,平均聚合度为24519;b、c、d为南瓜多糖经酸水解制备的南瓜低聚糖样品,平均聚合度分别为4977、3374、2945。

图1 时间对总糖含量和平均聚合度的影响
样品a分子量主要分布于5000Da以上,最大分子量延伸到2.7×105Da;经过一定程度降解的样品b其12000Da以上的分子量分布明显减少,分子量在5000Da以下的产物明显增多,其中低于麦芽糖的小分子单糖产物显著增多;样品c的降解程度更深,其5000Da以上的分子量分布较b明显减少,低于麦芽糖的小分子单糖产物略为增多;样品d的降解程度最深,其几乎没有高于麦芽糖以上的小分子单糖产物,样品中主要组成物质为单糖。
所以在南瓜多糖降解过程中,用平均聚合度的变化来描述分子量的分布变化是稳定、可行的。
因此,为了充分降解南瓜多糖制备南瓜低聚糖,在高效液相色谱分析实验的基础上,本实验选取平均聚合度3000作为响应值优化的目标值。
2.2 单因素实验结果
2.2.1 时间对总糖含量和聚合度的影响 图2结果表明,当反应时间为240min时,所得总糖含量最高,达到35.18mg/mL。当反应时间小于240min时,随着反应时间的延长总糖含量逐渐增高;当反应时间大于240min时,随着反应时间的延长总糖含量逐渐下降。在本实验范围内,随着反应时间的延长,聚合度逐渐下降。
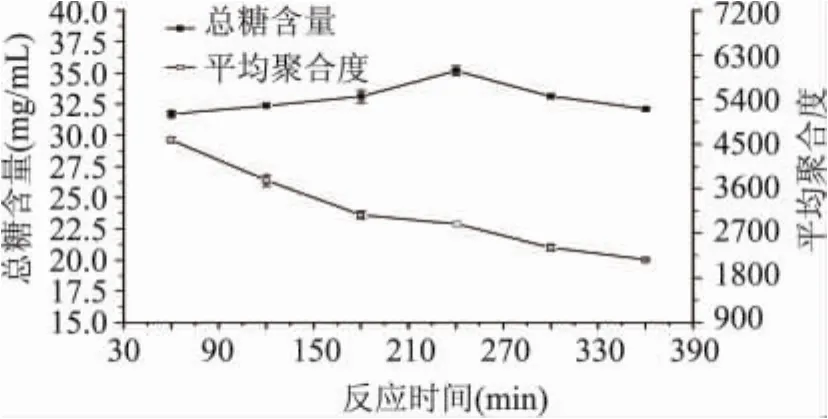
图2 时间对总糖含量和平均聚合度的影响
2.2.2 温度对总糖含量和聚合度的影响 图3结果表明,当反应温度为60℃时,所得总糖含量最高,达到37.19mg/mL。当反应温度小于60℃时,随着反应温度的增加总糖含量逐渐增高;当反应温度大于60℃时,随着反应温度的增加总糖含量逐渐下降。在本实验范围内,随着反应温度的延长,聚合度逐渐下降。

图3 温度对总糖含量与平均聚合度的影响
2.2.3 硫酸浓度对总糖含量和聚合度的影响 图4结果表明,当硫酸浓度为7.5%时,所得总糖含量最高,达到34.6mg/mL。当硫酸浓度小于7.5%时,随着硫酸浓度的增加,总糖含量逐渐增高;当硫酸浓度大于7.5%时,随着硫酸浓度的增加总糖含量逐渐下降。在本实验范围内,随着硫酸浓度的增加,聚合度逐渐下降。

图4 硫酸浓度对总糖含量和平均聚合度的影响
2.3 响应面法优化南瓜低聚糖提取工艺
2.3.1 响应面法实验设计及结果 表2中给出了总糖含量和平均聚合度的实验结果。

表2 响应面分析实验设计及结果
2.3.1.1 总糖含量的分析 按照Design Expert软件中的Central Composite Design模型,对实验设计各组的总糖含量进行回归分析,得回归方程如下:Y1= 33.34-0.18x1-0.46x2-0.22x3-0.17x1x2+0.24x1x3+ 0.035x2x3-0.077-0.15-1.55(Y1为总糖含量,x1、 x2、x3分别为上述3个自变量的编码值)。该模型的相关系数是0.8335(p<0.05),模型的拟合度良好,该模型是合适的,可以用此模型分析和预测不同水解条件下总糖含量的变化。对模型进行回归系数显著性检验(表3),由此可知,温度对总糖含量的影响显著,硫酸浓度的二次项对总糖含量的影响极显著。依据一次项回归系数绝对值的大小可知,因素的主效应关系为:温度>硫酸浓度>时间。

表3 回归方程模型系数的显著性检验
根据模型的回归方程,固定一个因素在编码值0的水平,分析另外两个因素对总糖含量的影响,Design Expert软件生成3个三维响应面(图5~图7)。从图5可以看出,硫酸浓度在7.5%时,温度和时间对总糖含量的影响。从图6可以看出,温度在60℃时,时间和硫酸浓度对总糖含量的影响。从图7可以看出,时间在240min时,温度和硫酸浓度对总糖含量的影响。

图5 温度和时间对总糖含量影响的响应面

图6 硫酸浓度和时间对总糖含量影响的响应面

图7 温度和硫酸浓度对总糖含量影响的响应面
2.3.1.2 平均聚合度的分析 按照Design Expert软件中的Central Composite Design模型,对实验设计各组的平均聚合度进行回归分析,得回归方程如下:Y2=3106.99-407.18x1-1797.52x2-406.01x3+140.26x1x2+73.90x1x3+204.91x2x3+74.45x+372.51x-266.67x(Y2为平均聚合度;x1、x2、x3分别为上述3个自变量的编码值)。该模型的相关系数是0.9856 (p<0.05),模型的拟合度良好,该模型是合适的,可以用此模型分析和预测平均聚合度随水解条件的变化。对模型进行回归系数显著性检验(表3),由此可知,时间、温度、硫酸浓度的一次项,温度的二次项和硫酸浓度的二次项对平均聚合度的影响极显著。依据一次项回归系数绝对值的大小可知,因素的主效应关系为:温度>时间>硫酸浓度。
根据模型的回归方程,固定一个因素在编码值0的水平,分析另外两个因素对平均聚合度的影响,Design Expert软件生成3个三维响应面(图8~图10)。从图8可以看出,硫酸浓度在7.5%时,温度和时间对总糖含量的影响。从图9可以看出,温度在60℃时,时间和硫酸浓度对总糖含量的影响。从图10可以看出,时间在240min时,温度和硫酸浓度对总糖含量的影响。

图8 温度和时间对平均聚合度影响的响应面

图9 硫酸浓度和时间对平均聚合度影响的响应面

图10 硫酸浓度和温度对平均聚合度影响的响应面
2.3.2 优化 本实验的目的在于保证快速、稳定地降解到适当的平均聚合度的同时获得最高的总糖含量,以获得高的产率与活性,因此优化方法选择固定平均聚合度在 3000,同时取总糖含量最大。用Design Expert软件进行优化,时间、温度和硫酸浓度都选择在本实验范围内;总糖含量的目标选择最大,重要性选择+++++,最低值选择29.6227mg/mL,最高值选择34.2475mg/mL,权重选择1;平均聚合度的目标选择3000,权重选择1。
优化的结果为:时间171min,温度64℃,硫酸浓度7.3%。在这个条件下获得的总糖含量为33.362mg/mL,同时平均聚合度为3000。
2.3.3 验证实验 按实验优化条件下进行验证实验(如表4)得到的总糖含量为32.192mg/mL,平均聚合度为2906,接近且都略低于Design Expert软件分析得到的预测值。由此证明实验模式合理,实验结果理想。

表4 验证实验条件和结果
3 结论
3.1 本实验利用 Design Expert软件,采用 Central Composite Design建立总糖含量回归模型:Y1=33.34 -0.18x1-0.46x2-0.22x3-0.17x1x2+0.24x1x3+ 0.035x2x3-0.077-0.15-1.55以及平均聚合度回归模型:Y2=3106.99-407.18x1-1797.52x2-406.01x3+140.26x1x2+73.90x1x3+204.91x2x3+74.45+ 372.51-266.67,两个方程拟合程度良好,实验误差小。
3.2 利用模型的响应面及其等高线对影响总糖含量和平均聚合度的关键因子及其相互作用进行探讨,优化出了在目标平均聚合度下获得最高总糖含量的条件为:时间171min,温度64℃,硫酸浓度7.3%,所得到的总糖含量为 32.192mg/mL,平均聚合度为2906。
3.3 本实验将化学法测定平均聚合度与高效液相色谱法相结合,发现该方法可以简便、快捷、稳定地评价降解程度。
3.4 本实验在研究如何利用南瓜果肉资源,增加南瓜附加值的基础上,探索了利用酸降解南瓜多糖制备低聚糖的方法及可能遇到的问题,为后续研究应用其他途径降解南瓜多糖奠定了基础。
[1]赵一鹏,李新峥,周俊国.世界南瓜生产现状及其种群多样性特征[J].内蒙古农业大学学报,2004,25(3):113.
[2]刘志强,傅承新,杨志坚,等.食用菌深层发酵法制备南瓜汁脱糖营养液工艺研究[J].食品科学,2003,24(9):88-91.
[3]Hu K,Liu Q,Wang S,et al.New oligosaccharides prepared by acid hydrolysis of the polysaccharides from Nerium indicum Mill and their anti-angiogenesis activities[J].Carbohydrate Research,2009,344:198-203.
[4]Hidaka H,Tashir Y,Eida T.Proliferation of bifidobacteria by oligosaccharides and their useful effect on human health[J]. Bifidobact Microflora,1991,10(1):65-79.
[5]Solange I,Mussatto IM.Non-digestible oligosaccharides:A review[J].Carbohydrate Polymers,2007,68:587-597.
[6]Montserrat R,Alicia S.Oligosaccharides:application in infant food[J].Early Human Development,2001,65:43-52.
[7]Robert AR,Vatsala M.Prebiotics and synbiotics:towards the next generation[J].Current Opinion in Biotechnology,2002,13: 490-496.
[8]付才力.南瓜糖肽和木葡聚糖的分离纯化及其功能研究[D].中国农业大学,2006.
[9]Dubois,Gilles,Hamilton,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28:350-356.
[10]Robertson JA,Ryden P,Botham RL,et al.Structural properties of diet-derived polysaccharides and their influence on butyrate production during fermentation[J].British Journal of Nutrition,2001,81:219-223.
[11]王杏文.木聚糖的高温酸降解与酶降解[D].南京林业大学,2004.
Optimization of pumpkin polysaccharide hydrolysis process
DU Bing-jian,LI Quan-hong*
(College of Food Science and Nutritional Engineering,China Agricultural University Engineering Research Centre for Fruits and Vegetables Processing,Ministry of Education Key Laboratory of Fruits and Vegetables Processing,Ministry of Agriculture,Beijing 100083,China)
Pumpkin is rich in resources.In this study,for the use of the pumpkin polysaccharides one of the main component of pumpkin,response surface methodology was applied to study the effect of time(x1),temperature (x2)and acid concentration(x3)on the acidic hydrolysis of pumpkin polysaccharide oligosaccharide process on the preparation.A time of 171min,temperature of 64℃;sulfuric acid concentration of 7.3%were thought to be optimal.These conditions resulted in a total sugar concentration of 33.362mg/mL,while the average degree of polymerization of 3000,as a result to the protection of polysaccharide content of pumpkin polysaccharide while achieving the purpose of controllable degradation.These results help in the deep processing and utilization of pumpkin,and increasing the added value by a new way.
pumpkin;polysaccharide;acidic hydrolysis;response surface
TS255.1
B
1002-0306(2011)03-0232-05
南瓜属于葫芦科南瓜属,发源于北美洲,在世界各地都有种植,亚洲种植面积最多[1]。我国每年利用南瓜籽数千吨,但对南瓜果肉资源利用十分有限。南瓜籽与果肉部分(扣除皮、瓤)质量比为1∶30~1∶45,果肉部分作为粉剂或者廉价饲料利用不到30%,有近70%因得不到有效利用而被弃掉,造成了浪费与污染[2]。南瓜的含水量接近90%,碳水化合物含量占干物质2/3,其中以大分子的南瓜多糖为主,分子量从数万到数百万道尔顿不等,单糖组成包括半乳糖、阿拉伯糖、葡萄糖、鼠李糖、木糖等。南瓜多糖聚合度高、分子空间体积大、生物利用度低,极大地限制了南瓜多糖在食品、医药和化工等产业的应用[3]。低聚糖具有多种生物活性,在日本、欧洲以及美国拥有巨大的市场[4-7]。通过可控的酸降解南瓜多糖,生产南瓜低聚糖,将有效推进南瓜肉质资源的开发利用,实现南瓜农产品的深加工,增加其附加值。为了能高效的制备南瓜低聚糖,本文在单因素实验的基础上,运用响应面法研究了硫酸浓度、时间、温度对总糖含量和平均聚合度的影响及交互作用,优化了南瓜多糖酸水解的工艺。
2010-03-03 *通讯联系人
杜秉健(1985-),男,在读硕士,主要从事天然产物提取与开发的研究。
国家自然科学基金面上项目(30972047)。

