星形胶质细胞和神经元之间谷氨酰胺的转运研究现状
王红 王栓科 汪静
兰州大学第二医院骨科研究所,兰州 730000
星形胶质细胞和神经元之间谷氨酰胺的转运研究现状
王红 王栓科 汪静
兰州大学第二医院骨科研究所,兰州 730000
从谷氨酰胺的星形胶质细胞排除到神经元对其进行摄取,谷氨酸-谷氨酰胺循环是必不可少的一步,这也是神经元补充谷氨酸的主要途径。本文主要是对参与这一过程的谷氨酰胺转运体的类别和功能做一综述。体内大多数参与谷氨酰胺转运的转运体是相互关联的,许多属性都是相同的,如都对微小p H值变换很敏感等。介导成人大脑中谷氨酰胺转运的转运系统主要是N转运系统(S N1)和A转运系统(S A T/A T A),它们都是AAAP转运家族的成员。它们之间主要的区别就是生理条件下S N1对谷氨酰胺转运是可逆的,这使得S N1既可以维持星形胶质细胞内谷氨酰胺的浓度梯度,也可介导谷氨酰胺的净外流。但在增值的星形胶质细胞内,S N1的功能被A S C T2取代。
神经胶质细胞;神经元;谷氨酸-谷氨酰胺循环;A转运系统;N转运系统
astrocyte; neuron; glutamate-glutamine cycle; system A transport; system N transport
谷氨酸是大脑兴奋性突触传递的重要神经递质,释放到突触间隙的谷氨酸被星形胶质细胞重摄取后被酰胺化为一种非兴奋性神经递质谷氨酰胺,谷氨酰胺被释放到细胞外间隙,被神经元重摄取后转化为谷氨酸[1,2]。这种将谷氨酰胺从星形胶质细胞转移到神经元的过程就是大家熟知的谷氨酸-谷氨酰胺循环。但在此过程中谷氨酰胺的转移到底是如何被介导和调控的直到现在还未达成共识,且谷氨酰胺还和其他许多中性氨基酸共用转运通道。
目前,对它们的研究有了很大的进展。首先,在星形胶质细胞和神经元内的谷氨酰胺转运的功能性研究已经定位到特定的转运体上。其次,对氨基酸转运蛋白新家族鉴定的突飞猛进,使我们可以单独的对这些谷氨酰胺转运体进行研究。本综述主要是对参与谷氨酰胺在细胞间转运的转运体的最新进展进行阐述。
1. 谷氨酸-谷氨酰胺循环
星形胶质细胞和神经元是代谢偶联的,其中最重要的途径之一是谷氨酸-谷氨酰胺循环。研究表明,谷氨酸-谷氨酰胺循环并不是完全封闭的[3]。因为谷氨酸不能穿过血脑屏障,所以中枢神经系统(C N S)中谷氨酸是葡萄糖经糖酵解和三羧酸循环,由三羧酸循环的中间物合成的。在此过程中需丙酮酸羧化酶的作用,但该酶在神经元中不存在,而大量存在于星形胶质细胞中并有功能性活性。谷氨酰胺的合成是谷氨酸-谷氨酰胺循环的重要部分。合成反应由谷氨酰胺合成酶催化,该酶只存在于星形胶质细胞,在少突胶质细胞中很少,神经元中不存在,因此它是星形胶质细胞的标志性酶。星形胶质细胞迅速摄取细胞外的谷氨酸[4],谷氨酸载体和谷氨酰胺合成酶在星形胶质细胞中的重叠分布表明,在突触位置摄取释放的谷氨酸和在星形胶质细胞中转变为谷氨酰胺是紧密联系的[5]。谷氨酰胺从星形胶质细胞释放作为谷氨酸的前体在神经元中积累,在突触前末端转变成谷氨酸,进入小泡准备新一轮的兴奋反应。谷氨酸前体的返回保持了谷氨酸能神经元的谷氨酸水平。由于谷氨酸不能穿过血脑屏障,所以多余的谷氨酸必须通过T A C氧化降解后再从C N S 中排出,多余的谷氨酰胺经水解变成谷氨酸后也以相同的途径氧化降解。
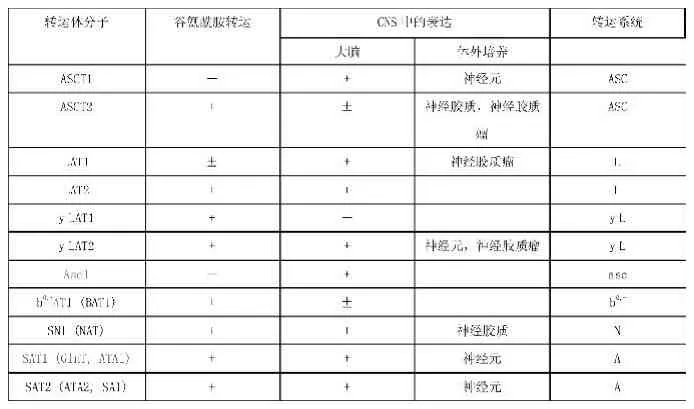
表1
2. 中性氨基酸转运体
谷氨酰胺转运体家族主要分为两类:钠离子依赖性和非钠离子依赖性。目前在中枢神经系统中已发现7个谷氨酰胺转运体家族,钠离子依赖性者包括s y s t e m A、s y s t e m N、s y s t e m y(+) L及A S C,s y s t e m B,非钠离子依赖性者包括s y s t e m L、s y s t e m b。前者主要依靠N a+-K+-A T P酶提供能量,进行膜内外谷氨酰胺的转运;后者转运谷氨酰胺不需要N a+提供能量[6]。近几年来,通过基因研究,获得几种编码转运蛋白的c D N A,并证实谷氨酰胺载体蛋白系统分属于4个不同的基因家族。如N a+依赖谷氨酰胺载体蛋白基因有:系统N(S N l)、系统A(A T A l,A T A2),系统A S C/B0 (A S C T2或A T B0),系统B0,+(A T B0,+)和系统y+L(y+L A T1,y+L A T2)。非N a+依赖谷氨酰胺载体蛋白基因编码系统L(L A T1,L A T2)和系统b0,+(b0,+A T),其中转运二性离子氨基酸用“0”上标,转运阳离子氨基酸用“+”上标[7]。具体见表[8]。
3.N和A转运系统的谷氨酰胺转运
在星形胶质细胞和神经元中,转运系统N和A对于谷氨酰胺的转运作用最重要。培养的小鼠星形胶质细胞中的谷氨酰胺转运分析结果[9]显示,N系统是谷氨酰胺摄取的主要通路。在脑组织,S N1 m R N A和载体蛋白仅限于胶质细胞,S N1位于神经元细胞。通过研究肝腺泡发现,末梢静脉周围的肝细胞质膜富含S N1载体蛋白及谷氨酰胺合成酶,并且很活跃。S N1介导谷氨酰胺摄取的 K m值大约是1.1±1.6 m m,说明S N1对谷氨酰胺摄取的过程不受膜去极化的影响。这种H+交换必将导致p H值的变化,这与谷氨酰胺摄取的p H依赖是一致的[10]。 更重要的是在生理水平下谷氨酰胺/H+交换是可逆的。神经元活动增加将降低星形胶质细胞内N a+和H+浓度梯度,最终通过S N1转运导致谷氨酰胺外流,使得星形胶质细胞内谷氨酰胺的重新分布[9]。
上述星形胶质细胞对谷氨酰胺的转运主要是通过S N1,但是在神经元主要是通过A系统。在过量的M e A I B不能抑制原代培养小鼠星形胶质细胞谷氨酰胺的吸收,说明其缺乏A系统介导的摄取。鼠S A T1/A T A1主要分布于神经元,在大脑和脊髓广泛表达[11],在突触小泡很少。原代培养大鼠小脑颗粒细胞中有S A T1的/ A T A1表达,但星形胶质细胞中却没有。人A T A1 m R N A(9 k b)仅在胎盘和心脏有表达。在脑组织,无论鼠A T A1及A T A2均限于神经元,胶质细胞中不存在,与S N1、A S C T2/A T B0分布不同,后者在脑组织中仅表达在胶质细胞中。
4. p H值对N和A转运系统的影响
神经元的电活动使得星形胶质细胞H+、N a+和跨膜电位梯度下降,促使谷氨酰胺通过S N1[9]排除。活跃神经元释放K+使星形胶质细胞发生去极化,从而加速了电依赖的N a+- H CO3-同向转运体对H CO3
-的转运。这将使得星形胶质细胞内部发生碱化,并促使谷氨酸-谷氨酰胺循环大量激活,从而加速了谷氨酸的摄取以及谷氨酰胺的合成[12]。碱化过程必然伴随着对应的细胞外酸化,导致跨膜H+梯度下降或反转,促进S N1介导的谷氨酰胺外流交换H+。接下来我们还需进一步对S N1转运体的能学进行研究,以便于我们更好模拟细胞活动变化对电化学梯度的影响,以及对谷氨酰胺外流的作用。相比于S N1,没有迹象表明p H值变化可通过S A T1/A T A1或S A T2/A T A2扭转谷氨酰胺转。S A T/A T A转运体主要的功能是在细胞质内储积谷氨酰胺,尤其是在神经元。然而,当p H值从7.4下调到7.0时,S A T1/A T A1或S A T2/A T A2转运速率下降一半,但当上调到7.8时,速率明显加快,将近翻了一倍[11]。 这种酸碱度敏感性的机制尚不太清楚。对系统A的功能研究发现[13],细胞内和细胞外p H改变也可导致类似情况发生,表明是依赖p H感受器调节的,而不是H+的浓度梯度。到目前为止,表达性研究还是证明不了是通过S A T/A T A转运体导致的H+转移。
5. 小结
在成人脑组织中,星形胶质细胞和神经元之间谷氨酰胺转移主要是由N转运系统(S N1)和A转运系统(S A T/ A T A)介导的,它们都是A A A P转运家族的成员,在形态和功能上是相联系的,如在生理范围内,都对微小的p H变化敏感等。两者主要的区别在于在生理条件下,S N1对谷氨酰胺的内流转运表现为稳定的可逆性,这可维持星形胶质细胞内的谷氨酰胺浓度梯度,且可调节谷氨酰胺的净外流。虽然在过去的十几年中研究者对于星形胶质细胞和神经元之间谷氨酰胺转运的研究取得了一定的成就,但要进一步了解其机制,仍有很长的一段路要走。
[1] Hertz L., Dringen R., Schousboe A. andRobinson S. R. (1999) Astrocytes: Glutamateproducers for neurons. J. Neurosci. Res. 57,417-428
[2] Magistretti P. J., Pellerin L., Rothman D.L. and Shulman R. G. (1999)Energy ondemand. Science 283, 496-497.
[3] Hertz L;Yu ACH;Kala G Neuronal-astrocyticand cytosolic-mitochondrial metabolite traffickingduring brain activation, hyperammonemia andenergy deprivation
[4] Suchak SK;Baloyianni NV;Perkinton MS The'glial' glutamate transporter, EAAT2 (Glt-1)accounts for high affinity glutamate uptake intoadult rodent nerve endings
[5] Ventura R.Harris KM Three-dimensionalrelationships between hippocampal synapses andastrocytes 1999
[6] Bode BP.Recent moIecuIar advances inmammalian gIutamine transport.J Nutr,2001,131(9 Suppl):2475S-2485S
[7] 周济宏.谷氨酰胺转运载体的种类与分布及功能特点.医学研究生学报.第20 卷第4期,2007 年4 月
[8] Stefan Bro è er and Neville Brookes,Transfer of glutamine between astrocytes and Neurons,Journal of Neurochemistry,2001,77,705-719
[9] Chaudhry F. A., Reimer R. J., Krizaj D.,Barber D., Storm-Mathisen J.,Copenhagen D. R.and Edwards R. H. (1999) Molecular analysis of System N suggests novel physiological roles in nitrogen metabolism and synaptic transmission.Cell99,769-780
[10] Nagaraja T. N. and Brookes N. (1996)Glutamine transport in mouse cerebral astrocytes.J. Neurochem.66,166-1674
[11] Varoqui H., Zhu H., Yao D., Ming H. and Erickson J. D. (2000) Cloning and functional identication of a neuronal glutamine transporter.J. Biol. Chem.275,4049-4054
[12] Brookes N. (2000) Functional integration of the transport of ammonium, glutamate and glutamine in astrocytes. Neurochem. Int.37,121-129
[13] Yao D., Mackenzie B., Ming H., Varoqui H., Zhu H., Hediger M. A. and Erickson J. D.(2000) A novel system A isoform mediating Na1/neutral amino acid cotransport. J. Biol.Chem.275,22790-22797
Research Status of the Transfer of glutamine between astrocytes and neurons
Wang hong Wang shuan-ke Wang jing
Institute of Orthopedics,Lanzhou University Second Hospital,Lanzhou 730000,China
The export of glutamine from astrocytes, and the uptake of glutamine by neurons, are integral steps in the glutamate-glutamine cycle, a major pathway for the replenishment of neuronal glutamate. We review here the functional and classification of the transporters that mediate this transfer. The participating glutamine transporters are functionally and structurally related, sharing the following properties,such as they are sensitive to small pH changes in the physiological range. The emerging picture of glutamine transfer in adult brain is of a dominant pathway mediated by system N transport (SN1) in astrocytes and system A transport (SAT/ATA) in neurons, they are members of the AAAP family of transporters. A key difference between SN1 and the SAT/ATA transporters is the reversibility of glutamine fluxes via SN1 under physiological conditions, which allows SN1 both to sustain a glutamine concentration gradient in astrocytes and to mediate the net outward flux of glutamine. It is likely that the ASCT2 transporter displaces the SN1 transporter as the main carrier of glutamine export in proliferating astrocytes.
10.3969/j.issn.1001-8972.2011.13.078

