响应面法优化酶法制备花生蛋白的工艺研究
谈佳玉 王承明
(华中农业大学食品科技学院,武汉 430070)
响应面法优化酶法制备花生蛋白的工艺研究
谈佳玉 王承明
(华中农业大学食品科技学院,武汉 430070)
以花生粕为原料,对在乙醇水溶液中利用α-淀粉酶制备花生蛋白的工艺条件进行了研究。探讨乙醇体积分数、加酶量、pH、酶解温度、酶解时间、液料比6个因素对可溶性总糖提取率的影响,试验表明乙醇体积分数、酶解时间、pH和液料比对提取过程影响较大。通过Box-Behnken中心组合试验和响应曲面分析法优化工艺条件:pH 5.95、酶解时间52 min、液料比13.8∶1、乙醇体积分数76%、加酶量0.5%、酶解温度35℃,总糖提取率为13.06%。对此工艺条件进行验证得到蛋白质纯度为70.29%,而单纯的乙醇溶液提取法蛋白质纯度为62.03%。
花生浓缩蛋白 α-淀粉酶 响应曲面法
花生是全球最重要的四大油料作物之一[1],我国是全球最大的花生生产国,产量稳定在1 500万t左右。在我国花生除直接食用外,主要用于榨油,每年在榨油后能得到超过900万t的花生粕[2]。花生粕营养价值较高,通常含有40% ~50%的蛋白质。花生粕的花生蛋白是一种很好的植物蛋白,它含有人体所需的8种必须氨基酸,且易为人体消化吸收,并含有比大豆蛋白更少的抗营养因子[3],花生蛋白在食品中具有广泛的应用。
花生粕除了含有丰富的蛋白质,还含有较多的碳水化合物,在花生蛋白的制备过程中加入淀粉酶,可以降解花生粕中的碳水化合物,有利于花生多糖的浸出,从而提高花生蛋白的纯度。常用糖的提取剂有水、乙醇水溶液,本试验选择乙醇水溶液作为提取剂,可以减少花生粕中水溶性蛋白的流失,提高了花生蛋白的纯度。
试验以脱壳高温榨油后的花生粕为原料,采用以乙醇水溶液为提取剂,α-淀粉酶辅助制备花生蛋白。以总糖提取率为指标,利用单因素试验和响应曲面设计法分析不同因素对总糖提取效果的影响,并对提取工艺进行了条件优化。
1 材料与方法
1.1 材料与试剂
花生粕由山东龙大集团公司提供,粉碎后过60目筛,石油醚回流,95%乙醇回流,晾干备用。
α-淀粉酶(生化试剂BR):酶活性≥30 000 U/g,北京双旋微生物培养基制品厂。
葡萄糖、浓硫酸、苯酚、考马斯亮蓝、无水乙醇等:国产分析纯试剂。
1.2 仪器与设备
AL204电子天平、320-S pH计:梅特勒-托利多仪器(上海)有限公司;TDL-5A型离心机:上海菲恰尔分析仪器有限公司;722型可见分光光度计:津普瑞斯仪器有限公司;恒温水浴锅:金坛市杰瑞尔电器有限公司。
1.3 试验方法
1.3.1 原料成分测定
脂肪含量的测定:索氏抽提法(GB/T 6432—1994);蛋白质含量的测定:微量凯氏定氮法(GB/T 5009.5—1985)(氮对蛋白的转换系数为5.46);灰分含量的测定:灼烧法(GB/T 14770—1993);水分含量的测定:恒重法(GB/T 5009.3—2003);总糖含量的测定:苯酚 - 硫酸法[4]。
1.3.2 花生浓缩蛋白的制备工艺
称取适量已处理过的原料于三角瓶中,加入一定比例、一定体积分数的乙醇,调节至一定的pH值,按一定比例添加α-淀粉酶,恒温水浴,然后沸水灭酶5 min,室温下离心10 min(4 000 r/min),将滤液定容后测定总糖含量和可溶性蛋白的含量。
1.3.3 总糖含量的测定及标曲绘制
总糖含量的测定,苯酚-硫酸法[5],得可溶性糖的标准曲线,其回归方程为:Y=7.12x-0.035 1(r=0.999 8)。
总糖提取率=总糖含量/花生粕干质量×100%
1.3.4 可溶性蛋白含量的测定及标曲绘制
可溶性蛋白质的测定,考马斯亮蓝G-250染色法[6],得可溶性蛋白质的标准曲线,其回归方程为:Y=5.225x -0.006 1(r=0.999 9)。
蛋白质提取率=蛋白质溶出量/花生粕干质量×100%
1.3.5 单因素试验
以滤液中的总糖含量和可溶性蛋白含量为评价指标,研究不同乙醇体积分数、液料比、加酶量、酶解时间、酶解温度及pH对制备花生浓缩蛋白的主要影响。
1.3.6 响应曲面的组合试验
根据单因素的试验结果,利用Design-Expert 7软件进行Box-Behnken中心组合试验设计,优化花生浓缩蛋白的制备工艺。
2 结果与讨论
2.1 花生粕的主要成分
从表1可以看出花生粕中的主要成分是蛋白质和糖类,其中蛋白质含量较高,约占50%。

表1 花生粕的主要成分
2.2 酶法制备花生浓缩蛋白的单因素分析
2.2.1 酶解温度对总糖提取率和蛋白质溶出率的影响
固定乙醇体积分数80%,液料比20∶1,加酶量为0.5%,pH 6.0,酶解时间 60 min,酶解温度分别设定为30、35、40、45、50、55 ℃,结果见图 1。由图 1 可以看出总糖提取率在35℃时达到最高,随着温度的升高总糖提取率缓慢下降,这与在酶在有机溶剂中热稳定性大大提高有关[7]。当温度升高到55℃时,总糖提取率急剧下降,这主要是因为当反应温度超过酶的最适温度时,酶容易发生变性而钝化,使得酶解反应速度降低。随着温度的升高,蛋白质溶出率无多大变化,说明温度对蛋白质溶出率的影响很小。所以,选择酶解温度为35℃。
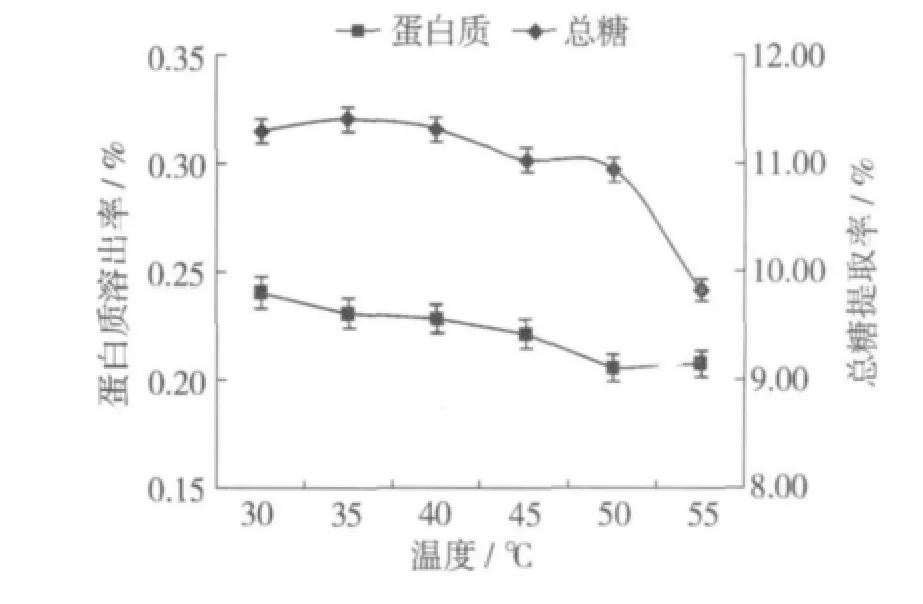
图1 酶解温度对总糖提取率和蛋白质溶出率的影响
2.2.2 pH对总糖提取率和蛋白质溶出率的影响
固定乙醇体积分数80%,液料比20∶1,加酶量为0.5%,酶解温度为40℃,酶解时间60 min,pH值分别设定为 5.0、5.5、6.0、6.5、7.0、7.5,结果见图 2。
酶的催化能力与pH有较大的关系,由图2可以看出,当pH 6.0时总糖提取率最高,pH 7.5时总糖提取率下降较多。随着pH的升高,蛋白质溶出率缓慢增加,符合蛋白质的碱溶性。在pH 6.0时,总糖提取率最高而蛋白质溶出率较低,故选择pH 6.0为宜。
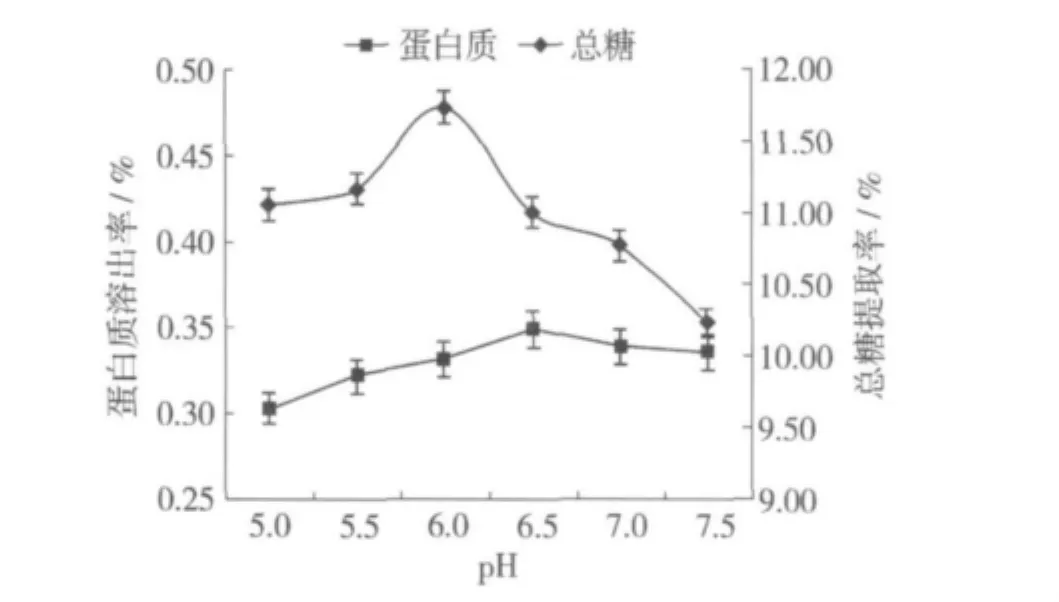
图2 pH对总糖提取率和蛋白质溶出率的影响
2.2.3 加酶量对总糖提取率和蛋白质溶出率的影响
固定乙醇体积分数80%,液料比20∶1,pH 6.0,酶解温度为40℃,酶解时间60 min,加酶量分别设定为 0.3%、0.4%、0.5%、0.6%、0.7%、0.8%,结果见图3。
酶的添加量直接反应酶促反应的速度。由图3可以看出随着加酶量的增加,提取率逐渐提高,加酶量为0.5%时,总糖提取率最高,之后,提取率逐渐下降。这主要是因为淀粉酶在水解过程中水解产物对酶有一定的抑制作用[8]。当产物浓度不断增加,抑制作用增大,使得酶活性下降,所以上清液中可溶性总糖的含量减少。在加酶量为0.5%时,总糖提取率较高而蛋白质溶出率较低。
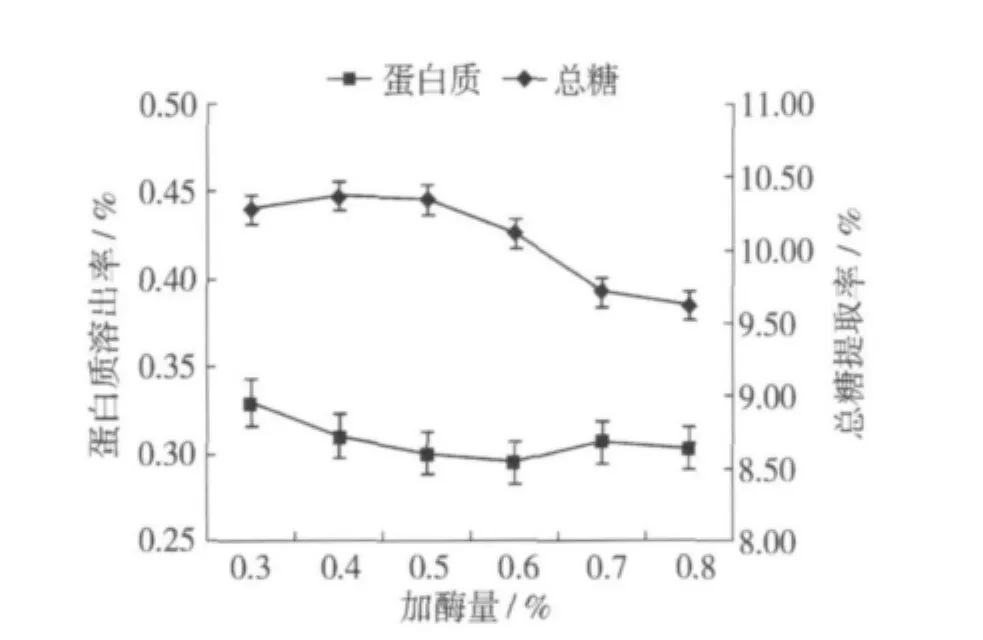
图3 加酶量对总糖提取率和蛋白质溶出率的影响
2.2.4 酶解时间对总糖提取率和蛋白质溶出率的影响
固定乙醇体积分数80%,液料比20∶1,pH 6.0,酶解温度为40℃,加酶量0.5%,酶解时间分别设定为 30、45、60、75、90、105 min,其结果见图 4。
由图4可以看出,随着酶解时间的延长,总糖提取率逐渐上升,60 min时达到最大。酶解60 min后总糖提取率下降,主要原因是酶的活力随时间的延长而相对下降。
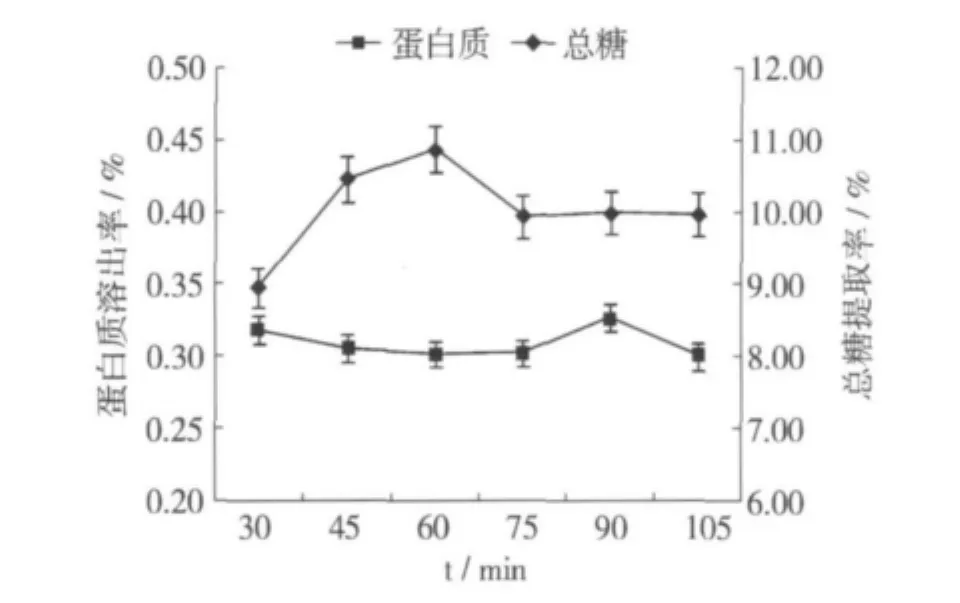
图4 酶解时间对总糖提取率和蛋白质溶出率的影响
2.2.5 液料比对总糖提取率和蛋白质溶出率的影响
固定乙醇体积分数80%,pH 6.0,酶解温度为40℃,加酶量0.5%,酶解时间60 min,液料比分别设定为 10∶1、15∶1、20∶1、25∶1、30∶1、35∶1,其结果见图5。
液料比直接影响酶与底物相互作用几率的大小。小的液料比有利于酶与底物的相互接触,但是液料比小,溶液的黏度就大,影响传质过程的进行[9]。图5表明随着液料比的增大,总糖提取率逐渐增加,在液料比为15∶1时达到最大值,而后提取率缓慢下降,主要因为反应体系中水分较多时,酶的浓度会相应下降,糖的浸出速率也随之下降。蛋白质溶出率随着液料比的增加而缓慢下降。故选取液料比15∶1为宜。
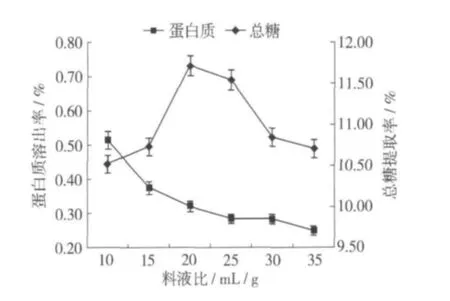
图5 液料比对总糖提取率和蛋白质溶出率的影响
2.2.6 乙醇体积分数对总糖提取率和蛋白质溶出率的影响
固定pH 6.0,酶解温度为40℃,加酶量0.5%,酶解时间60 min,液料比20∶1,乙醇体积分数分别设定为60%、70%、80%、90%、100%,其结果见图6。
酶在完全无水的溶剂中通常没有活性,只有吸收一定水分酶才能表现其活性,所以体系中的水分对酶的催化反应有着重要的影响。图6表明随着乙醇体积分数不断降低,体系含水量增加时,总糖提取率也不断增加。酶活性只取决于被酶分子吸收的水分而与溶剂的水含量无关[10]。当乙醇体积分数达到80%后继续降低时,上清液中的总糖含量只是缓慢增加。蛋白溶出率随着乙醇体积分数的增加急剧下降。综合考虑总糖提取率和蛋白质溶出率,选取乙醇体积分数为80%为宜。
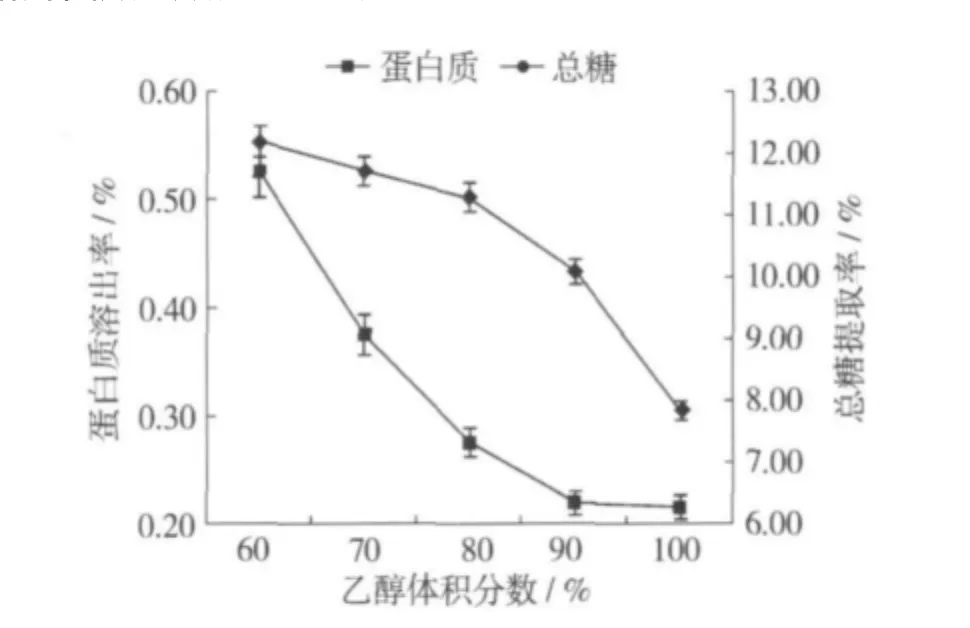
图6 乙醇体积分数对总糖提取率和蛋白质溶出率的影响
2.3 响应曲面的试验设计与结果分析
2.3.1 试验设计方案与结果分析
根据单因素分析结果,加酶量与酶解温度对总糖提取率的影响不是很显著,因此选择加酶量为0.5%,酶解温度为35℃。选取乙醇体积分数、pH、液料比、酶解时间对总糖提取率的影响较显著的4个因素,进行4因素3水平的Box-Behnken中心组合试验设计,试验因素和水平见表2,试验设计及多糖提取率结果见表3。
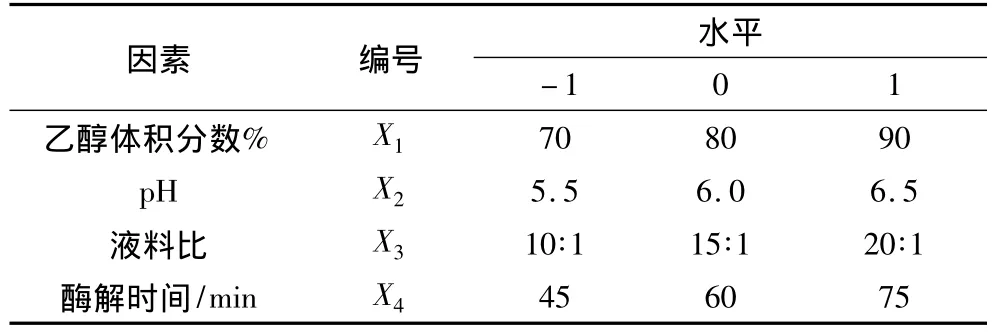
表2 试验因素和水平
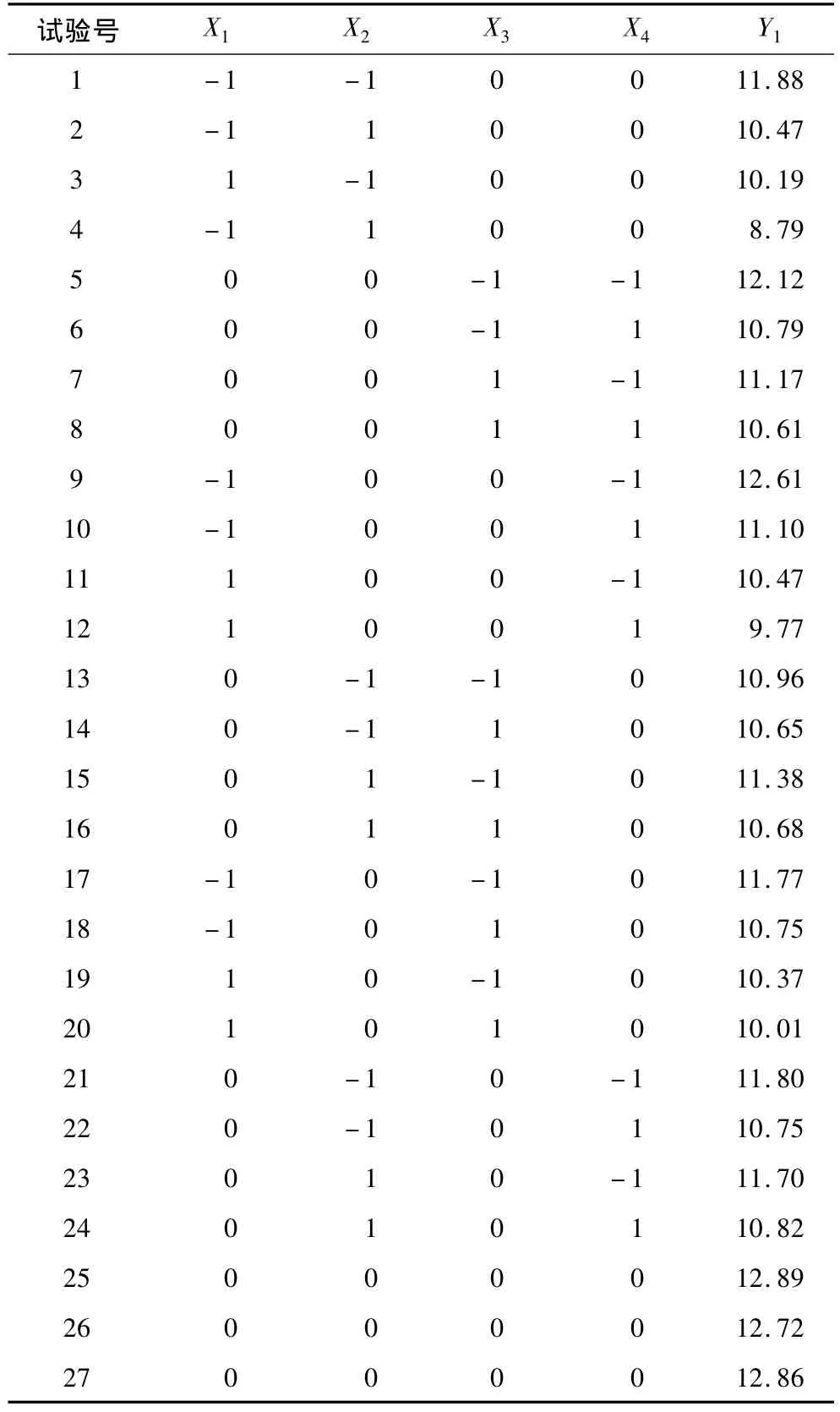
表3 Box-Behnken 试验设计及结果
利用Design-Expert软件对表3中的试验数据进行回归分析,得到总糖提取率对以上4个因素的回归方程为:
总糖提取率 Y=12.823 33-0.748 333X1-0.199 167X2-0.293 333X3-0.502 5X4-1.289 583 X1X1+0.002 5X1X2+0.165X1X3+0.202 5X1X4-1.053 333 X2X2- 0.097 5X2X3+0.042 5X2X4-0.904 583X3X3+0.192 5X3X4-0.598 333X4X4
对回归模型进行方差分析,结果见表4。
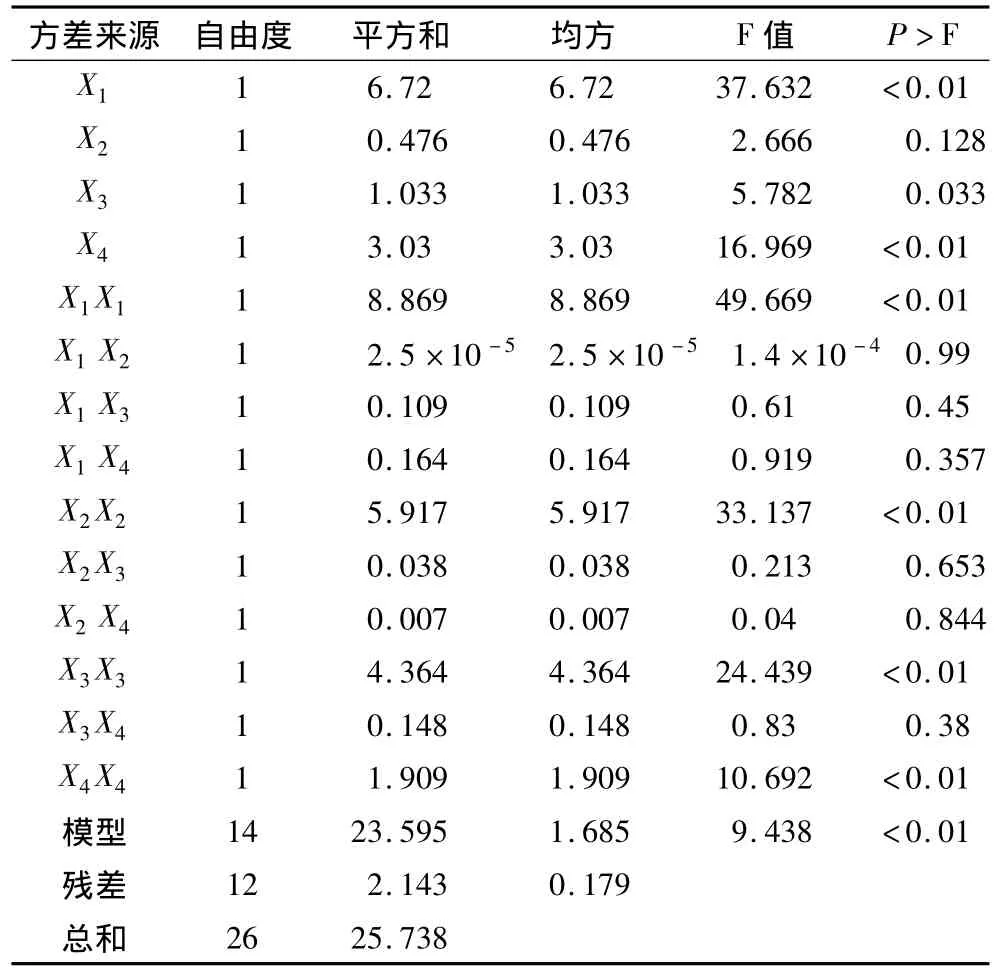
表4 回归模型方差分析
由表4可知,回归模型极显著(P<0.01)。模型一次项X1、X4极显著,X3显著,X2不显著,且显著顺序是X1(乙醇体积分数)>X4(酶解时间)>X3(液料比)>X2(pH);二次项均极显著,表明各具体试验因素对响应值的影响不是简单的线性关系。各试验因子与响应值的关系中,其因变量和全体自变量之间的相关系数 R=23.594 98/25.737 85 ×100%=91.67%,说明总糖提取率变化有91.67% 来源于所选的变量(乙醇体积分数、pH、液料比和酶解时间),且还存在其他的干扰因素。整体分析来看,回归模型的拟合程度较好,可以用上述回归方程对α-淀粉酶制备花生浓缩蛋白的试验结果进行分析预测和确定最佳提取工艺条件。
2.3.2 最佳提取工艺条件的确定
为进一步确定个因素的最优条件,对回归方程取一阶偏导数等于零解方程组得X1=-0.346 78,X2= -0.094 17,X3= -0.244 15,X4= -0.521 22,即α-淀粉酶制备花生浓缩蛋白最优条件为乙醇体积分数 76.53%,pH 5.952,液料比 13.779∶1,酶解时间52.181 min。在此条件下总糖提取率的预测值为13.12%。
2.3.3 回归模型的验证试验
考虑到实际操作的情况,将最优条件修正为:乙醇体积分数 76%,pH 5.95,液料比 13.8∶1,酶解时间52 min,在此条件下重复3次,测得总糖提取率分别为 12.93%、13.07%、13.17%,总糖提取率试验值为13.06%,与预测值相比,其误差为0.46%。因此采用响应面法优化得到的最佳条件可靠。
2.3.4 酶为介质乙醇溶液提取法与乙醇溶液提取法的比较
以花生粕为原料,在上述酶法优选工艺条件下,得到的花生蛋白纯度为70.29%,而以不加酶直接用乙醇水溶液提取得到的花生蛋白纯度为62.03%。表明α-淀粉酶在高体积分数的乙醇水溶液中也具有一定的活性,能降解淀粉,提高了糖类物质的浸出率,从而提高了花生蛋白的纯度。
3 结论
在醇法制备花生蛋白的基础上,本试验提出一种酶处理和乙醇提取同时进行的方法制备花生蛋白。试验表明,以酶为介质乙醇溶液制备花生蛋白受到多种因素的影响,包括乙醇体积分数、加酶量、酶解温度、酶解时间、pH、液料比等,其中乙醇体积分数、酶解时间、pH、液料比的影响较为显著。通过响应面法分析优化,得到最佳的工艺条件是:加酶量0.5%、pH 5.95、酶解温度35 ℃、酶解时间52 min、液料比13.8∶1、乙醇体积分数76%。此条件下,总糖提取率为13.06%,蛋白质纯度为70.29%。与醇法提取相比,本试验制备花生浓缩蛋白的条件更加温和,与水酶法制取相比,由于选择乙醇水溶液作为提取剂,不仅减少了花生蛋白的流失,而且使部分色素溶出,得到的花生浓缩蛋白纯度高且色泽好。
[1]高云中,张晖,李伦.高温花生粕蛋白提取及功能性质的研究[J].食品与发酵工业,2009,35(4):103-105
[2]梅娜,周文明,胡晓玉,等.花生粕营养成分分析[J].西北农业学报,2007,16(3):96 -99
[3]刘大川,胡小泓,张维农.花生粉、花生浓缩蛋白制备工艺及功能特征的研究[J].中国油脂,1996,21(3):5 -7
[4]李丹.苯酚-硫酸法测定食品总糖方法的应用和改进[J].中国卫生检验杂志,2003,16(3):506
[5]王明艳,王芳,杨树平.超声波技术用于薏米根多糖的提取[J].中国粮油学报,2006,21(6):59 -66
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社:197-198
[7]Zaks A,Klibanov A M.Enzymatic catalysis in organic media at 100 ℃[J].Science,1984,22(224):1294 -1251
[8]张驰松,袁永俊,王建.糖化过程中α-淀粉酶酶解动力学的研究[J].酿酒,2007,34(2):36 -39
[9]葛娜.酶法提取大米蛋白及其应用的研究[D].江苏:江南大学,2006
[10]杨缜,计亮年.低水有机介质中的酶催化[J].生物化学与生物物理进展,1994,21(2):98 -104.
Study on Optimized Enzyme-assisted Preparation Process of Peanut Protein by Response Surface Methodology
Tan Jiayu Wang Chengming
(College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070)
Preparation of peanut protein by α - amylase in the ethanol aqueous was studied.The effects of ethanol concentration,amylase amount,pH,temperature,time and ratio of liquid to material on extraction yield of total soluble sugar were explored.The result showed that ethanol concentration,extraction time,pH and ratio of liquid had great influence on the extraction process.The extraction process conditions were optimized by Box-Behnken centerunited experiment design and response surface methodology,and the result indicated that the optimum extraction conditions were ethanol concentration 76%,pH value 5.95,extraction time 52 min,ratio of liquid to material 13.8∶1,amylase amount 0.5%and extraction temperature 35 ℃,and the extraction yield of total soluble sugar was 13.06%.Under the optimized conditions the purity of peanut protein was 70.29%,and the purity of peanut protein was 62.03%without adding α - amylase.
peanut protein concentrate,α - amylase,response surface methodology
A
1003-0174(2011)08-0100-05
2010-09-26
谈佳玉,女,1983年出生,硕士,天然产物
王承明,男,1964年出生,教授,农业资源利用和食品安全

