发芽对大豆蛋白凝胶性质的影响
王素雅,赵甲慧,鞠兴荣,陈波
(南京财经大学食品学院,江苏省粮油食品检测与深加工重点实验室,江苏南京,210046)
发芽对大豆蛋白凝胶性质的影响
王素雅,赵甲慧,鞠兴荣,陈波
(南京财经大学食品学院,江苏省粮油食品检测与深加工重点实验室,江苏南京,210046)
研究了发芽大豆蛋白质凝胶性质的变化。采用碱提酸沉法制备大豆分离蛋白(SPI),以葡萄糖酸-δ-内酯(GDL)为凝固剂制备大豆蛋白凝胶,系统研究了不同芽长大豆蛋白凝胶强度的变化。通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱分析了发芽过程中SPI的变化及其对大豆凝胶强度的影响。结果发现:SPI中7S球蛋白的α'、α亚基和11S球蛋白的酸性亚基A3、A发芽时发生明显降解,但11S球蛋白各亚基在发芽初期变化小,利于大豆蛋白质分子之间形成网络结构使凝胶强度增强。随着发芽时间的延长,11S球蛋白也部分发生降解,凝胶强度下降。
发芽,SPI,大豆蛋白凝胶,SDS-PAGE
大豆是一种深受亚洲人民喜爱的良好食物来源,其不仅富含蛋白质、氨基酸组成比例合适,而且还含有丰富的不饱和脂肪酸、维生素、矿物质,以及大豆低聚糖、异黄酮、皂苷生理活性物质。但大豆组织坚固,且含有胰蛋白酶抑制因子、植物凝集素、植酸等抗营养因子,影响了人类对其营养素的充分消化和利用,因此需要适当加工后方可食用。
已有的研究表明发芽能调整大豆的营养结构,发芽后大豆中总蛋白[1]、必需氨基酸与非必需氨基酸含量增加[2],而纤维素、木质素减少[3]。发芽还能促进大豆中功能因子如大豆异黄酮[4]、VC、VB2、尼克酸、VB6、γ-氨基丁酸[5]、多酚[6]等增加,而降低抗营养因子如植物凝集素[7]、胰蛋白酶抑制因子的含量[8],从而大大提高大豆中各种营养素的消化利用率。
豆腐制品种类繁多,是大豆最重要的加工品种,也是大豆凝胶的重要表现形式。大豆凝胶是指大豆蛋白在加热变性后聚集形成的三维网络结构。凝胶强度反映大豆的凝固状态,是鉴定其品质高低的重要指标,而SPI是影响大豆凝胶形成的主要因素[9]。大豆发芽后,蛋白结构与功能性质发生变化,将影响大豆蛋白凝胶性能。因此,本文以大豆为原料,研究发芽过程中大豆凝胶性质随发芽时间和发芽长度的变化规律,并分离大豆分离蛋白,探讨大豆蛋白变化对其凝胶性能的影响。
1 原料、试剂及设备
1.1 实验原料与药品
1.1.1 原料
大豆:东北穆丰山,购自南京原粮市场;葡萄糖酸-δ-内酯(GDL):江苏常州康力食品添加剂厂。
1.1.2 药品
氢氧化钠,石油醚,乙醚,乙醇,次氯酸钠,甘油,异丙醇,苯酚,硫酸,甘氨酸,丙烯酰胺,N,N'-甲叉双丙烯酰胺,三羟甲基氨基甲烷 (Tris),四甲基乙二胺(TEMED),考马斯亮蓝 R250,十二烷基硫酸钠(SDS),过硫酸铵,β-巯基乙醇,溴酚蓝,以上所用试剂均为分析纯(AR)或生化试剂。
标准蛋白(protein marker):California Bioscience。
1.2 实验仪器设备
HG75-3型电热恒温两用箱,南京实验仪器厂;PHS-25型pH计,上海精密科学仪器有限公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;HH-6型恒温水浴锅,常州市国华电器有限公司;TDL-80-2B型离心分离机,上海安亭科学仪器厂;FW100型高速万能粉碎机,天津市泰斯特仪器有限公司;AIPHAI-4LDpluo真空冷冻干燥机,德国Marin Chris;DYY-12型电泳仪/电泳槽,北京市六一仪器厂;TA.XT2i型物性测试仪,英国Stable Micro Systems Ltd。
2 实验方法
2.1 大豆籽粒发芽
挑选大小均一、无虫蛀、无霉变、未破损的饱满大豆籽粒,用清水清洗3次,在25℃下用水(料液比1∶2,g∶mL)浸泡10 h,每2 h换一次水。将浸泡后的大豆籽粒置于25℃恒温培养箱中发芽,并根据发芽长度适时取样,以浸泡10 h的大豆籽粒(芽长0.0 cm)作为对照。
2.2 蛋白质含量测定
微量凯氏定氮法(GB5009.5-2003)。
2.3 GDL大豆凝胶的制备
将发芽大豆加水(料液比1∶6 g∶mL)磨浆,纱布过滤,豆浆在不断搅拌下小火煮沸3~5 min,脱气。向豆浆中加入2.8 g/LGDL并混匀,85℃保温20 min后,放入冰水中冷却成型,4℃冰箱保存备用。
2.4 大豆分离蛋白的制备[10]
发芽大豆→40℃烘干→磨粉→脱脂→烘干→碱提酸沉法提取SPI
2.5 GDL大豆分离蛋白凝胶制备[11]
60 g/L的SPI溶液 →90℃水浴加热15 min→加2.8 g/L GDL→80℃保温30 min→ 冷却 →4℃保存备用。
2.6 大豆凝胶强度测定
用TA-XT2i质构仪测定大豆凝胶与大豆分离蛋白凝胶的凝胶强度,主要参数如下:运行模式texture profile analysis(TPA);测前速度2.0 mm/s;测试速度1.0 mm/s;测后速度3.0 mm/s;穿刺距离10mm;时间2 s;数据采集速率200 pps;圆柱型探头(P/0.5)。凝胶破碎时受到的最大力作为凝胶强度指标,力越大凝胶强度越大[11]。
2.7 发芽前后大豆蛋白质分子变化的测定
SDS-PAGE法[12]:采用12%的分离胶和5%的浓缩胶,电泳时的电压200 V,电流100 mA,功率50 W。3~4 h后,待溴酚蓝刚刚迁移出凝胶底部时终止电泳,考马斯亮蓝染色12 h,将凝胶置于脱色液中漂洗,每隔2 h换一次脱色液,直至背景清晰为止。
3 结果与讨论
3.1 发芽过程中大豆芽长的变化
大豆发芽是一个复杂的生理生化过程,需要一系列酶的参与和消耗大量能量。大豆充分吸水后为各种酶提供了适宜的水环境,各种酶活力适度增加,种子呼吸作用加快,大豆子叶中储藏的脂肪、淀粉为萌发提供能量而蛋白质则提供氮源。由图1可以发现大豆发芽时生长速度分为2个阶段,即前36 h缓慢生长阶段和36~72 h快速生长阶段,这种情况是大豆内源酶活力不断增强的表现。
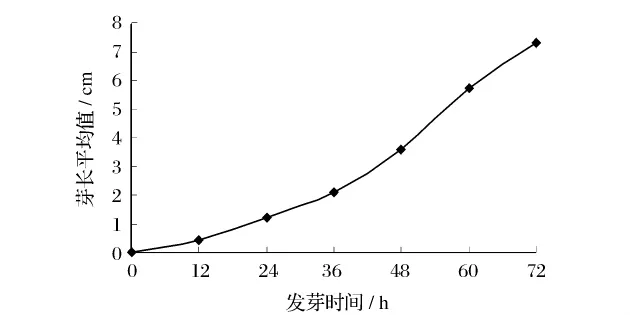
图1 发芽时间与大豆芽长的关系
3.2 发芽对大豆GDL凝胶性质的影响
大豆发芽后其凝胶性质的变化直接影响豆腐制品的品质,研究发芽后大豆凝胶性质的变化对于推广发芽大豆制品具有重要意义。因此,以葡萄糖酸内酯GDL为凝固剂研究了发芽过程中大豆凝胶强度的变化,结果见图2。由图2中可以看出,未发芽大豆GDL豆腐的凝胶强度为67.8 N,当芽长1.0 cm时凝胶强度增加至73.4N。但随着发芽时间的延长,豆芽长度增加,其大豆GDL豆腐的凝胶强度明显降低。当芽长超过5 cm时,GDL凝胶强度小于30 N,而芽长至7.0 cm时,凝胶强度降至16.8N,仅为最高凝胶强度的22%。该结果表明影响大豆凝胶结构的蛋白质发生明显变化。

图2 发芽对大豆GDL凝胶性质的影响
3.3 发芽对大豆蛋白质含量的影响
蛋白质不仅是大豆的主要营养组分,也是影响其加工性能的重要成分,发芽过程中蛋白质变化直接影响发芽大豆的加工性能与营养价值。由图3可以看出,在发芽初期,大豆蛋白质含量逐渐减少,发芽36 h时蛋白质含量最少为34.0%,然后大豆蛋白含量又有所增加,发芽72h时含量为37.6%。该实验结果与Lee等研究不完全一致,其发现发芽大豆中蛋白质含量明显增加[1]。蛋白质含量降低可能是浸泡过程中大豆部分可溶性氮溶于水中而产生的损失[13]。随着发芽过程的持续,大豆生长不断消耗能源物质脂肪,蛋白合成能力增强,蛋白质含量又重新增加。
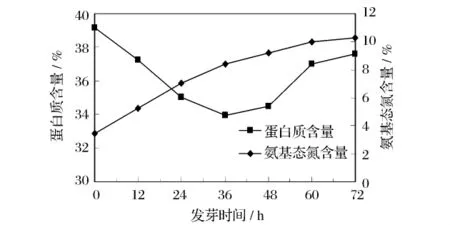
图3 发芽对大豆蛋白质与氨基态氮的影响
发芽大豆中氨基态氮含量随时间延长而持续增加,大豆中氨基态氮含量仅为3.5%,至发芽72 h时大豆氨基态氮含量增加到10.3%。分析认为氨基态氮不断增加是大豆内源性蛋白酶活性提高,对蛋白质水解能力增强,使相对分子质量较小的肽段增加并暴露出游离氨基端和羧基端的结果。这与李淑艳等[14]关于大豆中蛋白酶活性强弱与萌发种子中氨基态氮的含量密切相关的结论一致。这些结果表明发芽时大豆蛋白质发生部分降解,可溶性部分增加。
3.4 发芽对大豆分离蛋白凝胶性质的影响
为了更好的分析发芽过程中大豆蛋白对其凝胶强度的影响,研究分析了不同芽长大豆分离蛋白(SPI)的凝胶强度,结果见图4。

图4 发芽对大豆分离蛋白凝胶性质的影响
由图4可以看出,SPI的凝胶强度变化趋势与大豆一致,也是先上升后下降,芽长1.0 cm大豆SPI的凝胶强度最高为58.3N,而芽长7.0 cm的SPI凝胶强度降至14.8N,该结果表明大豆蛋白是影响大豆凝胶性能的直接因素。芽长1 cm大豆凝胶强度最高,可能是发芽中大豆内源蛋白酶活性增加,使大豆蛋白轻度水解而发生空间结构变化,使大豆蛋白某些基团暴露,利于相互作用形成网络结构,从而使大豆凝胶强度提高;但随着大豆蛋白质的不断降解,蛋白质聚合度减小,溶解性提高,不易形成网络结构,从而使大豆凝胶强度降低。
3.5 发芽对大豆SPI组成的影响
为了解大豆发芽前后蛋白质的降解情况,分析比较不同发芽阶段大豆SPI SDS-PAGE电泳图谱,可以推测大豆SPI亚基组成的变化,进而分析出大豆SPI的变化情况。
大豆SPI根据沉降系数的不同分为2S,7S,11S,15S蛋白,其中主要由7S和11S球蛋白组成,两者占SPI的70%以上。7S球蛋白分为β-大豆伴球蛋白、γ-大豆伴球蛋白和碱性7S球蛋白,其中β-大豆伴球蛋白是主要成分,所以通常又将7S球蛋白称为β-伴大豆球蛋白或伴大豆球蛋白[15]。7S球蛋白是三聚体即由α',α,β三个亚基组成,分子质量约为150~200 ku[16]。其各亚基的分子质量约为: α',78 ku;α,75 ku;β,47 ku[17],各亚基之间几乎无二硫键连接。
11S 球蛋白是六聚体单一球蛋白[15,18],分子质量约为320~380 ku。根据11S球蛋白氨基酸序列的特点将其 5个亚基分为 2组:Ⅰ(A1aB1b,A1bB2,A2B1a)和Ⅱ(A3B4,A5A4B3)。各亚基的分子质量约为:A3 ~37 ku,A1,A2,A4 ~34 ku,B3 ~23 ku,B1,B2,B4~22 ku[19]。每个亚基是由一条酸性多肽链A和碱性多肽链 B 通过二硫键连接而成的[17,19-20]。

图5 发芽大豆分离蛋白的SDS-PAGE电泳图谱
图5 中的1道为大豆蛋白的SDS-PAGE图谱,从上到下的区带分别是7S球蛋白(α',α,β)区带和11S 球蛋白(A3,A1A2A4,B3,B1B2B4)区带[19]。对比大豆发芽前后SPI电泳区带可知,发芽时大豆7S球蛋白的β亚基与11S球蛋白的碱性亚基B变化并不显著,而7S球蛋白的α'、α亚基与11S球蛋白的酸性亚基A3、A亚基在发芽时发生显著变化。虽然在发芽初期(24 h内)变化不明显,但发芽48h时区带逐渐模糊变细,至发芽72 h时趋于消失。同时发芽48 h和72 h大豆SPI电泳图谱中7S球蛋白的β亚基之上出现一条新的区带,11S球蛋白最小的B亚基区带处蛋白浓度明显增加。这些结果表明发芽后,内源蛋白酶对大豆7S球蛋白的α'、α亚基和11S球蛋白的酸性亚基A3、A作用强,使该部分蛋白相对分子质量较大的蛋白质亚基降解为相对分子质量较小的部分。11S球蛋白的碱性亚基变化并不明显,出现这种情况的原因可能有2个,一是碱性亚基受大豆内源蛋白酶影响较小,二是其他SPI降解形成与其相对分子质量相似的部分而在B区带处汇集。此外,从电泳图谱上还可以看到,发芽48 h时B区带下出现了相对分子质量更小的区带,发芽72 h时这种情况更为明显。总之,大豆发芽后11S球蛋白亚基比7S球蛋白亚基变化小,这可能与2种球蛋白的结构有关:7S球蛋白由3个亚基组成,容易受到外界条件影响而发生聚合和解聚;11S球蛋白由酸性亚基和碱性亚基构成2个环状六角形结构,具有一定的刚性,受外界影响较小[12]。
蛋白质尤其是SPI是大豆形成凝胶的主要因素,7S和11S具有胶凝性并对凝胶的形成具有决定性的影响[21],当其数量或比例发生变化可改变大豆的凝胶强度。11S主要靠二硫键和静电引力形成凝胶,7S主要靠氢键形成凝胶[22]。11S中含有比7S更多的二硫键,相当于增加了肽链的长度,使分子间相互缠绕的机会增多[23],因此11S组分对凝胶强度的影响高于7S组分[9]。凝胶形成过程中,蛋白质-蛋白质与蛋白质-溶剂相互作用会达到一定程度的平衡,而决定和控制这2种相互作用平衡程度的作用力如氢键,疏水作用,静电作用等也影响着凝胶的强度的改变。发芽初期大豆(芽长1.0 cm)的凝胶强度较未发芽大豆略有提高,这可能是发芽过程中蛋白酶活力提高,使大豆蛋白发生降解,肽键断裂,使分子内某些功能基团暴露出来,相邻的分子通过二硫键、氢键、疏水作用等相互交联[24],蛋白质分子间接触的机会增多,利于大豆凝胶的形成。由SDS-PAGE图谱分析可知,大豆发芽初期,11S球蛋白变化较7S球蛋白小,7S的降解可能使蛋白分子间形成新的相互作用,使凝胶网络结构更为紧密,凝胶强度提高。随着发芽的进行,11S球蛋白也逐渐被降解,使维护大豆凝胶稳定的蛋白质亚基减少,凝胶强度降低。
4 结论
通过研究发现,大豆发芽前期蛋白质含量随发芽的进行而降低,至发芽36 h后又有所增加,而氨基态氮含量则随发芽的进行而增加。发芽大豆的凝胶强度和SPI凝胶强度随发芽程度变化的趋势一致,发芽初期凝胶强度增高,然后则逐渐降低,发芽72 h时蛋白凝胶强度仅为最高凝胶强度的22%。通过分析SPI的SDS-PAGE图谱可知,发芽对大豆11S球蛋白亚基的影响较7S球蛋白亚基小,7S球蛋白的α'、α亚基和11S球蛋白的酸性亚基A3、A在发芽时降解明显。而11S球蛋白在大豆发芽初期变化小,有利于蛋白质分子之间形成网络结构,凝胶强度增强。随着发芽时间的延长,大豆SPI降解增加,部分蛋白亚基含量显著减少,11S球蛋白也部分发生降解,蛋白质不易形成网络结构,凝胶强度下降。
[1] Lee C K,Karunanithy R.Effect of germination on the chemical composition of Glyeine and Phaseolus beans[J].J Food Sci,1990,40:1 008 -1 009.
[2] Mostafa M M.Chemical and nutritional changes in soybean during germination[J].Food Chem,1987,23:257 -275.
[3] Wenstock R S,et al.The role of dietary fiber in the management of diabetes mellitus[J].Nutrition,1988,4:187-193.
[4] 徐茂军.不同品种发芽大豆中异黄酮含量变化的比较研究[J].营养学报,2002,24(4):444-446.
[5] 袁松梅.发芽大豆饮料的研究[D].天津:天津轻工业学院硕士论文,2002:3.
[6] López-Amoró M L,Hernández I,Estrella I.Effect of germination on legume phenolic compounds and their antioxidant activity[J].J Food Comp and Anal,2006,19:277-283.
[7] Beleia A,et al.Lowering phytic phosphorus by hydration of soybean[J].J Food Sci,1993,58:375 -377.
[8] Kumar V,Rani A,Pandey V,Chauha G S.Changes in lipoxygenase isozymes and trypsin inhibitor activity in soybean during germination at different temperatures[J].Food Chem,2006,99:563 -568.
[9] 刘志胜.豆腐凝胶的研究[D].北京:中国农业大学,2000.
[10] 陈莉,钟芳,王璋.凝固剂及凝固条件对大豆蛋白胶凝性质的影响[J].中国乳品工业,2004,32(9):23-27.
[11] 王雪,乔君,刘海波.豆浆加热程度对内酯凝胶强度的影响[J].农产品加工学刊,2008,7:106-108.
[12] 高丽,张声华.大豆蛋白凝胶前后SDS-PAGE图谱比较分析[J].粮油食品科技,2009,17(3):25-27.
[13] 朱新荣,胡筱波,潘思轶,等.大豆发芽期间多种营养成分变化的研究[J].中国酿造,2008,12:64-66.
[14] 李淑艳,王建中.大豆种子萌发过程中蛋白质的变化[J].中国种业,2009,25(4):41-43.
[15] 王丽,张英华.大豆分离蛋白的凝胶性及其应用的研究进展[J].中国粮油学报,2010,25(4):96~99.
[16] Maruyama N,Fukuda T,Saka S.Molecular and structural analysis of electrophoretic variants of soybean seed storage proteins[J].Photochem,2003,64:701 -708.
[17] Zarkadas C G,Gagnon C,Poysa V.Protein quality and identification of the storage protein subunits of tofu and null soybean genotypes,using amino acid analysis,one and two-dimensional gel electrophoresis,and tandem mass spectrometry[J].Food Res Intern,2007,40:111 -128.
[18] Renkema J M S.Formation,Structure and rheological properties gels[D].Net Lands:PHD thesis Wageningen University,2001:3 -5.
[19] Constantinos G,Zarkadas C G,Gagnon C,et al.Assessment of the protein quality of fourteen soybeans[Glycine max(L.)Merr.]cultivars using amino acid analysis and two-dimensional electropHoresis[J].Food Res Intern,2007,40:129–146.
[20] Mujoo R,Trinh D T.Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J].Food Chem,2003,82:265 -273.
[21] Poysa V,Woodrow L,Yu K.Effect of soy protein subunit composition on tofu quality[J].Food Res Intern,2006,39:309-317.
[22] 杨涛,马传国,李庆鹏,等.不同工艺条件对大豆分离蛋白7S和11S组分影响的探讨[J].粮食加工,2007,32(5):91-96.
[23] 华欲飞,Cui S W,Wang Q,等.不同大豆分离蛋白凝胶的流变学性质[J].中国粮油学报,2003,18(6):43-48.
[24] 叶荣飞.大豆分离蛋白凝胶性影响因素研究进展[J].畜牧与饲料科学,2009,30(1):29-30.
Effect of Germination on Properties of Soybean Gel
Wang Su-ya,Zhao Jia-hui,Ju Xing-rong,Chen Bo
(School of Food Science& Technology,Nanjing University of Finance& Economics,Jiangsu Key Laboratory of Quality Control& Further Processing on Grain& Oil,Nanjing 210046,China)
The impact of germination on gel property of soybean protein was investigated in the paper.Soybean protein isolate(SPI)were obtained from germinated soybean using alkaline extraction and acid precipitation method.After prepared by adding GDL as coagulant,soy protein gels were analyzed by Texture Analyzer.The influence of SPI changes on strength of soybean protein gel was discussed by SDS-PAGE mapping.The results showed that α'-7S,α-7S,A3-11S and A-11S subunits were easily hydrolyzed by intra - proteases.However,all subunits of 11S globulin had less change than 7S globulin during soybean germination.At the early germination,network structure of soybean gel was easily to form among proteins and the gel strength increased,and then the gel strength decreased due to hydrolysis of 11S globulin.
germination,SPI,soybean protein gel,SDS-PAGE
博士,副教授。
2011-07-04,改回日期:2011-09-10

