Pannonibacter phragmitetus T1菌对Pb2+的吸附特性
苏艳蓉 ,柴立元,杨志辉,尤翔宇,朱咏华
(1.中南大学 冶金科学与工程学院,长沙 410017;2.中机国际工程设计研究院有限责任公司,长沙 410007)
重金属铅具有不可降解和生物累积特性,因此,水体中的铅对生态环境和人类健康构成了巨大威胁。目前,含铅废水的处理方法主要有沉淀、吸附、电解和膜分离[1]等。但这些方法普遍存在成本高、二次污染严重、对痕量重金属处理效果差等缺点。生物吸附[2]因其成本低廉、材料来源广泛等优点逐渐成为研究热点。
从受重金属污染的土壤中分离筛选出的微生物,因受生存环境中重金属的胁迫,既对重金属有一定耐受性,又能对重金属具有高效吸附能力,因此具有成为高效重金属吸附剂的潜力。潘蓉等[3]研究了青霉菌对重金属 Cd2+、Cu2+、Zn2+和 Pb2+的吸附特性,结果表明,菌丝体对重金属的吸附能力表现出一定的差异性,对Pb2+的吸附率和吸附量明显高于其他3 种金属的。对 Cd2+、Cu2+和Zn2+的吸附率随金属浓度的升高而下降,吸附量随金属浓度的增加先增大后减小;当浓度增加到较高值时,Pb2+的吸附率开始下降,吸附量先逐渐增加后变化不大。RIORDAN和MCHALE[4]研究表明经过清洗预处理不经过清洗预处理的非活性酵母(干质量)对Pb2+的最大吸附量分别达到127 mg/g和 99 mg/g。但是,目前国内外学者在生物吸附方面开展的研究工作主要集中在真菌[5]、藻类[6]和酵母[7]等,而以细菌作为生物吸附剂材料的国内外报道较少。细菌是近地表环境中分布最广、生物量最大的生物类型。细菌细胞表面通常都有多种带负电荷的功能基团,如羧基、磷酰基和羟基等[8],因此,表现出显著的亲金属特性[9],且以细菌作为吸附剂具有效率高、选择性强和吸附容量大等特点[10]。
本文作者以从重金属污染土壤中分离、筛选出的一株对 Pb2+具有高耐受性的细菌 pannonibacter phragmitetus T1作为研究对象,在实验室条件下对影响Pb2+吸附的主要因素以及吸附机理进行研究,揭示pannonibacter phragmitetus T1吸附 Pb2+的特性和规律,以期为生物吸附剂在工业化废水处理中的应用提供理论依据。
1 实验
1.1 实验材料
从重金属污染土壤中分离得到一株重金属耐受细菌,对其进行16srDNA序列分析,并结合其形态特征、培养条件、生理生化特征进行鉴定,按照《伯杰氏细菌鉴定手册》(第9版),该菌被鉴定为Pannonibacter phragmitetus,命名为T1菌。
将保存的菌种接种到新鲜的LB固体培养基上,于30 ℃培养48 h后进行活化,选取单克隆菌落接种到LB液体培养基中,在30 ℃、120 r/min条件下振荡培养24 h,获得对数生长期菌液。再以体积分数为2%的接种量将菌液接入LB液体培养基中,振荡培养12 h后,经5 000 r/min离心20 min收集菌体,并用去离子水洗涤3次,收集湿菌体作为活性菌体吸附剂,将湿菌体于80 ℃烘干恒定,作为非活性吸附剂备用。
LB液体培养基:将胰蛋白胨(Tryptone)10 g/L、酵母提取物(Yeast extract)5 g/L、氯化钠(NaCl)5 g/L组成pH值为7.4~7.6的液体培养基。液体培养基在 0.105 MPa、121.3 ℃条件下高压蒸汽灭菌25 min。LB固体培养基在液体培养基中加入琼脂15~20 g/L。
Pb2+溶液的配制:称取一定量的分析纯Pb(NO3)2,溶解在去离子水中,定容后配制成 1 000 mg/L的含Pb2+溶液,再用去离子水将其稀释制成不同浓度。
1.2 实验方法
1.2.1 吸附条件实验
实验中分别研究了细菌代谢活动、细菌菌龄、溶液pH、菌体用量以及温度对Pb2+吸附的影响,具体实验过程如下。
细菌代谢活性对吸附的影响:在Pb2+离子初始浓度(ρi)为 50、100、150、200和 250 mg/L,pH 值为 6的溶液中,分别加入培养时间为12 h的活性菌体(干质量)和灭活菌体(ρb)0.50 g/L,于30 ℃下振荡 90 min,离心 20 min除去菌体,收集上清液,测定上清液中Pb2+离子浓度(ρf)。
细菌培养时间对吸附的影响:在 ρi为 150 mg/L的溶液中,分别加入培养时间为6、12、24、36、48、96 h及ρb为0.50 g/L的灭活菌体,然后于30 ℃、pH值为6的条件下振荡吸附90 min,离心20 min除去菌体,收集上清液,测定上清液中Pb2+离子浓度(ρf)。
溶液pH值对吸附的影响:将ρi为150 mg/L的溶液,用0.5 mol/L HNO3或0.5 mol/L NaOH调节pH值分别至1、2、3、4、5和6,各加入培养时间为12 h、ρb为0.50 g/L的灭活菌体,然后于30 ℃振荡吸附90 min,离心20 min除去菌体,测定上清液中Pb2+离子浓度(ρf)。
菌体用量对吸附的影响:在ρi为150 mg/L的溶液中,分别加入培养时间为12 h,ρb分别为0.50、2.5、5.0、7.5和10.0 g/L的灭活菌体,然后于30 ℃、pH值为6的条件下振荡吸附90 min,离心20 min除去菌体,测定上清液中Pb2+离子浓度(ρf)。
温度对吸附的影响:在ρi为150 mg/L、pH值为6的溶液中,各加入培养时间为12 h、ρb为0.50 g/L的灭活菌体,然后分别于10、20、30、40和50 ℃的温度下振荡吸附90 min,离心20 min除去菌体,收集上清液,测定上清液中Pb2+离子浓度(ρf)。
以上各实验分别重复3次。按下列公式计算菌体对 Pb2+的去除率(η)和吸附量(q):


式中:ρi为 Pb2+离子初始浓度,mg/L;ρf为 Pb2+离子平衡浓度,mg/L;V为溶液体积,L;M为吸附菌体的干质量,g。
1.2.2 吸附动力学
在ρi为150 mg/L、pH值为6的溶液中,分别加入培养时间为12 h、ρb为0.5 g/L的灭活菌体,然后分别于 30 ℃振荡吸附 1、3、5、10、15、20、30、40、60、90、120、180和240 min后离心分离,收集上清液测定剩余Pb2+离子浓度(ρf),并绘制吸附量与时间的关系曲线。
1.2.3 吸附等温模型
在ρi分别为20、50、100、150和200 mg/L,pH值为6的溶液中,各加入培养12 h、ρb为0.50 g/L的的灭活菌体,然后于30 ℃的条件下吸附90 min,离心收集上清液,测定吸附平衡时的离子浓度 ρe,以 q对 ρe作图得到等温吸附曲线,并将实验数据分别按Langmuir和Freundlich等温吸附模型进行拟合。
1.3 分析方法
溶液中的Pb2+浓度用WFX−120型原子吸收分光光度计(北京瑞利公司生产)测定,溶液 pH值用PHS−3E型pH计(上海雷磁公司生产)测定,菌体表面功能团用 NICOLETIS10型红外光谱仪(美国 Thermo公司生产)进行检测。
2 结果与讨论
2.1 细菌代谢活性对T1菌吸附Pb2+效果的影响
用活性菌体和灭活菌体作吸附材料进行试验,结果如图1所示。由图1可知,在50~250 mg/L的浓度范围内,具有代谢活性的菌体和灭活菌体对Pb2+都有一定的吸附量,且具有代谢活性的细胞对Pb2+的吸附量都大于灭活菌体的,但随着浓度的升高,差距明显减小。这是因为活性生物吸附过程可以分成2个阶段[11],第一阶段发生在细胞壁表面,以吸附和离子交换过程为主,为快速过程;第二阶段为主动吸收,即吸附在细胞表面的金属离子进一步转移至细胞内部,反应进行缓慢。高浓度的重金属会强烈抑制生物活性,影响第二阶段反应的进行,使得生物富集在实际应用中受到很大限制。非活性细胞的吸附相当于活性生物吸附过程第一阶段,只有表面吸附[12],是一个不依赖细胞代谢和能量的过程,有利地解决了由于高浓度重金属离子对活生物的毒性作用。一些学者研究发现,非活性菌体能以相等甚至更高的效率吸附重金属[13],且非活性菌体比活性菌体更易保存,从而解决了由于高浓度重金属离子对活生物毒性作用而使其应用受到限制的问题。因此,以下均采用灭活菌体进行实验。
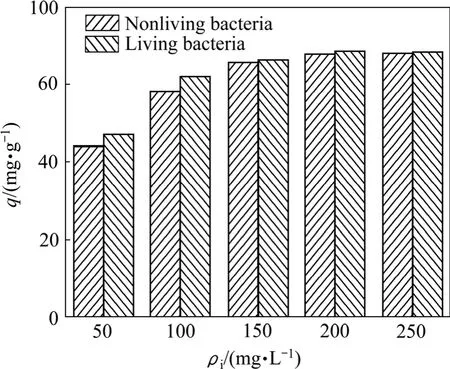
图1 菌体代谢活性对T1吸附Pb2+的影响Fig.1 Effect of metabolic activity of bacteria on biosorption of Pb2+ by T1
2.2 细菌培养时间对Pb2+吸附效果的影响
图2所示为培养时间对T1菌吸附Pb2+的影响。由图2可以看出,不同生长阶段的灭活菌体对Pb2+的吸附能力有明显的差异。对数期内(6~24 h)Pb2+的吸附量均达到59.58 mg/g以上,培养时间为6 h(对数期前期)的菌体对 Pb2+的吸附能力最强,吸附量(82.32 mg/g)和去除率(31.26%)均为最高。进入稳定期(24~72 h)后,Pb2+吸附量先下降后趋于稳定,保持在 47 mg/g左右。衰退期(72 h以后)菌体对Pb2+吸附逐渐下降。这可能是由于与重金属吸附密切相关的菌体细胞壁膜的主要成分(脂多糖、蛋白质和磷脂、肽聚糖)和含量在生长过程中不断发生变化。有研究发现[14],细胞壁膜的重金属吸附能力随培养时间变化,原因是壁膜中的外膜、内膜与PEG层的含量以及外膜和内膜对重金属的吸附能力随培养时间的变化而变化。细胞外膜的主要成分磷脂和脂多糖的含量以及内膜的主要成分磷脂的含量随菌龄的变化是导致不同生长时期细胞外膜和内膜的重金属吸附能力有显著差异的主要原因。
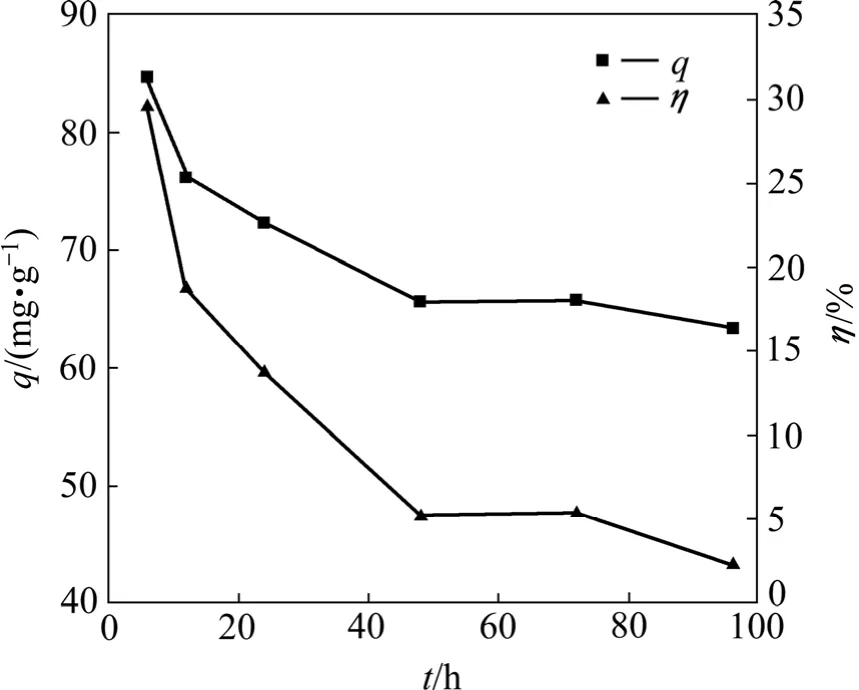
图2 培养时间对T1吸附Pb2+的影响Fig.2 Effect of culture time on biosorption of Pb2+ by T1
2.3 溶液pH值对T1菌吸附Pb2+效果的影响
图3所示为pH值对T1菌吸附Pb2+的影响。由图3可知,pH值对Pb2+吸附有较大的影响,随着pH值的升高,吸附量和去除率逐渐增大。在 pH值等于 6时,吸附量和去除率分别为64.44 mg/g和24.64%。这可能是由于细菌细胞壁带有负电荷,金属离子与细胞表面结构材料上的羧基阴离子和磷酸阴离子发生相互作用而被固定[15]。pH值较低时,细胞壁的吸附活性位点会被水合氢离子H3O+占据,使吸附剂质子化,增加细胞表面的静电斥力,而阻碍金属离子对细胞壁的靠近,pH值越低阻力越大。当溶液pH值升高至超过细菌表面的等电点时,细胞表面负电荷量增加,可以充分吸附带正电的金属离子,有利于金属离子的接近并吸附在细胞表面上。当pH值大于6时,溶液中出现微沉淀,Pb2+的状态发生了改变。
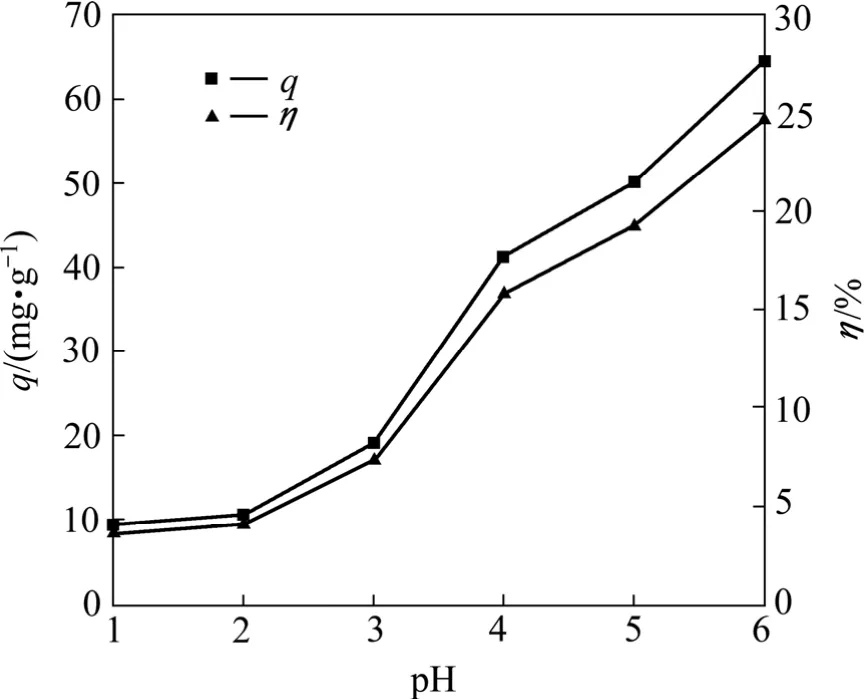
图3 pH值对T1吸附Pb2+的影响Fig.3 Effect of pH value on biosorption of Pb2+ by T1
2.4 菌体用量对Pb2+吸附效果的影响
将不同数量 T1菌体加入含 Pb2+的溶液中,研究菌体对Pb2+吸附性能,结果如图4所示。由图4可知,随着菌体用量的增加,Pb2+去除率迅速增加,但菌体对Pb2+的单位吸附量越来越小。在菌体用量为 7.50 g/L时,Pb2+去除率增加到93.29%。这可能是由于随着菌量的增加,吸附位点也增加,使得吸附率升高,但是吸附率并不随菌体加入量的增加而成比例增多,这说明在金属离子浓度一定的吸附体系中,降低菌体浓度(提高金属与菌体的浓度比),只要菌体未被金属饱和,菌体的吸附量便增加。但当菌体用量增加到一定程度时,Pb2+去除率增加幅度缓慢[16]。
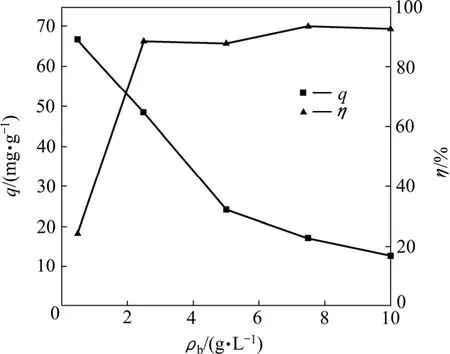
图4 菌体用量对T1吸附Pb2+的影响Fig.4 Effect of biomass concentration on biosorption of Pb2+by T1
2.5 温度对T1菌吸附Pb2+效果的影响
图5所示为温度对T1菌吸附Pb2+的影响。由图5可知,温度明显影响T1菌体对Pb2+的吸附效果。T1菌体对 Pb2+的吸附量和吸附效率都随温度升高而升高,在30 ℃时,T1菌体对Pb2+吸附量(62.01 mg/L)和去除率(21.81%)均最大。当温度大于30 ℃时,T1菌体对 Pb2+的吸附量和吸附效率随着温度的升高而下降。这与啤酒酵母对Hg2+的吸附一致[17]。温度在一定范围内升高,有利于菌体的吸附,而当温度高于30 ℃时,温度过高可能对细胞壁的结构或化学物质产生影响,也有可能是影响了与吸附位点有关的金 属−菌体之间络合的稳定性,导致吸附量下降。
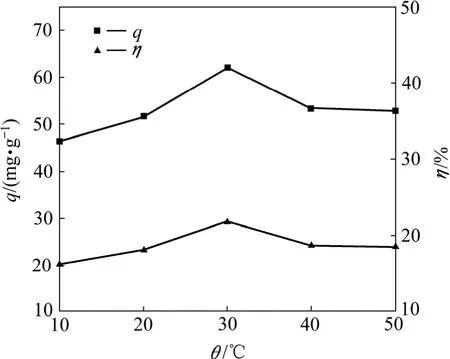
图5 温度对T1吸附Pb2+的影响Fig.5 Effect of temperature on biosorption of Pb2+ by T1
2.6 T1菌对Pb2+的吸附动力学2+
图6所示为T1菌对Pb的吸附随时间的变化。由图6可知,T1菌对重金属Pb2+的吸附大致可分为如下3个过程:前5 min,T1对Pb2+的生物吸附非常迅速,吸附量由0增加到64.84 mg/g,达到最大吸附量的90%以上[18]。6~40 min这段时间内,T1对Pb2+的生物吸附比较缓慢,其吸附量只占整个吸附过程所吸附Pb2+的很小一部分,当吸附时间大于40 min时,吸附量略微下降,之后基本保持稳定,说明细胞上被吸附的离子与溶液中的重金属离子已达平衡。CHEN等[19]在研究灭活的 Pseudomonas putida CZ1菌体对Cu2+吸附时亦发现了同样的现象。由图6还可知,整个吸附过程以较快的速度进行。说明T1对Pb2+的吸附在短时间内即可完成,推测出该吸附过程主要是菌体细胞表面的吸附作用,这种作用的特点是快速、可逆、不依赖能量代谢,细胞壁对吸附起主要作用。
吸附动力学模型是表征吸附过程一种重要手段,其在吸附剂的实际应用中可以用来预测不同吸附时间下可以达到的吸附效率,其中在生物吸附方面使用较多的吸附动力学模型是 Pseudo学模型。陈灿等[20]研究表明,很多二价金属离子的吸附动力学行为可以用准二级动力学方程描述。
Pseudo-second order模型是由HO等[21]提出来的,其方程如下:

式中:qt、qe分别为t时刻及平衡吸附量(mg/g);k2为准二级速率常数(g/(mg·min−1))。
采用 Pseudo-second order模型对 T1菌体吸附Pb2+的实验数据进行拟合,得到t/qt和时间t的线性拟合曲线,并且通过计算得到qe=68.35 mg/g,K2=0.029 g/(mg·min−1),相关系数 R2=0.999。因此,可以得出,该吸附过程可以用Pseudo-second order模型很好地描述和预测。
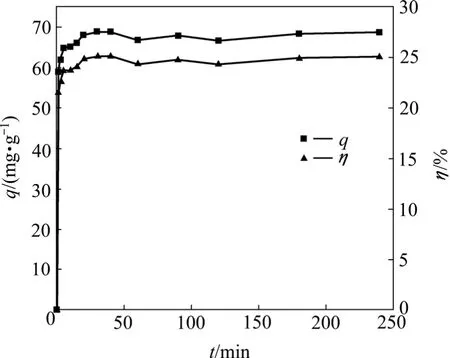
图6 T1菌对Pb2+的吸附随时间的变化Fig.6 Changes of Pb2+ biosorption by T1 vs.time
2.7 T1菌对Pb2+的等温吸附模型
T1菌对Pb2+的等温吸附曲线如图7所示。由图7可知,随着 Pb2+初始质量浓度的增加,Pb2+的吸附率降低,而平衡吸附量增大。当Pb2+质量浓度较低时,Pb2+的浓度低于细胞表面的吸附位点,被吸附的百分比相对较大,反之则较小;由于菌的量一定,单位菌体的吸附量一定,随着Pb2+质量浓度的增加,同体积溶液中有效 Pb2+的量增加,Pb2+与菌体表面吸附位点的碰撞几率必然上升,从而增加了菌体对Pb2+的吸附量。但是,这种增加不是无止境的,随着Pb2+初始质量浓度的继续增加,吸附量的增加幅度越来越小。在实验条件下Pb2+的最大吸附量可达67.97 mg/g。
Langmuir吸附模型假定吸附是单分子层的,体相溶液和吸附层均可视为理想溶液,即吸附质分子之间不存在任何形式的相互作用。Freundlich吸附模型描述的是非均质固体表面的吸附行为。
Langmuir方程和Freundlich方程分别如下:

式中:eρ为平衡浓度,mg/L;qe为平衡吸附量,mg/g;Q为最大吸附量;b为Langmuir常数,与吸附能量有关,表征吸附剂与吸附质的亲和力;k是表征吸附能力的常数;n为待定系数。
将实验所得数据分别按Langmuir和Freundlich吸附等温线方程进行回归分析,拟合结果如表1所列。
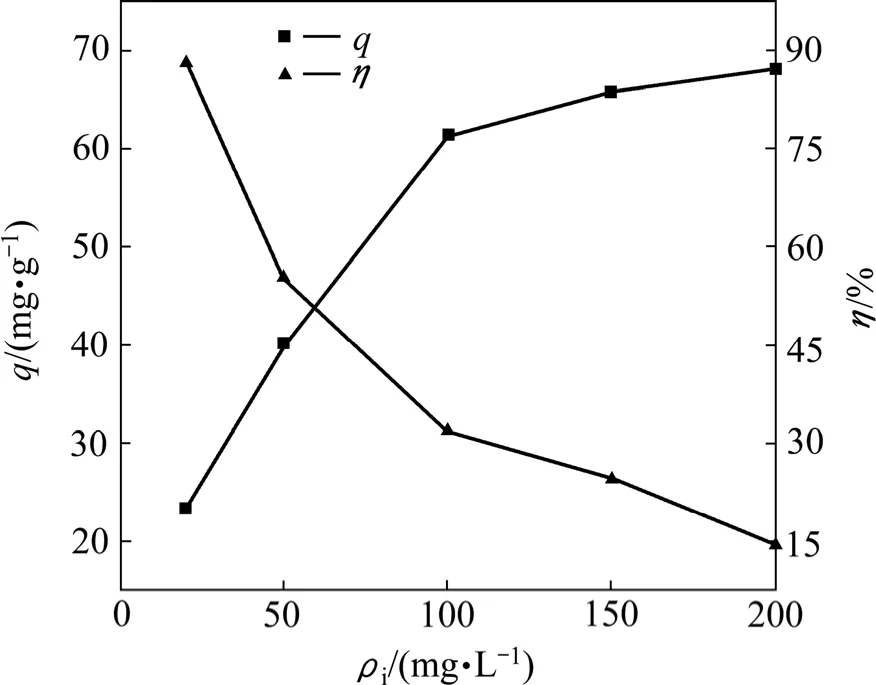
图7 T1菌对Pb2+的吸附等温线Fig.7 Adsorption isotherm of Pb2+ by T1
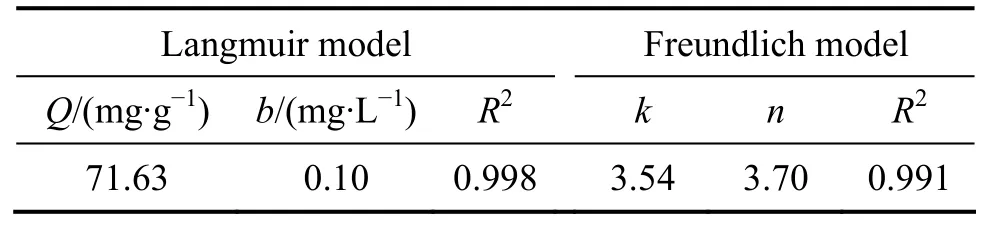
表1 Pb2+等温吸附模型拟合参数Table 1 Parameters of Pb2+ by different isotherm adsorption models
以上结果可以看出,Langmuir和Freundlich吸附等温方程的相关系数都达到了0.99以上,都能在一定程度上描述 T1对 Pb2+的吸附。类似的现象在Steptomyces coelicolor A3(2)细菌吸附 Cu2+和 Ni2+[22]以及Aeromonas caviae细菌吸附Cd2+的实验[23]中也有发现。Langmuir能够更好地描述该吸附过程,说明溶液中Pb2+在吸附剂表面是单分子层的表面吸附。
2.8 红外光谱吸收分析(FTIR)
由图8可以看出,在3 800~3 000 cm−1处有一较宽的吸收带,最大吸收峰将在3 443.24 cm−1处,来自O—H的伸缩振动,是O—H,N—H键伸缩振动吸收,来自多糖、脂肪酸和蛋白质等组分的贡献。2 962.94 cm−1和2 928.34 cm−1处的谱峰分别来自蛋白质和脂类的—CH2和—CH3,是典型的脂碳链(—CH3、=CH2、=CH—)的 C—H键的伸缩振动吸收带,它反映脂肪酸、各种膜和细胞壁组分的亲水脂分子的信息。1 642.79 cm−1处的谱峰来自仲酰胺Ⅰ带,是—C=O的伸缩振动引起的。1 546.48 cm−1处的谱峰来自仲酰胺Ⅱ带,是N带谱的弯曲振动和C弯曲的伸缩振动特征谱带,这两个峰是蛋白质的特征谱带。1 401.06 cm−1处的谱峰来自酰胺Ⅲ带,是C谱的伸缩振动和N伸缩的弯曲振动引起的[24]。1 453.49 cm−1处的谱峰来自—CH3和—CH2—的弯曲振动。1 241.08处的谱峰是糖环上—C—O—C—收缩的糖类特征峰,表明菌细胞壁含有大量多糖及蛋白质等物质。胺基中C—N的伸缩振动、磷酸脂和糖环的振动出现在1 112.15和1 078.86 cm−1处。972.48 cm−1处的峰可归属于磷酸化蛋白和核酸中磷酸单酯二价阴离子—PO42−基团的对称伸缩振动。974.77 cm−1为多糖骨架振动吸收带,主要是糖类的C—OH的伸缩振动,可能也含P—O—C伸缩振动的贡献。低于600 cm−1的525.25 cm−1处的谱峰是M的谱(M是金属离子)和O的振动吸收峰[25]。由此可以初步推断,pannonibacter phragmitetus T1细菌主要含有羟基、胺基、酰胺基、羧基和磷酸脂。
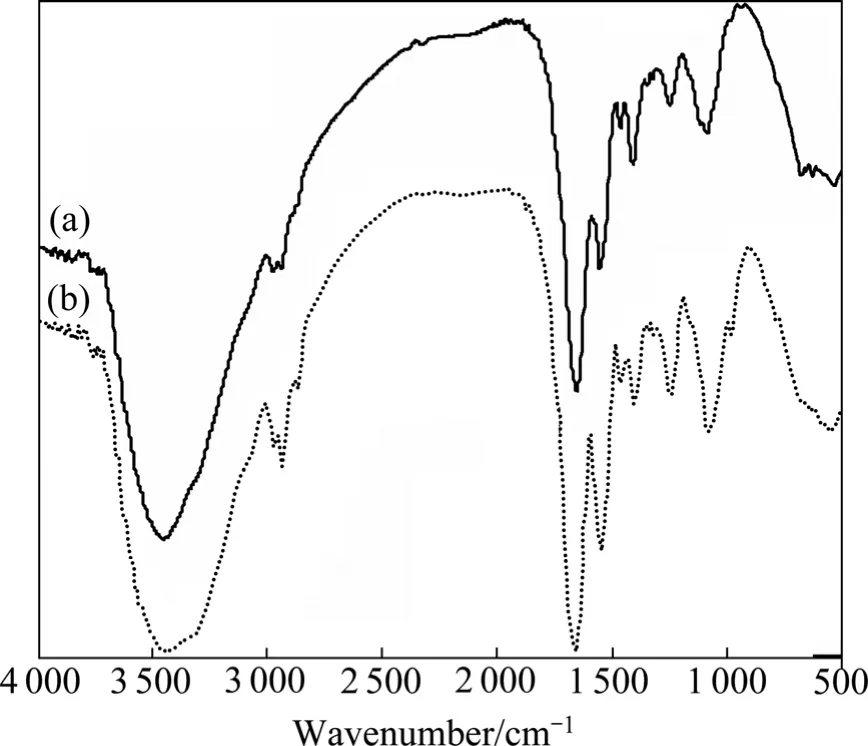
图8 T1吸附Pb2+前后的红外光谱Fig.8 FTIR spectra of T1 before(a)and after(b)adsorbing Pb2+
菌体吸附Pb2+后羟基峰红移至3 420.95 cm−1,且与—M—O(O—M—O)吸收峰一样增强并增宽。吸附后1 642.79、1 546.48和1 401.06 cm−1处的吸收峰峰形变窄,吸光度变大。结果表明:羟基和酰胺基是吸附、络合或螯合金属离子或原子的主要活性基团。吸附后没有新的谱带出现,表明Pb2+并未破坏吸附剂本身的结构,进一步证明菌体对Pb2+是表面吸附过程。
3 结论
1)Pannonibacter phragmitetus T1菌对Pb2+具有良好的吸附性能,菌体的代谢活性、菌体的生长阶段、pH值、菌体用量、温度、Pb2+离子浓度明显影响Pb2+的吸附。
2)Pannonibacter phragmitetus T1菌对Pb2+吸附的最佳条件是灭活 T1菌、菌龄 12 h、Pb2+浓度为 150 mg/L、pH值为6、菌体加入量为0.5 g/L、温度为30 ℃,最佳条件下T1菌体对Pb2+的吸附量为68.35 mg/g。
3)Pannonibacter phragmitetus T1菌对Pb2+的吸附速度较快,Pb2+的吸附符合Pseudo-second order动力学模型和Langmuir、Freundlich等温吸附模型。菌体可能主要是借助细胞表面成分的羟基、酰胺基等活性基团与Pb2+络合,进而吸附Pb2+。
[1]WANG J L, CHEN C.Biosorption of heavy metals by Saccharomyces cerevisia∶ A review[J].Biotechnology Advances,2006, 24∶ 427−451.
[2]VIJAYARAGHAVAN K, YUN Y S.Bacterial biosorbents and biosorption[J].Biotechnology Advances, 2008, 26(3)∶ 266−291.
[3]潘 蓉, 曹理想, 张仁铎.青霉菌和镰刀菌对重金属 Cd2+、Cu2+、Zn2+和 Pb2+的吸附特性[J].环境科学学报, 2010, 30(3)∶477−484.PAN Rong, CAO Li-xing, ZHANG Ren-de.Biosorption characteristics of heavy metals cadmium, copper, zinc, lead by Penicillium and Fusarium fungi[J]. Acta Scientiae Circumstantiae, 2010, 30(3)∶ 477−484.
[4]RIORDAN C, MCHALE A P.Removal of lead from solution using non-living residual brewery yeast[J].Bioprocess Engineering, 1998, 19∶ 277−280.
[5]FAN T, LIU Y, FENG B Y, ZENG G M, YANG C P, ZHOU M,ZHOU H Z, TAN Z F, WANG X.Biosorption of cadmium(Ⅱ),zinc(Ⅱ)and lead(Ⅱ)by Penicillium simplicissimum∶ Isotherms,kinetics and thermodynamics[J].Journal of Hazardous Materials,2008, 160∶ 655−661.
[6]HANG Z L, ZENG G M, HUANG D L, LI L F, HUANG P M,XIA C B.Adsorption of lead(Ⅱ)from aqueous solution onto Hydrilla verticillata[J].Biodegradation, 2009, 20∶ 651−660.
[7]代群威, 董发勤, NOONAN M J, 张 伟.面包酵母菌在铅铜模拟废水中的吸附动力学[J].中国有色金属学报, 2010, 20(4)∶788−794.DAI Qun-wei, DONG Fa-qin, NOONAN M J, ZHANG Wei.Biosorption kinetics of baker’s yeast in lead and copper waste water[J].The Chinese Journal of Nonferrous Metals, 2010, 20(4)∶788−794.
[8]BOHUMIL V.Biosorption and me[J].Water Research, 2007, 41∶4017−4029.
[9]DAI Qun-wei, DONG Fa-qin, NOONAN M J, SARABJEET S,AHLUWALIA, DINESH G.Microbial and plant derived biomass for removal of heavy metals from wastewater[J].Bioresource Technology, 2007, 98∶ 2243−2257.
[10]SISCA O L, NOVIE F, FELYCIA E, SOETAREDJOA, JAKA S,SURYADI I.Studies on potential applications of biomass for the separation of heavy metals from water and wastewater[J].Biochemical Engineering Journal, 2009, 44∶ 19−41.
[11]许旭萍, 沈雪贤, 陈宏靖.球衣菌吸附重金属 Hg2+的理化条件及其机理研究[J].环境科学学报, 2006, 26(3)∶ 453−458.XU Xu-ping, SHEN Xue-xian, CHEN Hong-jing.Study on biosorption mechanism and physiochemical conditions of Hg2+by Sphaerotilus natans[J].Acta Scientiae Circumstantiae, 2006,26(3)∶ 453−458.
[12]GUAN X H, QIN Y C, QIN Y H.Study on removing Cr(Ⅵ)by composite biosorbent of nano Fe3O4sphaerotilus natans[J].Environmental Science, 2007, 28(2)∶ 436−440.
[13]VOLESKY B, PHILLIPS A M.Biosorption of heavy metals by Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology, 1995, 42(5)∶ 797−806.
[14]陈志英, 王 磊, 周 琪.菌龄对恶臭假单胞菌吸附铜离子能力的影响[J].中国环境科学, 2006, 26(7)∶ 97−101.CHEN Zhi-ying, WANG Lei, ZHOU Qi.Studies on the Cu2+adsorption capacity of Pseudomonas putida 5-x membranes with different cell ages[J].China Environmental Science, 2006, 26(7)∶97−101.
[15]KIRAN B, KAUSHIK A, KAUSHIK C P, Biosorption of Cr(Ⅵ)by native isolate of lyngbya putealis (hh-15)in the presence of salts[J].Journal of Hazardous Materials, 2007, 141(3)∶ 662−667.
[16]KANG S Y, LEE J U, KIM K W.Biosorption of Cr(Ⅲ)and Cr(Ⅵ)onto the cell surface of pseudomonas aeruginosa[J].Biochemical Engineering Journal, 2007, 36(1)∶ 54−58.
[17]朱一民, 周东琴, 魏德州.啤酒酵母菌对汞离子(Ⅱ)的生物吸附[J].东北大学学报∶ 自然科学版, 2004, 25(1)∶ 89−91.ZHU Yi-min, ZHOU Dong-qin, WEI De-zhou.Biosorption of Hg2+By Saccharomyces cerevisiae[J].Journal of Northeastern University∶ Natural Science, 2004, 25(1)∶ 89−91.
[18]ZULKALI M M D, AHMAD A L, NORULAKMAL N H.Oryza sativa L.husk as heavy metal adsorbent∶ optimization with lead as model solution[J].Bioresource Technology, 2006, 97∶ 21−25.
[19]CHEN X C, WANG Y P, SHI J Y, WU W X, CHEN Y X.Biosorption of copper(Ⅱ)and Zn(Ⅱ)from aqueous solution by Pseudomonas putida CZ1[J].Colloids and Surfaces B∶Biointerfaces, 2005, 46(2)∶ 101−107.
[20]陈 灿, 王建龙.酿酒酵母吸附 Zn2+、Pb2+、Ag2+、Cu2+的动力学特性研究[J].环境科学学报, 2007, 27(4)∶ 544−553.CHEN Can, WANG Jian-long.Biosorption of heavymetal ions by a brewery’swaste∶ Kinetic and equilibrium[J].Acta Scientiae Circumstantiae, 2007, 27(4)∶ 544−553.
[21]HO Y S, MCKAY G.Batch lead(Ⅱ)removal from aqueous solution by peat∶ Equilibrium and kinetics[J].Trans Ins Chem Eng, 1999, 77(B)∶ 165−173.
[22]OZTURK A, ARTAN T, AYAR A.Biosorption of nickel (Ⅱ)and copper (Ⅱ)ions from aqueous solution by Streptomyces coelicolor A3(2)[J].Colloids and Surfaces B∶ Biointerfaces,2004, 34(2)∶ 105−111.
[23]LOUKIDOU M X, KARAPANTSIOS T D, ZOUBOULIS A I,MATIS K A.Cadmium(II)biosorption by Aeromonas caviae∶Kinetic modeling[J].Separation Science and Technology, 2005,40(6)∶ 1293−1311.
[24]卢涌泉, 邓振华.实用红外光谱解析[M].北京∶ 电子工业出版社出版, 1989∶ 21−163.LU Yong-quan, DENG Zhen-hua. Practical infrared spectroscopy analysis[M].Beijing∶ Electronic Industry Press,1989∶ 21−163.
[25]代群威, 董发勤.FTIR技术在几株细菌鉴定中的应用[J].西南科技大学学报, 2009, 24(1)∶ 114−118.DAI Qun-wei, DONG Fa-qin.The application study of FTIR technology in microbial classification[J].Journal of Southwest University of Science and Technology, 2009, 24(1)∶ 114−118.

