Slug基因在宫颈癌、宫颈上皮内瘤变组织中的表达与意义*
张 铭,张一鸣,蒋丽霞,欧阳俊,周蓓蓓
(南京医科大学附属常州市妇幼保健院:1.检验科;2.病理科;3.妇科,江苏常州 213003)
宫颈癌是女性最常见的生殖道恶性肿瘤,在发展中国家占女性恶性肿瘤的第1位[1]。宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与宫颈浸润癌密切相关的一组癌前期病变,它反映宫颈癌发生、发展中的连续过程,但CIN不一定都发展为癌,CINⅠ期和Ⅱ期是可逆的,Ⅲ期是不可逆的[2]。转录因子Slug在多种恶性肿瘤的发生、发展和转移中起重要作用[3-4],但其在宫颈癌、CIN组织中的表达情况及意义文献报道甚少。本研究采用实时定量PCR方法检测了Slug mRNA 在宫颈癌、CIN、慢性宫颈炎及正常宫颈组织中的表达,分析宫颈癌组 Slug 表达与临床病理参数的相关性,探讨Slug基因在宫颈癌发生发展过程中的作用。
1 资料与方法
1.1一般资料 收集2010年3月至2011年12月,常州市妇幼保健院妇科手术切除的宫颈癌患者组织56例,其中鳞癌46例;腺癌10例;年龄21~68岁,中位年龄46岁,术前均未接受化疗和放疗。CIN组织60例(Ⅰ、Ⅱ、Ⅲ期各20例);年龄22~65岁,中位年龄45岁。同期收集因子宫肌瘤而行子宫全切或因宫颈炎症行宫颈活检的正常宫颈或宫颈炎症组织标本共35例为对照组,年龄22~66岁,中位年龄46岁。手术取材后立即置于-70 ℃冻存备用,所有病例均经病理检查确诊。患者均知情同意,研究符合常州市妇幼保健院伦理委员会所制定的伦理学标准并得到委员会的批准。
1.2仪器和试剂 PCR仪(2720,ABI公司)、实时荧光定量PCR仪(CFX96,Bio-Rad公司)、核酸蛋白测定仪(Eppendorf公司)、TRIzol试剂(Invitrogen公司)、逆转录试剂盒(Fermentas公司)、实时定量PCR检测试剂盒(Toyobo公司)。
1.3方法
1.3.1总RNA的提取和逆转录 取50~100 mg组织,放入匀浆器中并加入1 mL TRIzol提取RNA,核酸蛋白质测定仪测定RNA样品浓度,取A260/A280在1.80~2.0之间,且琼脂糖凝胶电泳鉴定质量好的RNA标本进行逆转录(不符合要求的RNA重新提取),按逆转录试剂盒说明书操作,以oligo(dT)为引物,合成cDNA.
1.3.2引物设计 根据GenBank已知基因序列编号(Slug:NM_003068.4,β-actin:NM_001101.3)设计引物,由上海生工公司合成,引物序列为:Slug 正向:5′-CCT GGT TGC TTC AAG GAC AC-3′,反向:5′-TCC ATG CTC TTG CAG CTC TC-3′,产物长度为395 bp。β-actin正向:5′-CAC GAA ACT ACC TTC AAC TCC-3′,反向:5′-CAT ACT CCT GCT TGC TGA TC-3′,产物长度为265 bp。
1.3.3实时定量PCR检测 常规方法构建Slug基因标准质粒为标准品[5-6],稀释成103~107copy/μL浓度,构建标准曲线。实时定量PCR反应总体积20 μL,包括: 2×SYBR Green Master Mix 10 μL,cDNA模板1 μL,上、下游引物各0.5 μL(10 μmol/L),ddH2O 8 μL。循环参数为:94 ℃ 5 min;94 ℃ 30 s,Slug(60 ℃)/β-actin(56 ℃) 30 s,72 ℃ 30 s,Slug(78 ℃)/β-actin(84 ℃)8 s后采集荧光,共35个循环,每个样本重复测定3次。由荧光定量PCR分析仪附带软件测定并绘制标准曲线。Slug mRNA相对表达水平=Slug cDNA拷贝数/β-actin cDNA拷贝数。
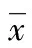
2 结 果
2.1标准曲线建立及线性检测范围 实时荧光定量PCR检测结果显示,Slug基因实时定量PCR标准曲线方程为Y=- 3.514X+45.110,在5个数量级检测范围内,其起始模板量对数值(X)与相应反应循环数(Y)有良好的线性相关(r2=1.000),实时定量PCR效率E为92.6%,说明扩增效率较好,见图1、2。
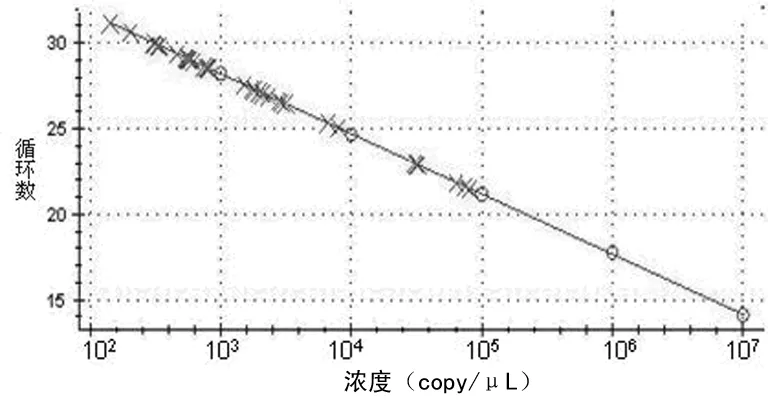
图1 Slug基因SYBR Green实时荧光PCR标准曲线

图2 Slug基因SYBR Green实时荧光PCR扩增曲线
2.2不同宫颈组织中Slug mRNA 的表达 对照组、CIN组、宫颈癌组Slug mRNA 相对表达水平分别为(1.33±0.32) ×10-2、(2.99±0.95) ×10-2、(4.69±1.02) ×10-2,3组间差异有统计学意义(F=56.70,P<0.01)。两两比较发现,宫颈癌组、CIN组Slug mRNA 相对表达水平高于对照组(P<0.01),宫颈癌组Slug mRNA 相对表达水平高于CIN组,差异有统计学意义(P<0.01)。
2.3宫颈癌组织中Slug mRNA 相对表达量与临床病理参数的关系 实时定量PCR检测所得Slug mRNA 相对表达量与宫颈癌的FIGO分期、是否有淋巴结转移相关(t分别为2.23、2.37,P<0.05),但与年龄、肿瘤大小、病理类型、分化程度无关(t分别为0.30、0.42、0.81、1.83,P>0.05),见表2。
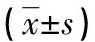
表2 宫颈癌组织中Slug相对表达量与临床病理参数的关系
3 讨 论
宫颈癌的发生、发展是一个多步骤、多因素的过程[7],它是由CIN逐步形成的,经历了CINⅠ、CINⅡ、CINⅢ、原位癌、早期浸润癌和浸润癌的连续发展过程。高危型人乳头瘤病毒感染是宫颈癌前病变和浸润性宫颈癌发生的必要条件[8],其他一些癌基因、抑癌基因也在宫颈癌前病变、宫颈癌的发生、发展中发挥重要作用。上皮-间质转化(epithelial-mesenchymal transitions,EMT)是上皮细胞向间质细胞转化的现象,以上皮细胞极性的丧失及其间质特性的获得为主要特征,并与肿瘤细胞的原位侵袭和远处转移有着密切的关系[9]。E-钙黏着蛋白(E-cadherin)的减少或丢失是EMT 最重要的标志性变化。Slug基因是锌指转录因子Snail家族成员之一,能够下调E-cadherin,诱导EMT的发生[10]。多项研究表明,Slug基因过度表达与胃癌、肺癌、乳腺癌、卵巢癌等肿瘤的发生、发展和转移密切相关[11-13],其在宫颈癌发生、发展过程中作用尚未见文献报道。
本研究采用实时定量PCR方法检测宫颈癌、CIN、慢性宫颈炎及正常宫颈组织中的Slug 基因的表达,结果显示,对照组、CIN组、宫颈癌组Slug mRNA 相对表达水平差异有统计学意义(P<0.05),从正常宫颈及慢性宫颈炎到CIN再到宫颈癌的演变中,Slug基因表达水平逐渐升高,提示Slug表达量的提高可能出现于宫颈恶性转化的早起,可能具有促进这些损伤恶性转化的作用,表明Slug表达上调与CIN、宫颈癌的发生发展有关,有可能作为宫颈癌发生的早期标志物。本研究还发现,Slug表达水平与宫颈癌的FIGO分期、是否有淋巴结转移相关,Ⅱ期相对表达量高于Ⅰ期,淋巴结转移组高于淋巴结未转移组,差异有统计学意义(P<0.05),但与年龄、肿瘤大小无关,不能为子宫颈癌的病理类型、分化程度提供依据。说明Slug不仅参与了CIN、宫颈癌的发生、发展,还可能与宫颈癌的侵袭和转移密切相关。
综上所述,Slug在CIN、宫颈癌组织中的表达增加,可能通过下调E-cadherin,诱导EMT的发生,参与了宫颈癌的发生、发展及转移。随着对Slug基因研究的深入,将有助于阐明宫颈癌发生、发展、侵袭、转移的本质,对临床早期诊断宫颈癌、判断CIN的发展及肿瘤侵袭转移也有重要指导意义。
[1]Parkin DM,Bray F.Chapter 2:the burden of HPV related cancers[J].Vaccine,2006,24(Suppl 3):11-25.
[2]高超,李保玉,曲从玲,等.子宫颈上皮内瘤样病变108例的临床病理分析[J].中国肿瘤临床与康复,2000,1(7):26-27.
[3]Kurrey NK,KA,Bapat SA.Snail and Slug are major determinants of ovarian cancer invasiveness at the transcription level[J].Gynecol Oncol,2005,97(1):155-165.
[5]De Graves FJ,Gao D,Kaltenboeck B.High-sensitivity quantitaive PCR platform [J].Biotechniques,2003,34(1):106-110,112-115.
[6]Rajeevan MS,Ranamukhaarachchi DG,Vernon SD,et al.Use of real-time quantitative PCR to validate the results of cDNA array and differential display PCR technologies[J].Methods,2001,25(4):443-445.
[7]Bosch FX,Lorincz A,Munoz N,et al.The causal relation between human papillomavirus and cervical cancer[J].J Clin Pathol,2002,55(4):244-265.
[8]钱德英,岑坚,王丁,等.高危型人乳头状瘤病毒DNA检测与细胞学联合检查对子宫颈癌前病变筛查的研究[J].中华妇产科杂志,2006,41(1):34-37.
[9]Thiery JP.Epithelial-mesenchymal transitions in tumour progression[J].Curr Opin Cell Biol,2003,15(6):740-746.
[10]Yu J,Ebert MP,Miehlke S,et al.α-Catenin expression is decreased in human gastric cancers and in the gastric mucosa of frist degree relatives[J].Gut,2000,46(5):639-644.
[11]Thiery JP.Epithelial-mesenehymal transitions in tumour progression[J].Nat Rev Cancer,2002,2(6):442-454.
[12]Chart AO.E-cadherin in gastric cancer[J].World J Gastroenterol,2006,12(2):199-203.
[13]Shih JY,Tsai MF,Chang TH,et al.Transcription repressor slug promotes carcinoma invasion and predicts outcome of patients with lung adenocarcinoma[J].Clin Cancer Res,2005,11(22):8070-8078.

