异甘草素固体脂质纳米粒中低分子肝素钠包封率的测定
巩慧敏,冯泽岸,邵婷玑,廖明琪,乔 华
(兰州大学 1.第一医院,2.药学院,甘肃 兰州 730000)
异甘草素固体脂质纳米粒中低分子肝素钠包封率的测定
巩慧敏1,2,冯泽岸1,2,邵婷玑1,2,廖明琪1,2,乔 华1
(兰州大学 1.第一医院,2.药学院,甘肃 兰州 730000)
目的 测定异甘草素固体脂质纳米粒中低分子肝素钠(LMWH)的包封率。方法 在Britton-Robinson(B-R)缓冲溶液中,天青A与LMWH相互作用,在662 nm处测定吸光度差值(△A),用△A对LMWH浓度进行线性回归。样品同法操作,测定LMWH的包封率。结果 LMWH的回收率在90.0% ~102.5%之间,线性范围为100~1 000μg/mL(r=0.999 1),异甘草素固体脂质纳米粒中LMWH的平均包封率为35%(n=5)。结论 此法操作简单、准确,适用于该制剂的质量评价。
异甘草素;固体脂质纳米粒;低分子量肝素钠;天青A;纳米粒;包封率
异甘草素(isoliquiritigenin,ISL)固体脂质纳米粒(solid lipid nanoparticles,SLN)是以 ISL为主药,以磷脂、十六醇、米高-2等为辅料,经肝素改性而得到的粒径在80~250 nm的新型给药系统。为了克服SLN静脉注射用药时容易引起凝血的缺点,同时增强制剂的物理稳定性和SLN在溶液中的分散性,用低分子肝素钠(LMWH)对ISL的SLN进行了改性。目前,LMWH的含量测定一般采用生物学方法和紫外分光光度法,即利用碱性染料作用后吸光度(A)值降低的特点进行肝素钠的含量测定。但SLN中含有磷脂、十六醇等辅料,对测定有干扰,为了消除SLN中辅料的干扰,本文以阳离子染料天青A与LMWH相互作用,在662 nm波长处测定吸光度差值(△A),并对测定条件进行了优化。
1 仪器与试剂
紫外-可见分光光度计(PerkinElmer Lambda 35);DT-224S电子分析天平(北京塞多利斯);H2050R高速冷冻离心机(湘仪离心机股份有限公司);YEH-A型液体快速混合器(江西医疗器械厂);pH计(Mettler Delta 350,梅特勒托利多仪器);超滤离心管(10000MWCO PES,Sartorius Stedim Bio-tech)。
ISL的 SLN(自制);天青 A(Azure A chloride Salt,Lot No:090201,Ri Chu Bio Science Co.,Ltd);LMWH(批号:080311,效价:105.1 Axa IU/mg,河北常山生化药业股份有限公司);ISL(上海邦成化工有限公司)。
2 方法与结果
2.1 吸收波长的选择
取10 mL量瓶,加Britton-Robinson(B-R)缓冲液2 mL,1 mg/mL天青A溶液100μL,加水至刻度。图1为该溶液的紫外吸收光谱图。B-R缓冲液中,天青A在662 nm处有最大吸收,当加入LMWH 100 μL后,最大吸收波长不发生变化,但A值下降,如图2。图2中由上往下7条曲线加入的LMWH浓度分别为100,200,300,400,600,800 和 1 000 μg/mL。加入的LMWH的浓度越大,A值下降越大,即△A越大。因此选择662 nm为测定波长,用△A值对LMWH进行测定。
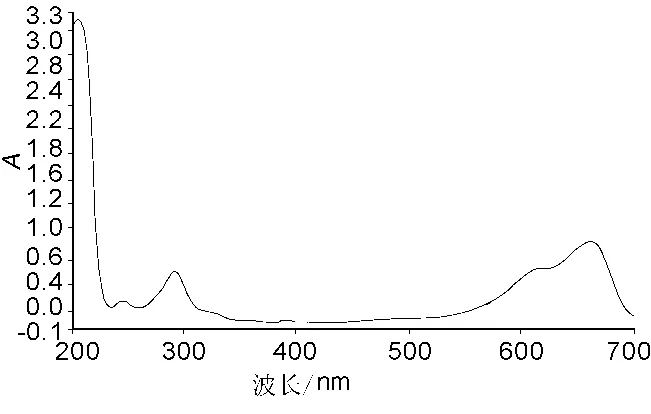
图1 天青A的吸收光谱图Fig.1 Absorption spectra of Azure A
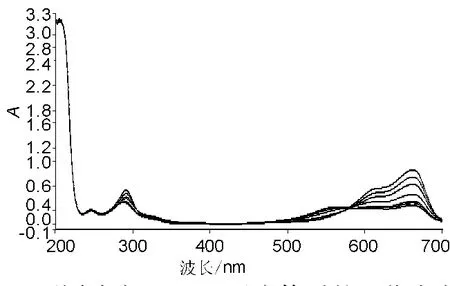
图2 不同浓度LMWH反应体系的吸收光谱图Fig.2 Absorption spectra of different LMWH concentrations
2.2 B-R缓冲液pH值和用量的选择
在B-R缓冲液中,LMWH与天青A作用,662 nm波长处△A增大。不同pH值的B-R缓冲液对LMWH与天青A的结合有影响。参考文献[1]的方法,取10 mL量瓶2个,一个加水100μL,另一个加400μg/mL LMWH溶液100μL,再分别加入400 μg/mL天青A溶液100μL,pH 1.5的B-R缓冲液2 mL,加水至刻度,涡旋混匀,于662 nm处测定A值,计算△A 值,平行测定5 份。再以 pH 2.0,2.5,3.0,4.0和5.0的B-R缓冲液替代 pH 1.5的 B-R缓冲液按上述方法同法操作,测定△A,对pH作图,结果见图3。由图3 看出,在 pH 1.5 ~5.0 之间,pH 2.5时△A最大,所以选用pH 2.5的B-R缓冲液。
取10 mL量瓶2个,空白加入水100μL,另一个加400μg/mL LMWH 溶液100μL,各加400μg/mL天青 A 溶液100μL,pH 2.5的B-R 缓冲液0.5 mL,加水至刻度,涡旋混匀,于662 nm处测定A值,计算△A,平行测定5份。再分别取pH 2.5的B-R缓冲液 1.0,1.5,2.0,3.0,4.0 和 5.0 mL 同法操作,计算△A。结果表明,B-R 缓冲液用量在1.0~3.0 mL内,△A较大且变化较小,用量大于3 mL或小于1 mL时,△A值减小,所以确定最佳用量范围为1.0~3.0 mL,结合文献报道[1],确定选用 B-R 缓冲液1.5 mL。
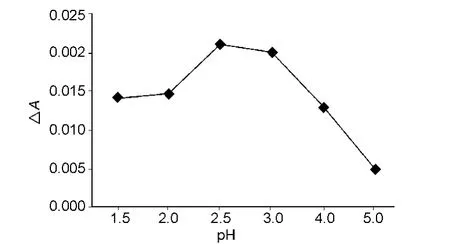
图3 pH值对△A的影响(n=5)Fig.3 Influence of pH on △A(n=5)
2.3 天青A用量
配制200~800μg/mL系列浓度的天青A溶液。取10 mL量瓶8个,分别加入各浓度天青A溶液100 μL,加 pH 2.5 B-R 缓冲液 1.5 mL,400 μg/mL LMWH溶液100μL,涡旋混匀,加水至刻度,待反应完全测定△A值,平行测定5份。结果如图4。天青A浓度在600μg/mL时△A最大,所以选择天青A的浓度为600μg/mL。
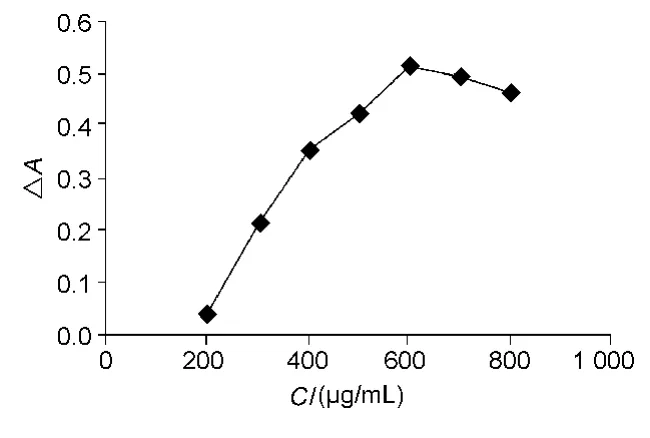
图4 天青A浓度对△A的影响(n=5)Fig.4 Influence of Azure A concentration on △A(n=5)
2.4 反应时间和体系的稳定性
取10 mL量瓶4个,分别加入600μg/mL天青A溶液100μL。空白加水100μL,其他分别加入100,200,400 μg/mL LMWH 溶液100 μL,pH 2.5 BR缓冲液1.5 mL,加水至刻度,涡旋混匀,于662 nm波长处测定A值,平行测定5份。结果见表1。由表1可以看出,在室温下反应20 min即达到反应平衡,体系具有很好的稳定性,A值在2 h内基本保持稳定。
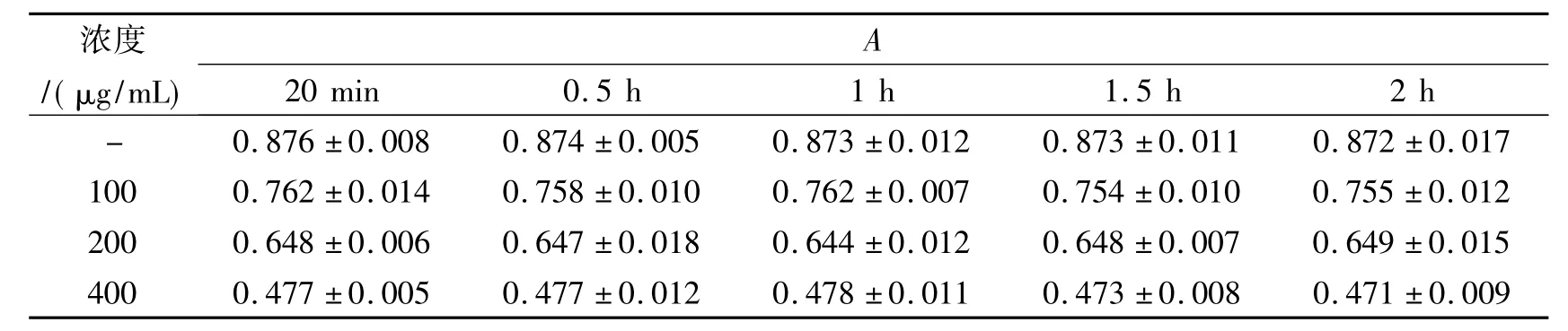
表1 反应时间对体系稳定性的影响(室温,n=5)Tab.1 Influence of reaction time on system stability(room temperature,n=5)
2.5 SLN原辅料对测定的影响
2.5.1 SLN原辅料的吸收光谱 ISL的SLN中含有磷脂、泊洛沙姆、硬脂酸、十六醇、中碳链三苷脂等辅料及异甘草素,称取处方量的SLN原辅料于10 mL量瓶中,加水稀释到刻度,吸收光谱图如图5。可以看出,ISL及辅料在662 nm波长处基本无吸收,因此,原辅料本身对LMWH的测定基本无干扰。
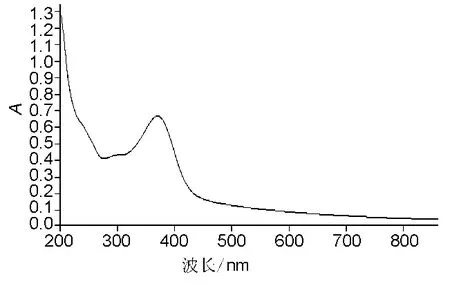
图5 ISL的SLN辅料的吸收光谱图Fig.5 Absorption spectra of ISL solid lipid nanoparticles materials
2.5.2 SLN原辅料对天青A与LMWH相互作用的影响 取ISL的SLN混悬液(不含LMWH)200μL,加甲醇200μL,破坏SLN并使其溶解。取10 mL量瓶3个,各加入上述溶液200μL、50%甲醇溶液200μL、水200 μL,分别加入 pH 2.5的 B-R 缓冲液1.5 mL,600 μg/mL天青 A 溶液 100 μL,加水至刻度,涡旋混匀,室温静置20 min,于662 nm处测定△A值,平行测定5份。结果显示,含SLN原辅料的样品△A值为0.395±0.007,加入50%甲醇溶液的△A值为0.455±0.020,加水的△A 值为 0.472±0.040,将测定结果进行 t检验分析,P <0.05,差异有统计学意义。因此,SLN原辅料和甲醇对天青A与LMWH的作用都有影响,因此,在反应体系中,应平行加入甲醇溶液以消除其影响。
2.6 包封率的测定
2.6.1 标准曲线及线性 取10 mL量瓶10个,空白管加水 100 μL,其他加入 1 000,800,700,600,500,400,300,200,100 μg/mL LMWH 溶液 100 μL,加600μg/mL天青 A溶液100μL,pH 2.5的 B-R缓冲液1.5 mL,甲醇溶解并破坏的不含LMWH的SLN溶液200μL,加水至10 mL,涡旋混匀,室温放置20 min,以水为空白,测定各管的A值。空白管为A0,含有LMWH的为A,计算△A=A0-A。以△A对LMWH浓度进行一元三次多项式回归,得标准曲线方程:△A=0.000 9 C3-0.020 4 C2+0.168 6 C -0.013 7,r=0.999 1,见图 5。LMWH 浓度在 100 ~1 000μg/mL范围内与△A线性关系良好。

图6 LMWH含量测定的标准曲线Fig.6 Standard curve of LMWH determination
2.6.2 回收率与重现性 取LMWH溶液各5份,按照2.6.1项下方法操作,测定A值,同日内测定5次,代入标准曲线方程得实测浓度,实测浓度跟配制浓度相比,计算LMWH的回收率,连测3 d,计算日内及日间精密度。结果见表2。

表2 LMWH各浓度点的回收率与精密度(n=5)Tab.2 Recovery and precision of every LMWH concentration(n=5)
2.7 样品分析
2.7.1 SLN中LMWH的总量测定 精确吸取ISL的SLN混悬液200μL(LMWH总浓度为200μg/mL),加入甲醇200μL破坏并溶解后,取200μL于10 mL量瓶中,加入600μg/mL天青A溶液100 μL,pH 2.5 B-R 缓冲液 1.5 mL,加水至刻度,涡旋混匀。室温下放置20 min,于662 nm处测定其△A,代入标准曲线方程,得实测浓度为(201.0±1.5)μg/mL。
2.7.2 游离LMWH的测定 吸取一定量 ISL的SLN混悬液,置于超滤离心管中,14 600 r/min离心60 min,取超滤液100μL,置10 mL量瓶中,加600 μg/mL天青 A 溶液100 μL,pH 2.5 B-R 缓冲液1.5 mL,甲醇100μL,加水至刻度,涡旋混匀。室温放置20 min,662 nm处测定A值。以不含LMWH的ISL的SLN同法处理作为空白管,以水为空白,测定A值(A0)。△A=A0-A,代入标准曲线方程,计算游离LMWH浓度,其实测浓度为(70.4±0.6)μg/mL。
2.7.3 包封率的计算 SLN中LMWH的总量记为△A总,游离LMWH的量记为△A游,则 SLN中 LMWH的包封率=(△A总-△A游)/△A总×100%。测得样品中LMWH的平均包封率为35%(n=5)。
3 讨论
LMWH是肝素钠经裂解获取的硫酸氨基葡聚糖片段,常以钠盐形式存在,在溶液中带有大量的负电荷。天青A是一种阳离子染料,在溶液中解离形成无色的阴离子和有色的阳离子,天青A在溶液中氨基带正电荷,可与LMWH中带负电荷的硫酸酯基和硫酸氨基基团结合[2],结合型的天青A紫外吸收特征发生改变,使溶液在662 nm处A值降低,且A值的降低与LMWH的浓度成比例,因此,可用本方法对LMWH浓度进行定量分析。
本实验发现,ISL的SLN本身在662 nm波长处基本无吸收,但其对LMWH与天青A的结合有影响,所以在样品测定过程需加入ISL的SLN,以消除对反应的影响。ISL的SLN本身对LMWH与天青A结合反应造成影响的可能原因为ISL的SLN中含有表面活性剂大豆卵磷脂和泊洛沙姆,其中大豆卵磷脂含有磷酸基及季铵基,是两性分子,在溶液中可与天青A或LMWH发生相互作用,使LMWH和天青A结合比例受到影响,导致溶液A值升高,△A减小。实验发现,甲醇的加入对A值也有影响,其可能原因为影响了溶液中各种离子的解离,干扰了LMWH和天青A的解离和结合过程,造成了A值的改变。为了消除影响,在LMWH分析方法建立过程中,加入了少量甲醇溶解的ISL的SLN。
按照优化的实验条件,LMWH浓度与△A在100~1 000μg/mL呈三阶多项式关系,实验对每个浓度点进行了精密度和回收率测定,日内和日间精密度分别在 1.03% ~6.15%和 1.20% ~5.85%之间,回收率在90.0% ~102.5%之间,满足测定要求,其工作曲线变化趋势与文献报道[3]一致,但线性回归结果优于文献报道[1]。
在样品测定过程中,为了检测分子质量量5 000~8 000的LMWH能否完全通过10 kD MWCO超滤离心管,同时对ISL的SLN完全截留,本实验配制了LMWH溶液,在超滤离心前后测定原溶液和超滤液的浓度,结果表明超滤前后溶液浓度相同,10 kD MWCO的超滤离心管对游离的LMWH无截留;经激光粒度分析,ISL的SLN粒径均大于80 nm,其胶团分子总质量量远超10 kD,因此,该超滤离心管可将ISL的SLN有效截留。故本实验可用于该SLN中LMWH包封率测定,且操作简单快速。
[1]孙 伟,焦 奎,牛学良,等.用灿烂甲酚蓝褪色分光光度法测定肝素钠的研究[J].光谱学与光谱分析,2005,25(8):1322-1324.
[2]刘本举,李新梅.碱性染料的pH大于7吗?[J].生物学教学,2005,30(1):28.
[3]Jiao Qingcai,Liu Qian.Characterization of the interaction between methylene blue and glycosaminoglycans[J].Spectrochim Acta A,1999,55:1667-1673.
Encapsulation efficiency determination of low molecular weight heparin in isoliquiritigenin nanoparticle
GONG Hui-min1,2,FENG Ze-an1,2,SHAO Ting-ji1,2,LIAO Ming-qi1,2,QIAO Hua1
(1.The No.1 Hospital of Lanzhou University,2.School of Pharmacy,Lanzhou University,Lanzhou 730000,China)
Purpose To determine the encapsulation efficiency of low molecular weight heparin(LMWH)in isoliquiritigenin(ISL)nanoparticle.Methods In Britton-Robinson(B-R)buffer solution,Azure A chloride Salt has a maximum absorption peak at 662 nm and the absorbance reduced by the reaction with LMWH.Polynomial regression between absorbance and LMWH concentration was made.ISL nanoparticle and ultrafiltrate were treated by the similar method and absorbance was recorded.The contents of LMWH and entrapment efficiency were calculated respectively.Results Recoveries of LMWH were between 90.0%-102.5%,the linear ranges of determination of LMWH was 100-1 000 μg/mL(r=0.999 1).Average encapsulation efficiency of LMWH in ISL nanoparticle was 35%(n=5).Conclusion The method was convenient and accurate.It is suitable for the quantity control of ISL nanoparticle.
isoliquiritigenin;nanoparticle;low molecular weight heparin;Azure A chloride salt,nanoparticle;encapsulation efficiency
R944.9;R927.1
A
1005-1678(2012)04-0381-04
2011-06-28
甘肃省中医药科研立项课题(GZK-2008-21)
巩慧敏,女,硕士研究生;乔 华,男,通信作者,硕士,主任药师,副教授,硕导,Tel:13109431668,E-mail:qhbrian@163.com。

