新型抗癫痫药物左乙拉西坦制备技术研究进展
王井玲,欧阳启,钟成刚,石海芳,何军邀,王 普
(浙江工业大学 药学院,浙江 杭州 310014)
新型抗癫痫药物左乙拉西坦制备技术研究进展
王井玲,欧阳启,钟成刚,石海芳,何军邀,王 普
(浙江工业大学 药学院,浙江 杭州 310014)
左乙拉西坦(LEV)是一种吡拉西坦衍生物,具有治疗局限性和原发性癫痫、预防癫痫发作的独特药理作用,疗效高,耐受性好,是一种具有广阔发展前景的新型抗癫痫药物。目前合成LEV有多种方法。本文主要从化学法和生物法两方面综述了LEV的制备方法,并对生物催化制备LEV的工业化前景进行了展望。
左乙拉西坦;不对称合成;不对称拆分;生物拆分
左乙拉西坦(levetiracetam,LEV,商品名为开浦兰®),是比利时UCB公司研发的一种吡拉西坦类药物,化学名为(S)-α-乙基-2-氧-1-吡咯烷乙酰胺[1]。与传统的治疗癫痫的药物相比,LEV具有全新的作用机制,可作为添加剂治疗儿童各型癫痫病,尤其对于复杂局限性发作、肌阵挛发作等具有较好的治疗效果。通过大量的临床前以及临床研究,该药具有选择性治疗局限性和原发全身性癫痫的作用[2]。此外,LEV对双相情感障碍、神经痛治疗和偏头痛的预防等也有一定的作用[3]。同时,与同类药物相比,LEV具有以下优点:(1)有效量和中毒量相差大,用药安全,且副作用小;(2)主要代谢途径不经过肝药酶系统,与其它抗癫痫药物无相互作用;(3)口服吸收迅速,绝对生物利用度接近100%,呈线性药代动力学[4]。
癫痫病是一种长期性且难以治愈的疾病,对于一般患者而言,服用LEV进行治疗将是一笔不小的经济负担。因此,开发操作简便、成本低廉、环境友好的合成LEV的工艺路线,不仅可满足广大癫痫病患者的迫切需求,同时也可填补我国长期以来该类药物品种单一的现状,具有显著的社会和经济效益。目前,LEV制备方法主要有不对称合成法和光学异构体拆分法。不对称合成法主要包括手性源合成法和不对称氢化催化法;拆分法主要包括化学拆分法、生物拆分法和色谱拆分法。鉴于此,本文详述了国内外LEV相关制备技术的研究进展,并对生物催化制备LEV的工业化前景进行了展望。
1 不对称合成法
1.1 采用不对称合成法
不对称合成技术是有机合成化学的一个重要组成部分,近几十年来,不对称合成领域一直是众多科研人员研究的热点。化学催化不对称合成只需少量催化剂即可将大量潜手性底物立体选择性地转化为手性化合物,具有收率高(理论产率可达100%)、反应速度快、产物的手性易通过改变配体的手性来修饰等优点。但该方法需使用光学纯的手性催化剂,不仅难以直接获得,并且价格昂贵,化学性质非常活泼,不够稳定[5];同时也存在催化剂的循环使用效率不高等问题[6]。近年来,利用过渡金属作为催化剂的不对称合成反应得到了广泛的研究[7],但该类金属容易残留在药物中间体中,不易除去,会对人类健康产生不良影响。这些都限制了该类催化剂在不对称合成反应中的应用。
Surtees等[8]以2-氧代丁酮甲酯和2-吡咯烷酮为起始原料,在POCl3的催化下,于甲苯中回流生成(Z)-2-[2-氧代四氢-1-吡咯烷]-2-丁烯酸甲酯,经氨解,继而在手性催化剂Rh(Ⅰ)或Ru(Ⅱ)及0.5 mPa氢气中,进行催化氢化,分离纯化即可获得LEV,转化率大于83%,光学纯度可达98%(见图1)。但是该路线除存在金属催化剂容易残留、使用效率不高等问题外,反应条件苛刻,需高压反应,对厂房和设备的要求较高。
Shriram等[9]以丁醛为起始原料,利用脯氨酸催化其α位不对称氨基氧化反应,再在Pd/C催化剂的作用下生成(R)-1,2-丁二醇,经一系列复杂反应(见图2),合成得到LEV。虽然获得的产物光学纯度很高(e.e.>99.5%),但反应的总收率较低,仅为29.7%,且反应路线长而复杂,反应过程中加入了Pd/C催化剂,使用该催化剂进行保护与脱保护成本较大,且催化剂容易失活。
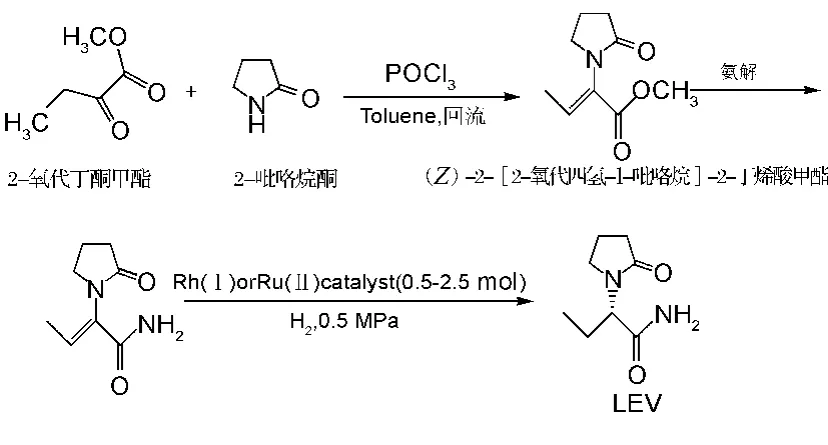
图1 不对称氢化催化法制备左乙拉西坦合成路线
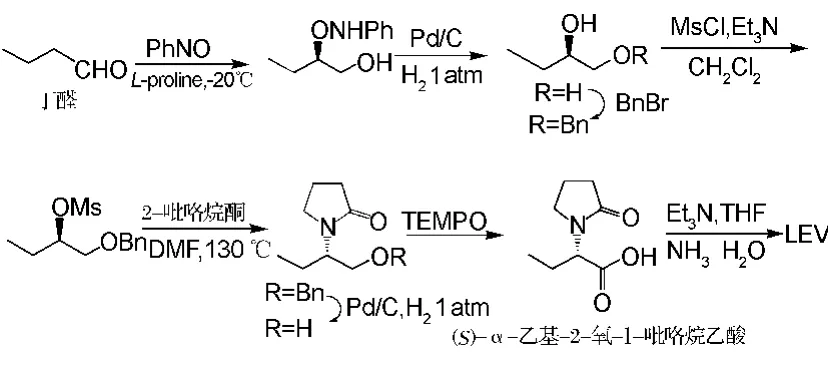
图2 利用脯氨酸制备左乙拉西坦合成路线
1.2 采用手性源法进行合成
手性源合成法是以天然手性物质为原料,经构型保持或构型转化等化学反应合成新的手性物质的方法。在手性源合成中,所有的合成转变反应都必须是高选择性的,并通过反应最终将手性源分子转变成目标手性分子。采用手性源合成的方法需要利用光学纯的物质作为起始反应物,且其用量多,价格昂贵[10]。但如果能选用价廉的手性物质作为手性源,并能在反应中对其有效利用,也不失为一种较好的手性合成方法。
目前文献中LEV的手性源合成主要以(S)-2-氨基丁酸和L-蛋氨酸作为手性原料,经一系列的化学反应后得到LEV。
Ates等[11]利用手性的(S)-2-氨基丁酸为合成原料,先对其酯化得到氨基酯,再与4-溴丁酸乙酯发生分子间亲核取代反应,在2-羟基吡啶存在下闭环生成(S)-α-乙基-2-氧-1-吡咯烷乙酸,经氨解,重结晶后得到LEV,产率为40%左右,非对映体过量值(e.e.)为99.9%(见图3)。由于氨基取代反应时氨基上的两个氢具有同等活性,在得到产物1的同时,也得到较多的副产物双烷基取代酯,使得产率较低。
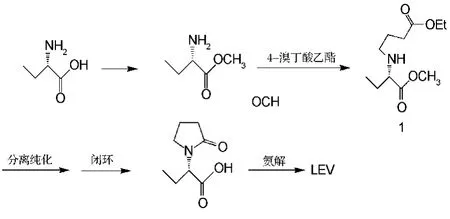
图3 (S)-2-氨基丁酸为原料制备左乙拉西坦合成路线
陈文婕等[12]以 L-蛋氨酸为原料,经 NaBH4和 NiCl2·6H2O,Raney镍等还原试剂脱硫甲基化[13],酯化,氨解,酰胺化及分子内缩合、成环反应最终得到LEV(图4)。该合成路线的反应条件不苛刻,原料易得,操作简单,收率高(45.5%~51.6%,以蛋氨酸计)。但脱硫反应过程中产生的硫化合物容易使催化剂活性Raney镍中毒,从而导致催化剂用量较多。此外,在干燥状态下,活性Raney镍暴露于空气中易燃烧,因此在大规模工业化生产时应用该工艺具有一定的危险性。该工艺起始原料为含硫手性氨基酸,其成本较高,并且反应中易产生重金属污染。

图4 L-蛋氨酸为原料制备左乙拉西坦合成路线
2 光学异构体拆分法
2.1 化学拆分法合成
化学拆分法是合成手性药物及其中间体广泛使用的一种方法,该方法利用手性试剂与外消旋体反应,生成两个非对映异构体,然后再根据它们的物理性质(溶解度,蒸汽压,吸收系数等)不同而将其分开,达到拆分目的。通常拆分碱性物质使用酸性拆分剂(酒石酸及其衍生物、樟脑磺酸、扁桃酸以及各种天然氨基酸等),拆分酸性物质使用碱性拆分剂(不同苯基取代的α-苯乙胺和一些天然生物碱,如(-)-马钱子碱、(-)-番木鳖碱和 D-(-)-麻黄碱等)[14]。
Tao等[15]报道了利用L-酒石酸作为拆分剂,对外消旋的2-氨基丁酰胺进行拆分,得到(S)-2-氨基丁酰胺,然后再与4-氯丁酸酯进行反应得到LEV(图5)。该拆分法的效率较低,R-型对映体无法回收利用,且最后一步反应需要使用具有致癌作用的烷基化试剂,容易残留,危害身体健康。

图5 利用L-酒石酸制备左乙拉西坦合成路线
刘跃金等[16]将外消旋体 α-乙基-2-氧-1-吡咯烷乙酸与光学纯的拆分试剂(R)-(+)-α-苯基乙胺[17]反应生成盐,经碱化、酸化、DCC脱水、冷却结晶后,将S-型分开,分离得到相应的2个对映体。该拆分过程较长,原料损失较大,反应的总收率仅为26.9%,e.e.值大于99%。鉴于用此底物得到的拆分效果欠佳,Forcato 等[18]外消旋体 α-乙基-2-氧-1-吡咯烷乙酸甲酯为底物,同样采用手性试剂(R)-(+)-α-苯基乙胺拆分得到(S)-α-乙基-2-氧-1-吡咯烷乙酸,经氨解,重结晶后制得 LEV,产率为 44.6%,e.e.值 99.9%。不仅缩短了反应步骤,也使产率提高了65.8%。但这两种化学拆分使用的手性拆分剂用量大,通常只能间歇生产,还有可能存在拆分剂降解或外消旋化等问题。
虽然化学拆分法是制备手性药物普遍采用的方法,但利用化学拆分法制备LEV普遍存在一些缺点,在实际应用中具有一定的局限性,如:拆分剂和溶剂的选择较为盲目;对手性试剂的光学纯度要求高,且其价格昂贵、工艺复杂、条件苛刻;非目标对映体未得到合理利用,导致资源浪费,甚至引发环境污染;需经多次重结晶,以及产率通常不高等问题。
2.2 色谱拆分法合成
目前,色谱技术多可用于手性拆分,可将外消旋体与手性固定相作用生成非对映异构体。该方法简便,廉价,分离效果好。色谱手性拆分方法主要有:超临界流体色谱法,气相色谱法,毛细管电泳法,薄层色谱法,高效液相色谱法等。随着各种类型手性固定相制备技术的成熟,以及多种色谱技术的综合运用,制备型色谱尤其是模拟移动床(Simulated Moving Bed,SMB)色谱技术在拆分对映体上的应用逐渐增多,有望成为大规模制备单一对映体的首选技术[19-20]。Futagawa等[21]利用工业手性色谱柱拆分非对映体乙拉西坦、中间体2-(2-氧代-1-吡咯烷)丁酸甲酯均可获得较好的分离度。基于色谱法拆分过程不需添加任何手性试剂或催化剂,具有快速、操作简便、回收率高等优点,广泛应用于新药的研发过程,可大大加快新药的开发进度[22]。但其最大的缺点是手性固定相和设备的初期投入较大,另外流动相的消耗量大,造成产品浓度过低,溶剂回收能耗大,目前主要用于成分分析或获得少量纯异构体。
2.3 生物拆分法合成
生物法拆分外消旋体化合物是近年来研究的热点之一,属于动力学拆分[23]。生物拆分法可利用完整的微生物细胞或从微生物中提取酶作为生物催化剂,与化学拆分相比,生物催化具有立体选择性强、反应条件温和、操作简便、成本较低、环境友好,且能实现一些化学反应难以完成的反应等优点。但生物催化也具有菌种和酶的获得困难,产酶时间长、容易受到杂菌影响等缺点,因此,目前一般采用的方法是将生物催化与化学合成相耦合,既可缩短反应步骤,又能提高原料的利用率,同时减少了能源驱动,对环境友好,以实现优势互补[24-26]。微生物不对称合成与酶催化相比,利用微生物催化不需要对酶进行分离提纯,在需辅酶循环的反应过程中,不需额外添加昂贵的辅酶,在催化反应过程中只需添加廉价的辅助底物(如蔗糖或葡萄糖)就可实现辅酶的再生。早期的无酶的动力学拆分法,用手性试剂与一对对映体以不同的速率反应,根据速率差值而得到目标对应异构体[27]。据文献报道,生物法拆分合成LEV主要由产腈水解酶和脂肪酶的微生物介导。
2.3.1 利用腈水解酶合成 腈水解酶合成法是直接催化腈水解、一步生成羧酸的方法。近年来,许多专家学者利用腈水解酶实现了有机羧酸的合成,而且报道的腈水解酶具有高度的化学、区域和立体选择性[28]。在腈水解酶的催化作用下,外消旋腈化合物不仅能转化成光学活性的羧酸,而且还能获得较高的对映体过量值。采用腈水解酶催化水解路线为目前化学法较难解决的问题提供了新的思路和方法。
Tucker等[29]通过构建产腈水合酶NH33的大肠杆菌基因工程菌,利用其细胞裂解液拆分外消旋的2-吡咯烷腈制备LEV(图6),产率和 e.e.值分别为43%和94%。在该反应中,(R)-2-吡咯烷腈可通过再消旋化以实现循环利用,与化学催化相比具有更高的原子经济性(atom economy),且能进行温和的SN2反应,从而避免了使用具危险性的烷基化试剂[30]。
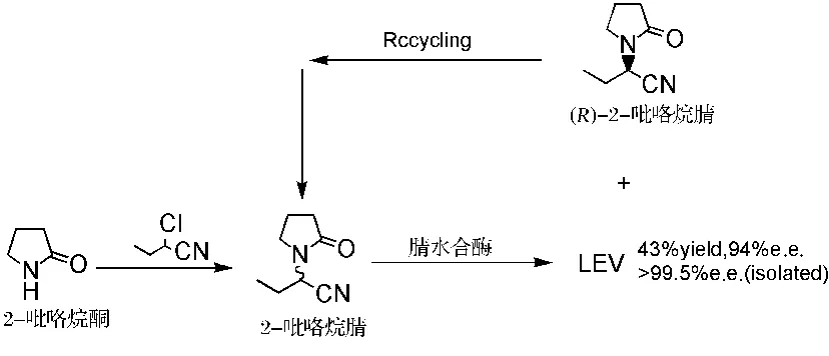
图6 腈水解酶用于左乙拉西坦的合成
2.3.2 利用脂肪酶合成 现在人们已逐渐广泛地利用脂肪酶和酯酶来拆分外消旋醇和羧酸。脂肪酶是工业上最常用的酶之一,可拆分外消旋的醇类、酸类、酯类和胺类等手性化合物。
笔者所在研究室选育得到了具有较高立体选择性和催化活性的产脂肪酶菌株--耐酪氨酸冢村氏菌(Tsukamurella tyrosinosolvens)E105,研究了该菌株在水相体系中催化α-乙基-2-氧-1-吡咯烷乙酸乙酯不对称水解制备得到(S)-α-乙基-2-氧-1-吡咯烷乙酸,产率可达 48.1%,产物 e.e.值大于99%[31]。该法具有立体选择性好,产率高,环境友好等优点。(S)-α-乙基-2-氧-1-吡咯烷乙酸经过氨解后即可得到(S)-α-乙基-2-氧-1-吡咯烷乙酰胺,即 LEV。
3 展望
LEV作为一种具有优良治疗效果和全新作用机制的新型抗癫痫药,其制备一直受到广泛的关注。目前对于其合成方法已进行了许多研究,包括化学法和生物法,都旨在制备得到高光学纯度的(S)-α-乙基-2-氧-1-吡咯烷乙酰胺[32]。生物法由于其独特的优点,势必成为今后制备手性药物的重要方向。相信随着生物产业的不断发展,生物转化技术在制备手性(S)-α-乙基-2-氧-1-吡咯烷乙酰胺中将发挥重要的作用。笔者所在研究室已筛选得到催化活性和立体选择性均较高的微生物菌株,为合成单一光学活性的(S)-α-乙基-2-氧-1-吡咯烷乙酰胺奠定了良好的基础,具有一定的工业化应用前景。
[1]Wu T,Chen C C,Chen T C,et al.Clinical efficacy and cognitive and neuropsychological effects of levetiracetam in epilepsy:An open-label multicenter study[J].Epilepsy Behav,2009,16(3):468-474.
[2]孙启泉,施介华,刘 燕,等.左乙拉西坦右旋对映异构体的HPLC 测定[J].中国医药工业杂志,2008,39(8):613-614.
[3]Genton P,Vleymen V B.Piracetam and levetiracetam:close structural similarities but different pharmacological and clinical profiles[J].Epileptic Disord,2000,2(2):99-105.
[4]王 普,袁 帅,何军邀.柱前衍生化气相色谱法测定α-乙基-2-氧-1-吡咯烷乙酸光学异构体[J].药物分析杂志,2010,30(10):1891-1894.
[5]Brandau S,Landa A,Franzen J,et al.Organocatalytic conjugate addition of malonates to alpha,beta-unsaturated aldehydes:Asymmetric formal synthesis of(-)-paroxetine,chiral lactams,and lactones[J].Angew Chem Int Ed Engl,2006,45(26):4305-4309.
[6]赵圣印.手性2-氨基-1-苯基乙醇类化合物的不对称合成研究进展[J].有机化学:2007,27(11):1309-1317.
[7]Pamies O,Backvall J E.Combination of enzymes and metal catalysts.A powerful approach in asymmetric catalysis[J].Chem Rev,2003,103(8):3247-3262.
[8]Surtees J,Marmon V,Differding E,et al.2-Oxo-1-pyrroliding derivatives,process for preparing them and their uses:US,6713635[P].2004-03-30.
[9]Shriram PK,Arumugam S.A short enantioselective synthesis of the antiepileptic agent,levetiracetam based on proline-catalyzed asymmetric α-aminooxylation[J].Tetrahedron Lett,2006,47(38):6813-6815.
[10] Dolitzky B Z,Hildesheim J,Finogueev S.Process for producing levetiracetam:WO,2004069796[P].2004-08-19.
[11] Ates C,Surtees J,Bureau A C,et al.Oxopyrrolidine compounds,preparation of said compounds and their use in the manufacturing of levetiracetam and analogues:US,7563912[P].2009-07-21.
[12]陈文婕,韦亚锋,江立新,等.一种左乙拉西坦的制备方法:中国,101624362A[P].2010-01-13.
[13] Cossement E,Motte G,Geerts JP,et al.The preparation of(S)-alpha-ethyl-2-oxo-pyrrolidineacetamide:GB,2225322[P].1990-05-30.
[14]李根容,李志良.手性药物拆分技术研究进展[J].中国新药杂志,2005,14(8):969-974.
[15] Tao Junhua,Xu Jianghe.Biocatalysisin development of green pharmaceutical processes[J].Curr Opin Chem Biol,2009,13(1):43-50.
[16]刘跃金,陈道鹏,梁 良,等.左乙拉西坦及其衍生物的合成[J].中国新药杂志,2007,16(11):860-864.
[17] Gobert J,Geerts J P,Bodson G.(S)-Alpha-Ethyl-2-oxo-1-Pyrrolidineacetamide:US,4837223[P].1989-06-06.
[18] Forcato M,Michieletto I,Maragni P,et al.Process for preparation of levetiracetam:US,20100076204[P].2010-03-25.
[19] Schulte M,Strube J.Preparative enantioseparation by simulated moving bed chromatography[J].J Chromatogr A,2001,906(1-2):399-416.
[20] Seidel-Morgenstem A,Kessler LC,Kaspereit M.New developments in simulated moving bed chromatography[J].Chem Eng Technol,2008,31(6):826-837.
[21] Futagawa,Tooru C,Jean-Pierre C,et al.Process for the preparation of levetiracetam:US,6107492[P].2000-08-22.
[22] Joao M M,Rui CR,Mario F J,et al.Chiral separation by two-column,semi-continuous,open-loop simulates moving-bed chromatography[J].JChromatogr A,2010,1217(33):5407-5419.
[23]鲁海英,陈 静,郑裕国,等.手性扁桃酸的合成及外消旋扁桃酸拆分的研究进展[J].现代化工,2007,27(2):66-71.
[24] Sheldon R A.E factors,green chemistry and catalysis:an odyssey[J].Chem Commum,2008,29:3352-3365.
[25] Ran N,Zhao L,Chen Z,et al.Recent applications of biocatalysis in developing green chemistry for chemical synthesis at the industrial scale[J].Green Chem,2008,10:361-372.
[26] Woodley J M.New opportunities for biocatalysis:making pharmaceutical processes greener[J].Trends Biotechnol,2008,26(6):321-327.
[27] Xu Qing,Xie Yongli,Geng Xiaohong,et al.Enzymatic kinetic resolution of racemic cyanohydrins via enantioselective acylation[J].Tetrahedron,2010,66(3):624-630.
[28] Panova A,Mersinger L J,Liu Q,et al.Chemoenzymatic synthesis of glycolic acid[J].Adv Synth Catal,2007,349(8-9):1462-1474.
[29] Tucker J L,Xu L,Yu W H,et al.Chemoenzymatic processes for preparation of levetiracetam:WO,2009009117[P].2009-01-15.
[30]郑裕国,薛亚平,柳志强,等.腈转化酶在精细化学品生产中的应用[J].生物工程学报,2009,25(12):1795-1807.
[31]王 普,何军邀,袁 帅.耐酪氨酸冢村氏菌及其催化制备(s)-α-乙基-2-氧-1-吡咯烷乙酸:中国,101748087A[P].2010-06-23.
[32] Gade SR,Mallepalli SR,Muvva V,et al.Processes for the preparation of levetiracetam:WO,2008077035[P].2008-06-26.
Research progress in preparation technique of Levetiracetam
WANG Jing-ling,OUYANG Qi,ZHONG Cheng-gang,SHI Hai-fang,HE Jun-yao,WANG Pu
(School of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
TQ463.4
A
1005-1678(2012)04-0504-05
2011-07-09
浙江省新苗人才计划项目(2010R403070);浙江省教育厅科研项目(Y201018521);浙江省制药重中之重学科开放基金资助项目(20100609);浙江省级公益性技术应用研究计划项目(2011C33005)
王井玲,女,微生物与生化药学硕士研究生,E-mail:wangjingling1987@126.com;王 普,女,通信作者,教授,博士生导师,E-mail:wangpu@zjut.edu.cn。

