抗HIV-1药物及其复方制剂研究新进展
冯婧劼, 张庆文, 徐云根*
(1.中国药科大学药物化学教研室,江苏 南京210009;2.上海医药工业研究院化学制药部,上海200437)
自1987年首个抗HIV-1药物齐多夫定问世以来,人类在抗HIV-1研究领域不断探索,最终使艾滋病从绝症转变为可控的终身慢性疾病。然而,目前的抗HIV-1药物并不能彻底清除患者体内的HIV-1,且长期使用带来的副作用以及耐药性问题日渐突出,因此,开发新靶点的抗HIV-1药物成为当务之急。本文对抗HIV-1药物及其复方制剂的研究进展作一综述。
1 抗HIV-1药物的类别及相关药物
针对HIV-1进攻人体T淋巴细胞的过程:吸附、进入、脱壳、逆转录、整合、复制、转录、翻译、装配和成熟[1],可将抗HIV-1药物分为7类,包括核苷类逆转录酶抑制剂(NRTI)、核苷酸类逆转录酶抑制剂(NtRTI)、非核苷类逆转录酶抑制剂(NNRTI)、蛋白酶抑制剂(PI)、整合酶抑制剂(INI)、融合抑制剂(FI)和复合受体抑制剂(CRI)。
1.1 核苷类逆转录酶抑制剂
NRTI为核酸类似物,当其进入被感染细胞后,经过3个胞内磷酸化过程插入病毒反义DNA中;由于NRTI缺少3'羟基,不能形成双链DNA,使病毒失去复制模板,并终结DNA链的合成,从而抑制病毒的复制[2]。
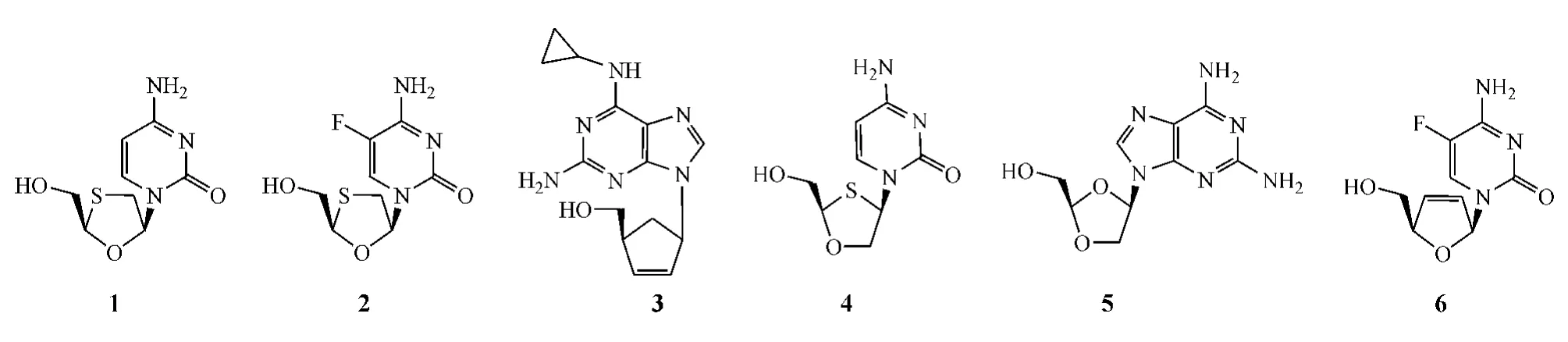
目前已上市的NRTI包括齐多夫定(zidovudine)、地达诺新(didanosine)、扎西他滨(zalcitabine)、司他夫定(stavudine)、拉米夫定(lamivudine,1)、恩曲他滨(emtricitabine,2)和阿巴卡韦(abacavir,3),它们均表现出明显的HIV-1抑制活性。其中,拉米夫定因病毒抑制率高、安全性好,一度成为抗HIV-1药物中的宠儿。恩曲他滨的结构与拉米夫定类似,只是在其胞嘧啶环5位引入了一个氟原子,且其作用机制也与拉米夫定类似,抗病毒活性却为拉米夫定的4~10倍。此外,与拉米夫定相比,恩曲他滨还有以下优点:毒性小,安全性更佳,儿童对其耐受性良好,更适合儿童服用;水溶性好,可以液体形式服用,患者依从性更好;可1日1次给药[3]。阿巴卡韦+拉米夫定+依非韦伦的联用疗效虽与齐多夫定+拉米夫定+依非韦伦的联用相当(用药48周后,两联用给药组中每毫升血浆HIV-1 RNA水平低于50拷贝的受试患者比例分别为70%和69%)[4],然而,阿巴卡韦可能会引起严重甚至致命的过敏反应,且会增加心脏病突发风险,故其临床使用受到限制。
目前进入临床研究的NRTI有阿立他滨(apricitabine,4)、氨多索韦(amdoxovir,5)和艾夫他滨(elvucitabine,6),它们的共同特点是对耐其他NRTI的患者也有疗效。例如,在具耐药突变位点M184V的51名患者中进行的临床试验显示:阿立他滨(600和800 mg,bid)和拉米夫定(150 mg,bid)组患者在用药21 d后,每毫升血浆病毒载量分别下降0.71log10拷贝、0.90 log10拷贝和0.03 log10拷贝[5]。目前,阿立他滨处于美国FDA快速审批阶段,有望成为第8个获批的NRTI;氨多索韦正处于Ⅱ期临床研究阶段;艾夫他滨则因存在严重的骨髓抑制等副作用而已被中止进一步开发。
1.2 核苷酸类逆转录酶抑制剂
NtRTI的作用机制与NRTI类似。从结构式上看,NtRTI已结合了1个磷酸基团,当其装配入DNA链后,该基团不易被磷酸酯酶水解,药物稳定性得到提高。且与NRTI相比,NtRTI的疗效和副作用均增加。
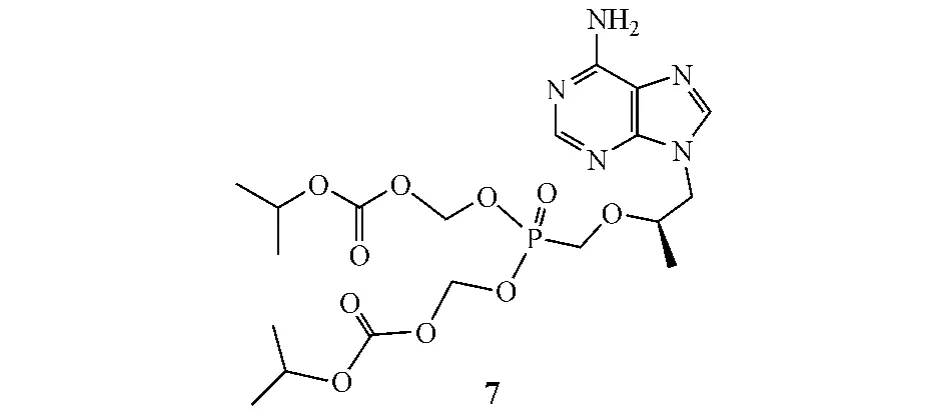
替诺福韦二吡呋酯(tenofovir disoproxil,7)为美国FDA批准的首个用于HIV-1感染的新型NtRTI,现已成为常用抗HIV-1处方,且其还可用于艾滋病的预防。一项名为CAPRISA004的临床研究显示:含量为1%的替诺福韦酯凝胶可使女性受试者HIV-1感染风险降低39%[6]。
NRTI和NtRTI的共同缺陷是会诱发病毒的修复机制,将不能成链的核苷酸去除,从而产生耐药性或造成剂量依赖性。此外,这两类药物还可竞争性抑制靶细胞的DNA多聚酶活性。DNA多聚酶是与DNA复制和修复有关的重要酶,广泛分布于人体各大组织器官中,其活性受到抑制后会给造血系统、神经肌肉系统、消化代谢系统带来不同程度的副作用。
1.3 非核苷类逆转录酶抑制剂
NNRTI可与逆转录酶的变构位点结合,通过改变逆转录酶的构象来抑制底物与逆转录酶的结合,属非竞争性抑制。与NRTI相比,NNRTI只针对逆转录酶,而不抑制DNA多聚酶活性,故毒性相对较小;其不需经胞内磷酸化即具活性,故可抑制胞外游离的病毒逆转录酶,进一步降低了病毒感染性[7]。然而,由于NNRTI与逆转录酶的变构位点的结合部位窄小,使得对某一种NNRIT耐药的病毒株极易对多种NNRTI产生耐药性[8-9]。
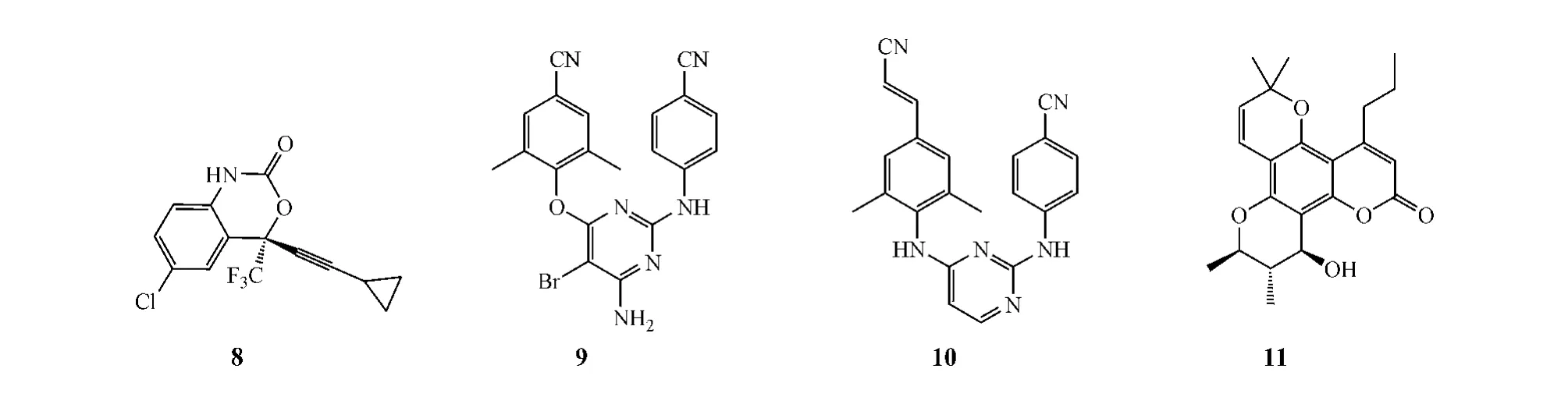
现已上市的NNRTI有奈韦拉平(nevirapine)、地拉韦定 (delavirdine)、依非韦伦(efavirenz,8)、依曲韦林(etravirine,9)和利匹韦林(rilpivirine,10)等,而进入Ⅱ期临床研究阶段的该类药物有胡桐素A (calanolide A,11)等。
依非韦伦可促进病毒多聚蛋白Gag和Gag-Pol (两者为HIV-1结构蛋白和酶形成的前体)过早嵌入蛋白酶中,干扰正常的HIV-1结构及功能蛋白的形成,从而减少病毒粒子的生成;可1日1次给药[10]。
依曲韦林也具有促进病毒多聚蛋白 Gag和Gag-Pol过早嵌入蛋白酶中的功能[9];此外,其柔性结构使得其与逆转录酶变构位点的结合更加紧密,故对耐药患者也有很好的疗效。临床试验显示:依曲韦林+达芦那韦+利托那韦的联用对耐药HIV-1的抑制率达61%,而安慰剂+达芦那韦+利托那韦的联用组仅为40%[11]。
利匹韦林对HIV-1的抑制效果不亚于依非韦伦,且无依非韦伦相关的血脂、神经、精神方面的副作用[12];此外,其纳米级悬浊液非常适合用作长效注射剂,静脉注射时活性可维持1个月,故可1月1次给药[13];且患者对其依从性良好,也适用于艾滋病的预防。
胡桐素A是目前唯一从天然植物中发现的NNRTI,也可人工合成。患者每日口服该药A 600 mg,可使其每毫升血浆病毒载量降低0.8 log10拷贝;此外,其对野生病毒株和具Y181C突变体的病毒株(该病毒株对大多数NNRTI存在耐药性)的抑制活性均较强(IC50=0.1μmol·L-1)[14],且副作用少。
1.4 蛋白酶抑制剂
HIV-1蛋白酶的作用是将翻译好的多聚蛋白Gag和Gag-Pol进行水解,使其成为成熟的HIV-1结构和功能蛋白。PI则可模拟天然HIV-1蛋白底物与蛋白酶结合,干扰蛋白酶活性位点,阻止蛋白前体的水解,从而抑制新病毒的装配,进而达到抑制病毒复制的目的。
目前美国FDA批准的用于抗HIV-1的PI包括:第1代药物沙奎那韦(saquinavir)、利托那韦(ritonavir)、茚地那韦(indinavir)、奈非那韦(nelfinavir)和安普那韦(amprenavir);第2代药物洛匹那韦(lopinavir)、阿扎那韦(atazanavir,12)、替拉那韦(tipranavir,13)、福沙那韦(fosamprenavir,14)和达芦那韦(darunavir,15)。其中,第1代PI易产生耐药性,而第2代PI对耐第1代PI的病毒也有效[15]。
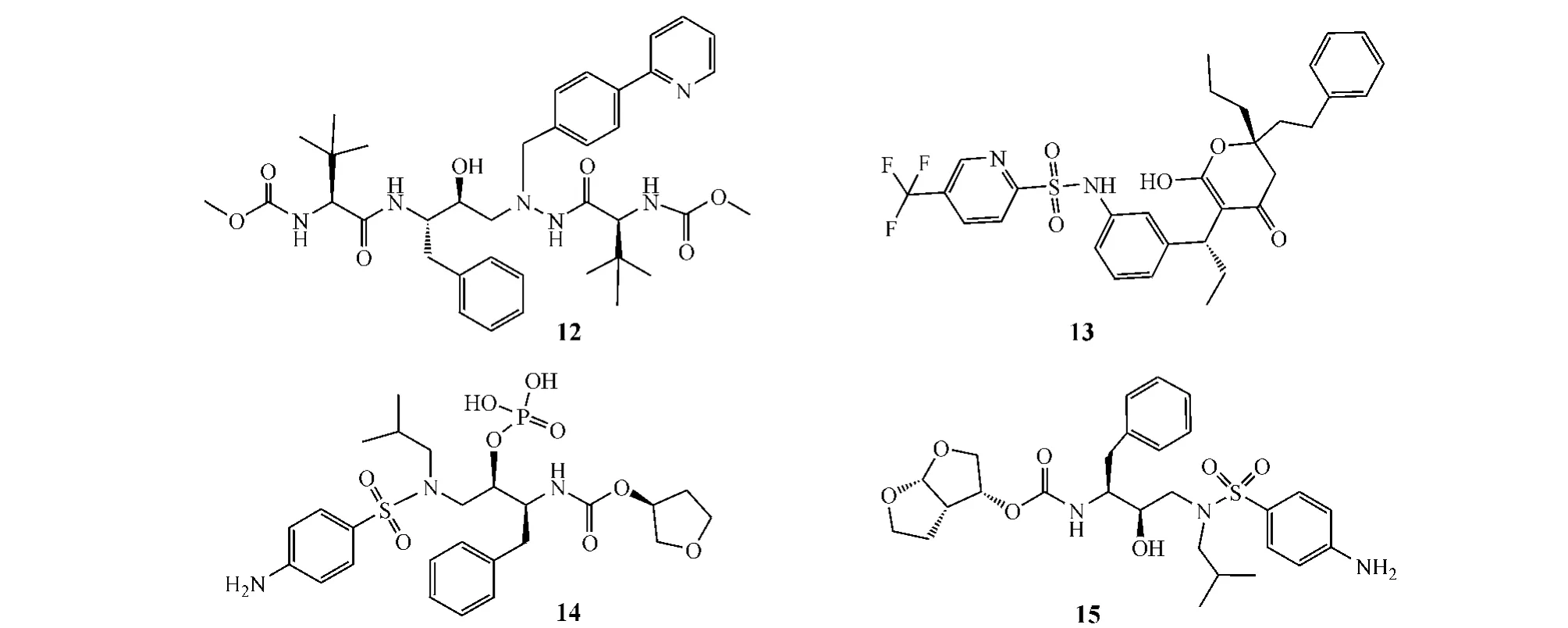
阿扎那韦选择性高,安全性好,不会引起脂肪代谢障碍,为首个1日1次给药的PI[16],已成美国最常用的PI类处方药。替拉那韦用于经其他药物治疗失败的患者时,能降低其HIV RNA携载量,增加CD4细胞的数量[17]。福沙那韦为安普那韦的高水溶性磷酸酯前药,其可在提高生物利用度的同时,保持安普那韦的强抗病毒活性和良好耐受性[18]。
达芦那韦是针对耐药型HIV-1设计的药物,其对HIV-1的绝大部分耐药性突变体有很好的抑制活性,临床试验显示:耐药患者每日口服本品600 mg,其每毫升血浆病毒载量可降低1 log10拷贝以上[19]。此外,达芦那韦可1日1次给药,且与阿扎那韦相似,其也不会引起脂肪代谢障碍这一PI类药物常见的副作用。
另据Degoey等[20]报道,化合物A-790742(16)和A-792611(17)也具有蛋白酶抑制活性,临床前研究结果显示:二者代谢稳定,口服生物利用度高。其中,A-790742对耐洛匹那韦的HIV-1克隆株A17、B26和P25的EC50分别为10、25和45 nmol·L-1,疗效优于A-792611(对上述克隆株的EC50分别为22、140和103 nmol·L-1),具有一定的开发前景。
1.5 整合酶抑制剂
整合酶的作用系将病毒(如HIV-1)DNA插入宿主细胞的染色体内,随后病毒可利用宿主细胞基因的复制功能完成其复制,INI则可通过抑制整合酶活性,阻止该过程的进行。由于整合酶仅存在于病毒中,不存在于哺乳动物体内,故INI具有高效低毒的特点。
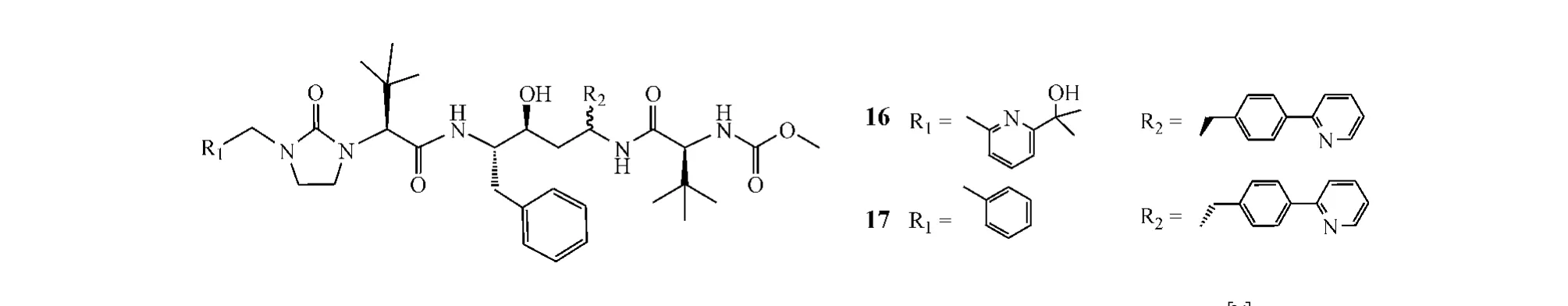
目前唯一获FDA批准的INI为雷特格韦(raltegravir,18),其可在较大程度上提高患者的生活质量,口服本品400 mg(bid)后,患者每毫升血浆病毒载量可降低1.84 log10拷贝[21]。然而,雷特格韦也存在耐药性问题。与雷特格韦相比,处于Ⅲ期临床试验阶段的埃替拉韦(elvitegravir,19)更具优势:每日口服150 mg即可使患者每毫升血浆病毒载量降低1.66 log10拷贝[22]。另一研发中的INI为dolutegravir(20),其对耐雷特格韦和埃替拉韦的HIV-1也具有很强的抑制作用,如经雷特格韦和埃替拉韦治疗无效的35名患者每日口服该药50 mg时,其每毫升血浆病毒载量可降低1.51~2.46 log10拷贝[23]。该药的Ⅱ期临床试验已经完成。
1.6 复合受体抑制剂和融合抑制剂
HIV-1进入靶细胞需经历3个步骤:首先,病毒外表面糖蛋白亚基gp120与宿主细胞表面CD4受体结合,使病毒附着在细胞上;其次,gp120与宿主细胞的复合受体CXCR4或CCR5反应;最后,HIV-1的跨膜亚基Gp41的构象发生改变,激活融合肽,从而使病毒外壳与宿主细胞膜融合,并致病毒RNA进入宿主细胞质中。由此可见,CXCR4、CCR5和Gp41均可作为抗HIV-1的有效靶点。目前,研究人员已开发出靶向作用于CXCR4或CCR5的CRI以及靶向作用于Gp41的FI。
马拉韦罗(maraviroc,21)是目前唯一获FDA批准的CCR5受体抑制剂,临床研究显示:该药(300 mg,bid)对HIV-1的抑制率为安慰剂的2倍以上,且无明显毒副作用[24]。此外,在1次有效给药后,马拉韦罗对HIV-1的抑制作用可保持10 d之久,提示其可按较长时间间隔给药,简化长期用药方案[25]。另一开发中的同类药物vicriviroc(22) (30 mg,qd,po)可使患者每毫升血浆病毒载量降低1.0 log10拷贝[26],且口服生物利用度高达89% ~100%,目前正处于Ⅲ期临床试验阶段。
研究发现,患者若长期服用CCR5受体抑制剂,可能会使病毒由以CCR5为共同受体转变为以CXCR4为共同受体进入细胞,造成治疗失败,因此,将CCR5抑制剂与CXCR4抑制剂联合使用,才可达到完全抑制 HIV-1的目的[27]。普乐沙福(plerixafor,23)为目前已上市的CXCR4受体抑制剂,其可快速提高患者体内CD4+T淋巴细胞的血浆浓度[28];然而,由于其仅能皮下注射给药,故使其长期使用受到限制。
目前上市的FI仅有恩夫韦肽(enfuvirtide),但它的成功却开辟了利用多肽类药物控制HIV-1感染的新领域。该药(90 mg,bid)与达芦那韦(600 mg,bid,po)联用时对HIV-1的抑制率为安慰剂与达芦那韦(600 mg,bid,po)联用时的1.3倍[25]。恩夫韦肽的缺点是易产生耐药性,且必须1日2次静脉注射,多数患者会因此产生注射位点反应,故增加了长期用药的难度。进入Ⅱ期临床研究阶段的西夫韦肽(sifuvirtide)虽只需1日1次静脉注射给药,且其对HIV-1ⅢB在内的多种HIV病毒株的抑制活性强于恩夫韦肽(两者的 EC50分别为1.69~750和22.11~21 910 nmol·L-1),但该药与恩夫韦肽存在交叉耐药性[29]。
2 抗HIV-1的复方制剂
自高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)应用于临床以来,艾滋病的发生率和死亡率均极大地降低。该疗法是指同时使用3~4种针对HIV繁殖周期不同环节的抗艾滋病药物治疗,以达到抑制HIV-1的目的。为了避免患者因服药数量过多导致漏服或误服,提高依从性,通常把多种抗HIV药物设计制成固定剂量复方制剂(fixed-dose combination,以下称复方制剂)。
2.1 基于核苷类逆转录酶抑制剂和核苷酸类逆转录酶抑制剂的复方制剂
抗HIV-1复方制剂最早均由NRTI组成,NRTI联用具有很好的协同作用,并具有毒性低、用量少、耐药性发生缓慢的优点,如拉米夫定与齐多夫定的组合。临床试验证实:齐多夫定单方治疗方案中添加拉米夫定后,能显著控制HIV-1感染和提高患者生存率[30]。目前,已开发出该组合的3个新的抗HIV-1复方制剂,即齐多拉米双夫定片(齐多夫定300 mg/拉米夫定150 mg)、阿巴卡韦双夫定片(齐多夫定300 mg/拉米夫定150 mg/阿巴卡韦300 mg)和Epzicom(拉米夫定300 mg/阿巴卡韦600 mg)。
恩曲他滨为拉米夫定的优化品种,对耐拉米夫定的病毒株有强效抑制活性,只需1日1次服用。恩曲他滨(200 mg)与NtRTI替诺福韦酯(300 mg)的组合具有良好疗效。临床试验证实:恩曲他滨/替诺福韦酯复方制剂对HIV-1的抑制率明显高于齐多拉米双夫定片(80%vs 70%,P=0.02)[31],且安全性更好。最新临床数据显示:恩曲他滨/替诺福韦酯复方制剂可使男同性恋者的HIV-1感染风险降低44%[32],异性恋者的感染风险降低73%[33],对艾滋病预防起重要作用。
然而,NRTI和NtRTI的病毒抑制作用较为短暂,且有剂量依赖性,从而可能导致毒性增加和耐药性产生。
2.2 基于非核苷类逆转录酶抑制剂的复方制剂
基于NNRTI的HAART可用于艾滋病治疗的初始阶段。如复方制剂Atripla(依非韦伦600 mg/恩曲他滨200 mg/替诺福韦酯300 mg),其每日仅需用药1次,较早期抗HIV-1治疗方案明显简化,为FDA推荐的上佳联合治疗方案之一。
新型NNRTI利匹韦林的抗HIV-1活性和安全性均高于依非韦伦,预示着含该药的复方制剂具有良好的应用前景。例如,复方制剂Complera(利匹韦林25 mg/恩曲他滨200 mg/替诺福韦酯300 mg)已于2011年8月上市,非劣效性研究数据显示:HIV-1感染患者对该复方制剂的病毒学应答率与Atripla相当(84%vs82%),且前者的安全性更好,Complera治疗组和Atripla治疗组出现2~4级副作用的患者比例分别为16%和31%(P<0.000 1)[34]。
2.3 基于蛋白酶抑制剂的复方制剂
PI类药物较NNRIT类药物的耐药性发生率低,故临床上通常优先选用PI类药物,而将NNRTI类药物作为PI类药物治疗失败后的辅助用药。
然而,联合应用PI时可能会发生药物相互作用。例如,沙奎那韦、茚地那韦和洛匹那韦均经细胞色素P450酶CYP3A代谢,当这些药物与该酶的强效抑制剂利托那韦联合使用时,可能会导致其血药浓度骤升,造成致命的危险[35]。而Abbott公司将洛匹那韦与利托那韦(质量比为4∶1)制成复方制剂,利用少量利托那韦来增加洛匹那韦的血药浓度,从而达到减少洛匹那韦用量,增加安全性的效果。
2.4 其他复方制剂
目前还有一些复方制剂被证实具有良好疗效。如吉利德科学(Gilead Science)公司研制的由埃替拉韦(150 mg)、恩曲他滨(200 mg)、替诺福韦酯(300 mg)和Cobicistat(150 mg)组成的四联复方制剂Stribild,其中,Cobicistat虽无直接抗病毒活性,但可通过抑制CYP3A和CYP2D6来增加埃替拉韦血药浓度,其效果和安全性与利托那韦相似。临床试验结果显示:同为每日1次给药,与复方制剂Atripla相比,Stribild对 HIV-1的抑制率更高(90% vs 83%),且与药物相关的中枢神经系统副作用的发生率更低(17%vs26%)[36]。该制剂已于2012年8月获FDA批准上市。
此外,由依曲韦林200 mg/雷特格韦400 mg/达芦那韦600 mg/利托那韦100 mg组成的另一四联复方制剂也获得了令人鼓舞的疗效结果。临床试验证实:对多种抗HIV-1药物产生耐药性的患者1日2次服用该制剂后,HIV-1的抑制率高达94%,且患者对该制剂的耐受性良好[37],故可在其他复方制剂治疗失败时使用本品。
恩夫韦肽和西夫韦肽虽同属FI,但由于两者作用靶点不同,故将两者制成复方制剂后,不但可产生很好的协同作用,而且可减少两者的用药量,延长用药周期[38]。
3 结语
自HIV-1被发现以来,抗HIV-1药物的研发成果已超越了任何其他抗病毒药物,该类药物的作用靶点几乎涵盖了HIV生命周期的每个步骤。然而,目前所有的抗HIV-1药物仅可将病毒水平抑制到检测限之下,而尚无法治愈艾滋病,导致患者需终身服药,并不得不忍受药物所带来的副作用以及病毒耐药所导致的治疗失败的折磨,因此,寻找毒性更低、不易产生耐药性的抗 HIV-1药物是人们始终的目标。
抗HIV-1复方制剂可多靶点抑制HIV-1,且用药方便,大大提高了患者的生活质量,具有良好的发展前景。未来,新的一线抗HIV复方药物组合的发展趋势可能会从NRTI类药物转向针对新靶点的药物(如CCR5抑制剂、FI和INI),以在保持抗病毒活性的同时尽可能地减小药物的毒副作用。当然,复方制剂的研发不仅需考虑抗HIV-1药物配伍的临床表现,还要综合考虑其组分的药动学特性是否适合制成复方制剂、是否存在药物相互作用以及是否会引起交叉耐药性等问题。此外,除了化学药物外,天然产物也有望成为抗HIV-1的新生力量,而艾滋病疫苗的研发亦将成为努力的另一目标。
[1] Mehellou Y,De Clercq E.Twenty-six years of anti-HIV drug discovery:where do we stand and where do we go?[J].JMed Chem,2010,53(2):521-538.
[2] Menéndez-Arias L.Mechanisms of resistance to nucleoside analogue inhibitors of HIV-1 reverse transcriptase[J].Virus Res,2008,134(1/2):124-146.
[3] 胡玉钦.恩曲他滨的研究现状与应用前景[J].中外医疗,2008(20):135-136.
[4] Irlbeck D,Rouse E,Castillo S,et al.Treatment-emergent mutations for previously naïve HIV-infected adults failing ZDV+3TC+EFV and ABC+3TC+EFV (CNA30024):11th Conference on Retroviruses and Opportunistic Infections,San Francisco,February 8-11,2004[C].c2004.
[5] Cahn P,Altclas J,Martins M,et al.Antiviral activity of apricitabine in treatment-experienced HIV-1-infected patientswith M184V who are failing combination therapy[J]HIVMed,2011,12(6):334-342.
[6] Celum C,Baeten J M.Tenofovir-based pre-exposure prophylaxis for HIV prevention:evolving evidence[J].Curr Opin Infect Dis,2012,25(1):51-57.
[7] 张兴权.抗艾滋病毒化学治疗药物的最新进展[J].药学学报,2010,45(2):194204.
[8] El Safadi Y,Vivet-Boudou V,Marquet R,et al.HIV-1 reverse transcriptase inhibitors[J].Appl Microbiol Biotechnol,2007,75(4):723-737.
[9] Lu X F,Chen ZW.The development of anti-HIV-1 drugs[J].Acta Pharm Sin,2010,45(2):165-176.
[10]Figueiredo A,Moore K L,Mak J,et al.Potent nonnucleoside reverse transcriptase inhibitors target HIV-1 Gag-Pol[J].PLoSPathog,2006,2(11):1051-1059.
[11]Christinea K,Richardb H,Jacobc L,et al.Efficacy and safety of etravirine in treatment-experienced,HIV-1 patients:pooled 48 week analysis of two randomized,controlled trials[J].AIDS,2009,23(17):2289-2300.
[12]Molina JM,Cahn P,Grinsztejn B,etal.Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatmentnaive adults infected with HIV-1(ECHO):a phase 3 randomised double-blind active-controlled trial[J].The Lancet,2011,378(9787):238-246.
[13]van't Klooster G,Hoeben E,Borghys H,et al.Pharmacokinetics and disposition of rilpivirine(TMC278)nanosuspension as a long-acting injectable antiretroviral formulation[J].Antimicrob Agents Chemother,2010,54 (5):2042-2050.
[14]罗焕亮,郭勇,代建国,等.胡桐植物中抗HIV香豆素化合物研究进展[J].天然产物研究与开发,2004,16 (3):249-253.
[15]郝格非,杨光富.新型非拟肽磺胺类HIV蛋白酶抑制剂Darunavir的研究进展[J].有机化学,2008,28(9): 1545-1552.
[16]牟英迪,林振广,刘宜辉.抗HIV病毒感染新药——硫酸阿扎那韦[J].齐鲁药事,2007,26(4):253
[17]何丽华.抗艾滋病病毒药物现状[J].医学信息,2010,(7):1866-1867.
[18]Palladino C,Briz V,Policarpo SN,et al.Long-term dfficacy and safety of fosamprenavir in human immunodeficiency virus-infected pediatric patients[J].Pediatr Infect Dis J,2010,29(6):563-566.
[19]Molina JM,Cohen C,Katlama C,et al.Safety and efficacy of darunavir(TMC114)with low-dose ritonavir in treatment-experienced patients:24-week results of POWER 3[J].JAcquir Immune Defic Syndr,2007,46(1):24-31.
[20]Degoey D A,Grampovnik D J,Flentge C A,et al.2-Pyridyl P1'-substituted symmetry-based human immunodeficiency virus protease inhibitors(A-792611 and A-790742)with potential for convenient dosing and reduced side effects[J].JMed Chem,2009,52(8):2571-2586.
[21]Grinsztejn B,Nguyen BY,Katlam C,etal.Safety and efficacy of the HIV-1 integrase inhibitor raltegravir(MK-0518)in treatment-experienced patients with multidrugresistant virus:a phase II randomised controlled trial[J].The Lancet,2007,369(9569):1261-1269.
[22]Shimura K,Kodama E N.Elvitegravir:a new HIV integrase inhibitor[J].Antivir Chem Chemother,2009,20 (2):79-85.
[23]Min S,Sloan L,Dejesus E,et al.Antiviral activity,safety,and pharmacokinetics/pharmacodynamics of dolutegravir as 10-day monotherapy in HIV-1-infected adults[J].AIDS,2011,25(14):1737-1745.
[24]Kuritzkes D R.HIV-1 entry inhbitors:An overview[J].Curr Opin HIV AIDS,2009,4(2):82-87.
[25]EstéJA,Telenti A.HIV entry inhibitors[J].The Lancet,2007,370(9581):81-88.
[26]Dirka S,Gerdc F,Jacques R,etal.Antiviral activity,pharmacokinetics and safety of vicriviroc,an oral CCR5 antagonist,during 14-day monotherapy in HIV-infected adults[J].AIDS,2007,21(10):1293-1299.
[27]Gouwy M,Struyf S,Berghmans N,et al.CXCR4 and CCR5 ligands cooperate in monocyte and lymphocyte migration and in inhibition of dual-tropic(R5/X4)HIV-1 infection[J].Eur J Immunol,2011,41(4):963-973.
[28]Dugan M J,Maziarz R T,Bensinger W I,et al.Safety and preliminary efficacy of plerixafor(Mozobil)in combination with chemotherapy and G-CSF:an open-label,multicenter,exploratory trial in patients with multiplemyeloma and non-Hodgkin's lymphoma undergoing stem cellmobilization[J].Bone Marrow Transplant,2010,45(1): 39-47.
[29]Wang R R,Yanga L M,Wang Y H,et al.Sifuvirtide,a potent HIV fusion inhibitor peptide[J].Biochem Biophysic Res Commun,2009,382(3):540-544.
[30]Oversteegen L,Shah M,Rovini H.HIV combination products[J].Nat Rev Drug Discov,2007,6:951-952.
[31]Gallant JE,DeJesus E,Arribas JR,et al.Tenofovir DF,emtricitabine,and efavirenz vs.zidovudine,lamivudine,and efavirenz for HIV[J].N Engl JMed,2006,354(3): 251-260.
[32]Grant R M,Lama J R,AndersonP L,et al.Preexposure chemoprophylaxis for HIV prevention in men who have sex with men[J].N Engl J Med,2010,363(27): 2587-2599.
[33]Baeten J,Celum C.Antiretroviral pre-exposure prophylaxis for HIV-1 prevention among heterosexual African men and women:The Partners PrEPStudy[R].c2011.
[34]Cohen C,Molina JM,Cahn P,et al.Pooled week 48 efficacy and safety results from ECHO and THRIVE,two double-blind randomized,phase III trials comparing TMC278 versus efavirenz in treatment-naïve,HIV-1-infected patients[J].The Lancet,2011,378(9787): 238-246.
[35]Li F,Lu J,Ma X.CPY3A4-mediated lopinavir bioactivation and its inhibition by ritonavir[J].Drug Metab Dispos,2012,40(1):18-24.
[36]Nguyen A,Calmy A,Delhumeau C,et al.A randomized cross-over study to compare raltegravir and efavirenz (SWITCH-ER study)[J].AIDS,2011,25(12): 1481-1487.
[37]Imaz A,del Saz SV,Ribas M A,et al.Raltegravir,etravirine,and ritonavir-boosted darunavir:a safe and successful rescue regimen for multidrug-resistant HIV-1 infection[J].J Acquir Immune Defic Syndr,2009,52(3):382-386.
[38]Pan C,Lu H,Qi Z,et al.Synergistic efficacy of combination of enfuvirtide and sifuvirtide,the first and nextgeneration HIV fusion inhibitors[J].AIDS,2009,23(5): 639-641.

