金黄色葡萄球菌、大肠杆菌O157、普通变形杆菌和副溶血弧菌多重PCR检测体系的构建①
刘金华 王蓓蕾 马路遥 刘 阳 贺 晨 邵丽钧 王浩天④
(吉林出入境检验检疫局,长春130062)
食品安全一直以来都是我国乃至世界食品卫生行业关注的热点,食源性致病菌是威胁食品安全的重要隐患。据WTO统计分析,发达国家每年都有将近一半的人感染食源性疾病[1],我国缺乏系统的统计,实际情况可能比发达国家更严重。大肠杆菌O157(EHEC O157:H7)、普通变形杆菌、副溶血弧菌、金黄色葡萄球菌是典型的食源性致病菌。大肠杆菌O157感染剂量低[2]。在美洲、欧洲和亚洲的日本等地均发生过多起由EHEC O157:H7引起的重大食源性疾病暴发事件。EHECO157:H7的感染已成为全球性的公共卫生问题,在世界各国都受到广泛关注[3]。副溶血弧菌(Vibrio parahaemolyticus,简称VP),通常广泛分布于近海区域、盐湖及鱼、贝类等海产品中,是沿海地区引起食物中毒的重要病原菌,我国沿海地区每年都有因副溶血性弧菌引起食物中毒的报道[4]。此外由病原微生物引起的食源性疾病事件中变形杆菌属约占11.3%,而普通变形杆菌和奇异变形杆菌是引起食物中毒的主要变形杆菌[5]。金黄色葡萄球菌(Staphylococcus aureus)是重要的病原微生物,是最常见的引起院内感染和食物中毒的病原菌,在全球范围内具有很高的发病率和病死率[6]。因此,为有效控制上述4种食源性致病菌发生扩散,实现准确快速的检测手段是预防控制其传播的关键所在。目前这几种菌的检测主要有传统分离培养方法、免疫学方法、分子生物学技术和传感器技术等。
其中传统检测食源性致病菌的方法是分离细菌,再生化鉴定和血清学鉴定分型,周期4~7天,程序复杂[7,8],但该方法是目前各种实验室常用的方法,许多国家标准方法都是基于常规方法建立的。这些常规需要耗费较长时间,或需要特殊的仪器设备。而基于分子生物学技术的PCR方法因其简便、快速的优势,已成为食品安全检测的一种常规技术[9,10]。本实验旨在建立针对上述4种菌的多重PCR初筛体系,并对其进行优化,探讨其特异性和灵敏性,同时应用于模拟样品的快速初筛检测。
1 材料与方法
1.1菌株来源 普通变形杆菌(Proteusbacillus vulgaris,ATCC33420)、蜡样芽孢杆菌(Bacillus cereus,ATCC11778)、副溶血性弧菌(Vibiro parahaemolyticus,ATCC17802)购于北京中原公司。单核细胞增生李斯特菌(Listeria monocytogenes,ATCC19111)、金黄色葡萄球菌(Staphylococcus aureus, JLC3563)、伤寒沙门菌(Salmonella typhi,ATCC13311)、肠炎沙门菌(Salmonella enteritidis,ATCC13076)、志贺氏菌 (ShigellaJLC3215)、空肠弯曲菌(Campylobacter jejuni,ATCC33291)、大肠杆菌 O157(Escherichia coli,O157 JLC1242)来自吉林出入境检验检疫局微生物实验室。
1.2试剂和仪器 DNA提取试剂盒Easy PureTMGenomic DNA Extraction KIT、PCR 试剂:2×Easy Taq PCR SuperMix、TaKaRa TaqTMHot start version、100 bp DNA Ladder Marker购自北京全式金生物技术有限公司;脂培养基(Nutrient agar,NA)、胰酪胨大豆琼脂培养基(Tryptose soya agar,TSA)、血平板、溶菌肉汤(Luria~bertani,LB)、氯化钠蔗糖平板、氯化钠结晶紫增菌液、哥伦比亚琼脂平板、布氏肉汤、革兰氏阴性菌增菌菌液(Gram negative,GN)购自北京陆桥技术有限责任公司。
Binder恒温培养箱(德国宾得公司)、离心机(3K30型,德国SigmaSartorius公司)、ProS梯度PCR仪(德国 Eppendorf公司)、PowerPac Universal 164-5070电泳仪(美国伯乐公司)、Alphalmager EC紫外成像系统(美国Alpha公司)、Milliflex Plus浓缩仪(美国Millipore公司)。
1.3方法
1.3.1菌株培养 志贺菌、大肠杆菌O157、变形杆菌、肠炎沙门菌、伤寒沙门菌、蜡样芽孢杆菌均用NA培养基37℃过夜培养,然后挑取3~4个菌落接种到LB液体培养基,在培养箱经过37℃培养24小时。金黄色葡萄球菌用TSA血平板37℃过夜培养,取3~4个菌落接种到LB液体培养基,37℃培养24小时。单核细胞增生李斯特菌用TSA血平板35℃培养24小时,取3~4个菌落接种到 LB液体培养基,35℃培养24小时。副溶血性弧菌用氯化钠蔗糖平板37℃培养24小时,然后挑取3~4个菌落接种到氯化钠结晶紫增菌液,37℃增菌8~16小时。空肠弯曲菌挑取适量的菌种接种于哥伦比亚琼脂平板,微需氧条件下(O2,5% ,N2,85% ,CO2,10%)42℃培养24~48小时,挑取黑色菌落到布氏肉汤过夜增菌。
1.3.2DNA提取 取1.3.1细菌培养液各4 ml按Easy PureTMGenomic DNA Extraction KIT试剂盒说明书操作提取DNA。用酶标仪测定DNA的浓度,用无菌水将DNA终浓度调整为2 ng/μl,用作后续PCR反应的模板。
1.3.3引物设计与合成 在GenBank中查出4种细菌的特异性序列,然后进行靶序列的筛选,使用Primer5.0软件进行引物的设计,并评价引物之间有无二聚体,得到了针对这4种菌株的4对PCR引物。使用BLAST程序对各引物及扩增产物同源性进行比对。引物由上海生物工程有限公司合成。序列见表1。
1.3.4单重PCR扩增 对4种目标菌的核酸提取物进行单独扩增,反应体系:模板DNA 1 μl(2 ng/μl),上、下游引物各 1 μl(10 μmol/L),2 × Easy Taq PCR SuperMix 12.5 μl,ddH2O 9.5 μl总体积 25 μl。PCR扩增条件:预变性95℃ 3分钟,每个循环条件为 95℃变性 30秒,62℃退火 30秒,72℃延伸30秒,34个循环,产物末端72℃ 延伸10分钟。
“新政”是经济危机的结果,它对国民经济的干预扩大了政府的权力与责任,但覆盖范围仍不够广,它的受益者主要是中产阶级、农民和那些有组织的具有优势的城市工薪阶层中的白人,黑人、印第安人的遭遇仍然很悲惨,他们深受种族歧视、失业、贫困的折磨。
1.3.5多重PCR体系的建立及退火温度优化
1.3.5.1多重PCR体系的建立 通过正交实验的方式,首先确定多重PCR的反应体系为10×buffer:5 μl,Taq 酶0.8 μl、dNTP 10.0 μl、上下游引物均为1.2 μl,模板 DNA(2 ng/μl):各加 3 μl,ddH2O 补足体积为50 μl。多重 PCR扩增条件:预变性 95℃3分钟,每个循环条件为95℃变性30秒,62℃退火30秒,72℃延伸30秒,34循环,72℃延伸10分钟。
1.3.5.2退火温度优化 采用梯度PCR,退火温度依次设置为58℃ ~65℃,根据电泳条带的清晰度及亮度确定出最佳退火温度。
1.3.6特异性和灵敏度检测
1.3.6.1特异性检测 分别取1.3.2提取的10种菌的DNA(2 ng/μl)作模板,按照如下反应体系进行多重 PCR:10 × buffer:5 μl,Taq 酶 0.8 μl、dNTP 10.0 μl、上下游引物均为 1.2 μl,模板 DNA 各加 2 μl,ddH2O补足体积为50 μl。多重 PCR扩增条件:预变性95℃3分钟,每个循环条件为95℃变性30秒,64℃退火30秒,72℃延伸30秒,34循环,72℃延伸10分钟。
1.3.6.2灵敏度检测 4种菌经过LB液体培养基37℃培养24小时后,采用平板计数法测定纯培养的菌液浓度,用生理盐水调整各个菌液浓度为108CFU/ml,然后做10倍梯度稀释。各个浓度的菌液分别取4 ml,按照1.3.2的方法提取DNA,根据优化后的多重PCR体系,取同一浓度梯度的4种菌的核酸提取物各3 μl,混合作为模板,按照1.3.5优化后的条件进行多重PCR。多重PCR反应能够检出的最小DNA量所对应的菌浓度即为该体系的灵敏度。
1.3.7模拟海产品中细菌的检测 购买市售的新鲜牡蛎、鱿鱼、黄花鱼、梭子蟹、海螺、墨鱼。经国标法[11]检测,大肠杆菌 O157、副溶血弧菌、普通变形杆菌、葡萄球菌均为阴性。分别各取25 g与250 ml 3%的NaCl溶液混合,匀浆处理。取1.3.6.2稀释得到的浓度为108CFU/ml的每种菌液2 ml,加入到每种海鲜的4份匀浆液中,混匀作为模拟样本。取模拟样本各4 ml,于LB中37℃过夜培养。取每份增菌液各10 ml,按1.3.2提取核酸,进行多重PCR检测。
2 结果
2.1单重PCR扩增 对所选定的各目标菌株,用编码变形杆菌ureR基因的引物进行PCR,结果扩增出大小约为522 bp的特异性片段,用编码金黄色葡萄球菌的nuc基因的引物进行 PCR,扩增出大小约为283 bp的特异性片段,用编码大肠杆菌O157的hlyA基因的引物进行PCR,扩增出大小约为366 bp的特异性片段,用编码副溶血弧菌的氨基酸脱氢酶(Amino acid dehydrogenase)基因的引物进行 PCR,扩增出大小约为199 bp的特异性片段。
2.2退火温度优化 用梯度PCR仪依次设定退火温度为 58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃,对PCR产物的电泳结果显示64℃对应的条带最亮也最清晰。说明64℃为最佳退火温度。如图1所示。
2.3特异性检测 用其他菌的DNA作为模板,然后加入本次研究的金黄色葡萄球菌、大肠杆菌O157、变形杆菌、副溶血弧菌相应的特异性引物。结果表明,只有该4种菌扩增出特异性条带,其余菌PCR结果均成阴性,如图2所示。
2.4灵敏度检测 对菌液进行10倍梯度稀释,然后进行多重PCR。结果显示,稀释后第6条泳带能够清晰辨别出4条菌的特异性条带,所对应的菌落计数为103CFU/ml,即本研究中的四重PCR反应体系的灵敏度,如图3。
2.5应用多重PCR体系检测人工染菌海产品 对海产品进行人工染菌,然后用此多重PCR体系进行检测。结果表明,该多重PCR体系可以成功扩增出4种菌相应的目的基因片段,从而识别出接种的4种菌。如图4,为牡蛎染菌检测结果。
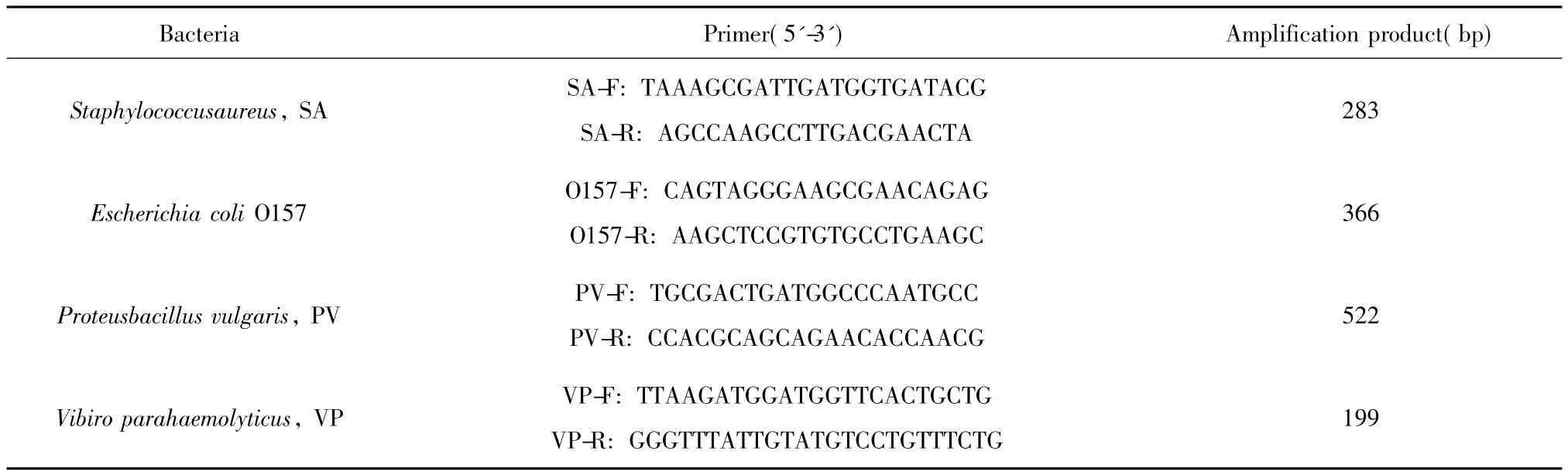
表1 多重PCR引物Tab.1 Primers of multiplex PCR

图1 多重PCR梯度退火温度电泳图Fig.1 The optimization of annealing temperature

图2 多重PCR特异性的检测Fig.2 The result of multiplex PCR specificity
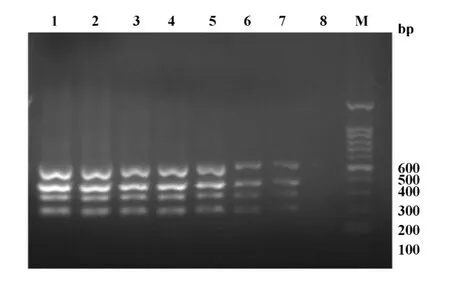
图3 多重PCR灵敏度的检测Fig.3 The result of multiplex PCR sensitivity

图4 多重PCR检测牡蛎中的细菌Fig.4 The detection of bacteria randomly determinated in the oysterNote:M.100 bp DNA ladder marker;1.VP,O157,PV;2.VP,SA,O157;3.PV,SA,O157;4.SA,PV,VP;5.PV,SA,O157,VP.
3 讨论
自1988年报道 Chamberlain等人[11]首次应用多重PCR技术诊断异基因脐带血干细胞移植治疗假肥大型肌营养不良症(DMD)以来,多重PCR作为基因工程的基本技术之一,被广泛应用于各种遗传疾病的诊断、基因的缺失、突变和多态性分析,病原微生物毒力基因的检测,尤其是各种病原微生物的检测和鉴定。
多重PCR是在同一个反应体系中加入多对引物同时扩增多段靶序列。多重PCR由于涉及的因素多,引物之间的结合以及引物和底物之间的竞争,使其反应体系比常规的反应体较常规PCR更为复杂[12,13]。本实验采用正交设计探索实验条件,设计了L9(34)正交实验,快速准确地找到了最佳实验条件。PCR试验的影响因素有退火温度、循环数、反应体积等,但最主要的是退火温度,退火温度决定PCR特异性与产量。温度高,特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低,产量高,但过低可造成引物与模板错配,非特异性产物增加。赵邦荣[14]、刘志杰[15]等人通过温度梯度PCR有效、快速的确定出最佳PCR退火温度。本实验通过温度梯度PCR,确定64℃30秒的最佳退火温度和时间,得到了理想的目标片段。
多重PCR反应产物的特异性除了取决于引物和模板的匹配程度,还要关注一个体系内多对引物之间是否存在序列互补。本实验利用prime5.0软件设计引物,又借助BLAST软件进行序列比对,避免引物之间有同源性,而且每对引物和其他引物的靶序列之间不存在互补序列。在实验设计中,同一多重PCR体系中加入了6种干扰菌,结果只扩增出目的条带,没有非特异性产物。进一步验证了本实验的四对引物具有很强的特异性。
本实验对灵敏度的检测结果和王虎虎等人[16]的多重PCR灵敏度的检测结果相近,高于李盛丰等人[17]的多重PCR灵敏度检测结果。可能是本实验所用的引物扩增效率同上述报道不同,此外使用的试剂扩增效果略有差异导致检测的灵敏性有所不同。除此之外,体系中各组分的比例、反应循环数均对多重PCR的扩增效果有影响。
对比起常规的PCR检测,本研究中一次性加入多种不同菌的引物,一次反应即可扩增出相应菌的基因片段,将这种技术应用于实际致病菌检验中,具有高通量的优点,大大提高了检测效率。
虽然多重PCR有很多优势,但由于它的检测灵敏度高,对食品中一些已经死亡的细菌DNA也能检测出来,导致结果假阳性。本实验采用对食品检测前增菌的方法,用酶标仪监测增菌液的OD值(OD值在0.1~3为对数期),用增菌液来提取DNA。此种方法检测的都是活的致病菌,而且对于一些不容易直接提取DNA的样品,例如食品碎屑等,也可以采用这种前增菌的方法。
总之,多重PCR具有较高的灵敏度和特异性,极大缩短了检测时间,提高了检测效率和通量,为一种理想的食品中致病菌的快速初筛手段,是国标方法的有力补充,为食源性致病菌快速检测探索了新的途径[18]。
1 Hedberg C.Food-related illness and death in the United States[J].Emerge Infect Dis,1999;5(5):840-842.
2 聂青和.感染性腹泻[M].北京:人民卫生出版社,2000:323-339.3 李刚山,王意银,邓 波 et al.大肠埃希菌 O157:H7分离鉴定及毒素基因多重 PCR检测[J].中国热带医学,2011;11(12):1431-1433.
4 刘 阳,孔繁德,徐淑菲et al.副溶血弧菌检测技术的研究进展[J]. 经济动物学报,2012;16(1):49-54.
5 王 鹏,张会彦,马晓燕et al.环介导等温扩增技术快速检测变形杆菌属的研究[J].食品工业,2011;10:106-109.
6 李彦媚,李纯厚,赵喜红et al.金黄色葡萄球菌检测方法的研究进展[J].安徽农业科学,2012;40(16):8927-8931.
7 吴海娟,扈庆华,李庆阁 et al.实时荧光PCR同时检测金黄色葡萄球菌和大肠杆菌 O157:H7[J].中国热带医学,2009;9(5):814-815.
8 曹际娟,徐君怡,孙哲平et al.乳粉中普通变形杆菌和奇异变形杆菌复合 PCR-DHPLC检测技术的建立[J].生物技术通报,2008;S1:420-424.
9 Mukhopadhyay A,Mukhopadhyay U K.Novel multiplex PCR approaches for the simultaneous detection of human pathogens:Escherichia coli O157:H7 and Listeria monocytogenes[J].J Micro Meth,2007;68(1):193-200.
10 Wang R F,Cao W W,Johnson M G.16S rRNA based probes and polymerase chain reaction method to detect Listeria monocytogenes cells added to foods[J].Applied and Environmental Microbiology,1992;58(9):2827-2831.
11 Chamberlain J S,Gibbs R A,Rattier J E et al.Multiplex PC for the diagnosis of Duchenne muscular dystrophy[M].San Diego:Academic Press,1990:272-281.
12 Sudhir T,John L M,Maryanne D.Development of a multiplex polymerase chain reaction assay for detection and differentiation of Staphylococcus aureus in dairy products[J].J Food Prot,2001;64(5):664-668.
13 Sandery M,Stinear T,Kaucner C.Dectection of pathogenic Yersinia enterocolitica in environmental waters by PCR[J].J Appl Bacteriol,1996;80:327-332.
14 赵邦荣,张香改,齐娜娜et al.优化多重PCR扩增效果的实验研究[J].河北医药,2011;33(11):1674-1675.
15 刘志杰,李如举,曾智勇et al.多重PCR反应的影响因素及其优化[J].黑龙江畜牧兽医,2011;7(1):26-28.
16 王虎虎,徐幸莲.冰鲜鸡肉中致病菌三重PCR检测方法的建立[J].中国农业科学,2010;43(17):3608-3615.
17 李盛丰,赵 姣,钟名华et al.单增李斯特菌不同PCR快速检测方法比较[J].中国公共卫生,2008;24(8):1021-1023.
18 杨 军,张 驰,刘新梅et al.多重PCR法对乳制品中3种致病菌的同时快速检测[J].中国乳品工业,2010;38(4):50-53.

