脑内补体系统与阿尔茨海默病①
罗 浩 李闻文 周 军 (中南大学湘雅医学院检验系,长沙410013)
阿尔茨海默病(Alzheimer's Disease,AD)是临床上最为常见的老年痴呆性疾病,临床上表现为隐性起病、不可逆进行性发展的记忆减退,认知、语言功能障碍及人格的改变等,其病理特点为脑内Aβ聚集形成老年斑(Senile plaques,SP),神经元内tau蛋白异常改变形成神经纤维缠结(Neurofibrillary tangles,NFT),脑皮质及海马胆碱能神经元及其突触的大量丢失,皮质动脉出现血管淀粉样变性[1]。目前,关于AD的病因及机制主要以遗传因素、炎症免疫学说、自由基学说为主,但这些学说解释AD的发生发展有待于进一步完善,随着研究的不断深入,补体介导的免疫炎性学说越来越受到人们的重视[2]。
1 脑内补体系统
由于血脑屏障的存在,血细胞以及血浆蛋白等物质难以进入中枢神经系统。虽然血脑屏障并非能绝对阻止大分子物质进入脑内,但大多数补体蛋白不能完全透过血脑屏障,因此认为大脑是免疫豁免器官,其固有免疫反应受到极大限制[3]。近年研究发现,固有免疫的许多因子能在大脑中表达,脑内存在活跃的固有免疫反应,在维持胶质细胞内环境自稳,识别和清除侵袭性微生物、衰老细胞、过量神经递质以及老化糖化蛋白等方面起到重要作用。如大脑受损后,所有补体成分都能在大脑内生成,伴随疾病不同进展过程起着损伤或保护作用[4]。综上所述,大脑细胞产生的补体蛋白可形成脑内局部固有防御体系,这些补体成分在大脑发育过程以及急慢性大脑损伤中均起到极为重要的调控作用。脑内细胞同时表达多种调控蛋白,如C1NH、H因子、备解素、MCP、P因子、DAF及其CD59等,这些蛋白为防止补体过度活化而导致自身组织损伤起到重要调控作用。由此可见,补体对中枢神经系统是防御,还是过度防御导致相关疾病,完全取决于补体蛋白在脑内的表达程度,一旦平衡失调,脑内结构及功能均出现紊乱。
目前认为,脑内补体一般分为三种来源:①胶质细胞见表1:包括星形胶质细胞、小胶质细胞、少突胶质细胞。Lévi-Strauss等[5]曾报道,小鼠星形胶质细胞能够产生补体活化旁路途径中的补体蛋白。近年研究表明,人类星形胶质细胞和小胶质细胞可产生经典途径及其旁路途径中的绝大多数的补体蛋白以及补体调节蛋白[6]。②神经元:脑组织原位杂交方法检测证实 AD 脑组织神经元有 C1q、C2、C3、C4、C5、C6、C7、C8、C9mRNA 的表达[7]。③某些病理情况下[8],血脑屏障被破坏,从外周循环进入脑实质的中性粒细胞等能分泌补体,释放炎症因子,通过进一步的反馈作用促进脑内细胞补体自分泌。以上三条途径均认为是参与脑内免疫炎性反应的结构基础。
2 脑内补体激活途径与调节作用
生理情况下,多数血清补体成分是以酶前体的形式存在。补体激活过程是一系列放大连锁反应,包括三条途径[9]:由抗原抗体复合物结合C1q启动激活的经典途径(Classical pathway,CP);由病原微生物等提供接触表面,而从C3开始激活的旁路途径(Alternative pathway,AP);由甘露聚糖结合凝集素(Mannose-binding lectin,MBL)结合细菌启动的MBL途径(MBL pathway,MBLP);最终通过C3的激活进入共同的终末途径(Terminal pathway,TP)形成MAC[10]。近年有研究者用Aβ1-42处理大鼠海马组织切片,发现C1q及其mRNA表达上调,表明大脑存在以C1q作为起始物的补体CP[11]。Strohmeyer等[12]在AD尸检中发现,在大脑额叶皮质中补体B及激活产物Ba、Bb和FHL-1显著高于对照组,而补体抑制物I因子和H因子与对照无显著意义,证实脑内存在AP[12]。另外有学者认为MBLP也可能参与AD的病理过程。
炎症反应导致大脑结构发生病理改变使其正常功能紊乱,而大脑具有自我调节机制可维持自稳。有研究报道,白细胞介素IL-1β、IL-6、干扰素INF-γ、肿瘤坏死因子TNF-α、H因子、ICAM、血清P蛋白、Aβ等多种细胞因子都可作为补体调节剂,其调节作用与上述因子产生的数量及其病理反应密切相关。C反应蛋白(CRP)是一种急性时相反应蛋白,它可作为一种补体系统激活剂,与相应配基结合,激活C1q从而激活经典的补体激活途径[13]。在老年化相关疾病的研究中发现,AD是由于不断积累的Aβ诱发补体成分活化,使胶质细胞上调,产生促炎症因子、氧自由基等细胞毒性物质,最终大脑局部产生慢性炎症反应。由于补体激活产物和补体调节蛋白失衡,如C1抑制物C1INH,C3转化酶抑制物I因子、MCP、DAF等,该慢性炎症反应将相应加重。活化的补体成分也能通过激活静止的血管内皮细胞呈现多种生物学效应。
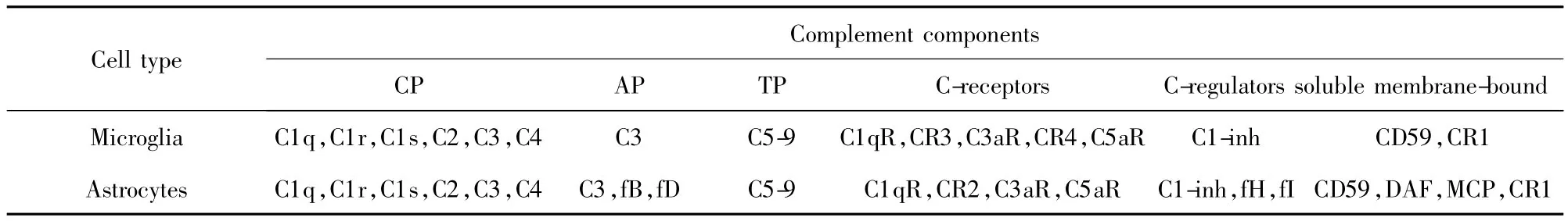
表1 人类小胶质细胞和星形胶质细胞所表达的补体蛋白及调节蛋白[8]Tab.1 Expression of C proteins and C-regulators by human astrocytes and microglia[8]
3 Aβ与补体在AD中的生物效应
使得AD致病的Aβ多为含有39~43个氨基酸残基的多肽,分子量为4 kD。多肽构成β-片层结构,来源于淀粉样前体蛋白(Amyloid precursor protein,APP)。APP基因在转录后由于不同的剪接产生10余种不同的mRNA和365~770个氨基酸残基的蛋白质异构体,其中APP695、APP770是人脑内主要存在形式。Aβ是各种细胞APP正常代谢产物,中枢神经系统中神经元、星形胶质细胞、小胶质细胞、少突胶质细胞和内皮细胞均表达APP,APP在α-分泌酶、β-分泌酶和 γ-分泌酶的作用下裂解产生Aβ[14]。由于三种酶对Aβ的作用位点不一致,产生的Aβ对人体的生物学效应也不一致。研究证实,α-分泌酶裂解APP产生分泌性APP(APPsa),其可促进神经存活、抗神经兴奋性氨基酸的毒副作用,在减少AD及神经退行性疾病中具有一定生理作用,即正常人大脑中存在Aβ,其可分泌至细胞外,具有可溶性,无积聚性及毒性作用。β-分泌酶主要裂解APP695中Met-595与 ASP-597之间膜外氨基端肽键,γ-分泌酶主要裂解Aβ39-43位跨膜羧基端任意肽键而产生分子大小不一的完整Aβ分子,其产生的Aβ具有很强的疏水性,因此认为β-分泌酶和γ-分泌酶的作用决定了Aβ的毒性作用[15]。综上所述,正常情况下主要表现为α-分泌酶活性,而当大脑存在病理改变时β-分泌酶和γ-分泌酶含量将会升高或活性增强。研究表明,Aβ可引起胆碱能神经元损伤、神经细胞凋亡、氧应激和免疫炎症反应,从而损伤神经细胞。但是可溶性的Aβ本身并无神经毒性,只有当β-折叠形成丝状纤维聚集物变为不可溶性沉积物后则具有神经细胞毒性作用,研究发现,Aβ42、Aβ43毒性最强。亦有研究报道,可溶性、呈寡居状态的Aβ寡聚体(Amyloid-beta oligomers,AβOs)也可能引起AD神经元功能失调,并可升高TNF-α、MCP-1、MIP-1α,促进 Aβ沉积,形成恶性循环的慢性免疫过程[16]。
研究表明,MAC有很明显的神经毒性,其作用可溶解神经元[17]。凋亡的神经元周围存在C1q和C5b-9等补体蛋白成分,提示AD患者神经元的凋亡很可能与经典补体途径相关。据报道,C1q作为补体经典途径活化的起始物,通过与Aβ结合,参与形成老年斑[18]。补体裂解产物 C3a、C4a、C5a 及其MAC具有过敏毒素作用,其中以C5a作用最强。AD在其不同的进展期,表现出不同的补体表达成分。在AD的早期,C1q、C4d和C3d的表达上调,而终末阶段的C5b-9则缺失或不占主导作用;在疾病的发生发展过程中,NP及NFT周围可观察到较强的C1q、C4d、C3d以及部分C5b-9,提示补体经典途径和C3在AD的主导作用[19]。对患有AD不同年龄段的尸检研究也证实了这一主导作用。补体因子H近来倍受关注,其作为负性免疫炎性反应的调节因子,可通过抑制AP进而起到保护作用。有学者指出,联合AD患者脑脊液中补体因子H和C3的检测,可以作为评价 AD病理进程的指标[20]。Lukiw 等[21]研究发现,在 AD 中,miRNA-9、miRNA-125b、miRNA-146a和miRNA-155作为上调表达NF-κB的因素,可下调补体因子H的表达,即在AD进展中,补体因子H的表达受到抑制,从而加速了由AP引起的病理损害。
动物实验发现,补体激活产物存在于大脑发育以及神经元形成过程中[22]。这些发现不但有助于了解大脑发育和神经元网络形成的机理,同时也为补体系统在与CNS相关疾病中的神经退行性和神经保护性作用提供理论支撑。Webster等[23]通过离体实验证实,C1q可增强小胶质细胞吞噬Aβ的作用,进而保护神经元免受损伤。也有研究表明,C1q能抑制Aβ和血清P蛋白所致的神经毒性。此外,C3也具有神经保护作用。Rogers等[24]发现C3b有助于C1R与Aβ结合,促进Aβ的清除,而另一补体激活物C3a可以诱导神经营养因子生成,防止门冬氨酸介导的神经毒性。进一步研究发现,C3a还具有抗炎作用。C5a作为过敏毒素最强的因子,仍有可能具有神经保护作用。体外诱导实验发现,C5a能够减少多种神经元的凋亡以及谷氨酸所诱发的神经毒性作用。C5a能够促使小胶质细胞表达谷氨酸受体(GLT-1),进而促进了谷氨酸的吸收,通过阻断谷氨酸的毒素作用保护神经系统[24]。Fonseca等[25]研究证实,C5a受体拮抗剂可抑制AP的激活,进而起到保护小鼠作用,同时也指出抑制补体活化能够延缓AD小鼠病理进程。以上研究结果充分说明补体系统在脑内的复杂作用机制。
4 AD的免疫靶向治疗和展望
补体受体拮抗剂和补体调节剂的使用,对于慢性神经退行性疾病以及急性神经系统疾病的治疗具有不可低估的前景。研究显示,AD的发病过程中,补体系统存在过度的活化。目前认为调节补体是最有希望干预AD发生发展的治疗方法。药物研究发现,痘病毒相关调节蛋白(VCP)、C5a受体拮抗剂PMX205、半枝莲提取物B3-ps1等对AD有较好疗效。VCP作为一种温和的补体调节剂,可抑制补体系统的激活,减少Aβ的沉积改善大鼠的学习记忆能力。但目前为止,补体调节剂尚处于AD的动物研究阶段[26]。此外,有研究报道,通过免疫方式减少脑内Aβ和过度磷酸化的Tau蛋白沉积,就能阻碍AD的发展[27,28]。目前进入临床实验的疫苗主要分为两类:一类为通过主动免疫作用的疫苗,如CAD-106、ACC-001、ACI-24、UB-311、V-950 等;另一类为通过被动免疫作用的疫苗,如 Solanezumab(LY2062430)、Ponezumab(PF-04360365)等。
预计到2050年,全球将有1.06亿AD患者,AD将成为全球致死性的神经退行性疾病。随着人口老龄化日趋明显,AD必将成为一个严重的社会问题。AD为一种不可逆进行性发展的脑损伤,除导致患者自身痛苦,也关系着家庭乃至整个社会的和谐,因此加大对AD的研究力度十分有必要。鉴于AD的药物治疗存在各种缺陷,就目前补体介导的炎性免疫反应机制提示,研制相应的补体激活剂、抑制剂,及其相关疫苗,在免疫炎性及补体效应的损伤阶段进行干预,将有望能改善或治愈AD。
1 Querfurth H W,LaFerla F M.Alzheimer's disease[J].N Engl J Med,2010;362(4):329-344.
2 Broussard G J,Mytar J,Li R C et al.The role of inflammatory processes in Alzheimer's disease[J].Inflammopharmacology,2012;20(3):109-126.
3 Abbott N J,patabendige A A ,dolman D E et al.Structure and function of the blood-brain barrier[J].Neurobiol Dis,2010;37(1):13-25.
4 Veerhuis R,Nielsen H M,Tenner A J.Complement in the brain[J].Mol Immunol,2011;48(14):1592-1603.
5 Lévi-strauss M,Mallat M.Primary cultures of murine astrocytes produce C3 and factor B,two components of the alternative pathway of complement activation[J].J Immunol,1987;139(7):2361-2366.
6 Verkhratsky A,Parpura V.Recent advances in(patho)physiology of astroglia[J].Acta Pharmacol Sin,2010;31(9):1044-1054.
7 Shen Y,Li R ,McGeer E G et al.Neuronal expression of mRNAs for complement proteins of the classical pathway in Alzheimer brain[J].Brain Res,1997;769(2):391-395.
8 Gosselet F,Candela P,Cecchelli R et al.Role of the blood-brain barrier in Alzheimer's disease[J].Med Sci(Paris),2011;27(11):987-992.
9 Woodruff T M,Ager R R,Tenner A J et al.The role of the complement system and the activation fragment C5a in the central nervous system[J].Neuromolecular Med,2010;12(2):179-192.
10 Ricklin D ,Hajishengallis G,Yang K et al.Complement:a key system for immune surveillance and homeostasis[J].Nat Immunol,2010;11(9):785-797.
11 Fan R and Tenner A J.Complement C1q expression induced by Abeta in rat hippocampal organotypic slice cultures[J].Exp Neurol,2004;185(2):241-253.
12 Strohmeyer R,Shen Y and Rogers J.Detection of complement alternative pathway mRNA and proteins in the Alzheimer's disease brain[J].Brain Res Mol Brain Res,2000;81(1-2):7-18.
13 Bi B T,Lin H B,Cheng Y F et al.Promotion of β-amyloid production by C-reactive protein and its implications in the early pathogenesis of Alzheimer's disease[J].Neurochem Int,2011;60(3):257-266.
14 Haass C,Kaether C,Thinakaran G et al.Trafficking and proteolytic processing of APP[J].Cold Spring Harb Perspect Med,2012;2(5):a006270.
15 Petrlova J,Kálai T,Maezawa I et al.The influence of spin-labeled fluorene compounds on the assembly and toxicity of the aβ Peptide[J].PLoS One,2012;7(4):e35443.
16 Choi J G,Moon M,Kim H G.Gami-Chunghyuldan ameliorates memory impairment and neurodegeneration induced by intrahipp-ocampal Aβ 1-42 oligomer injection[J].Neurobiol Learn Mem,2011;96(2):306-314.
17 D'Andrea M R.Evidence that immunoglobulin-positive neurons in Alzheimer's disease are dying via the classical antibody-dependent complement pathway[J].Am J Alzheimer's Dis Other Demen,2005;20(3):144-150.
18 Benoit M E,Tenner A J.Complement protein C1q-mediated neuroprotection is correlated with regulation of neuronal gene and microRNA expression[J].J Neurosci,20112;31(9):3459-3469.
19 Zhou J,Fonseca M I,Pisalyaput K et al.Complement C3 and C4 expression in C1q sufficientand deficientmouse modelsof Alzheimer's disease[J].J Neurochem,2008;106(5):2080-2092.20 Wang Y,Hancock A M,Bradner J et al.Complement 3 and factor h in human cerebrospinal fluid in Parkinson's disease,Alzheimer's disease,and multiple-system atrophy[J].Am J Pathol,2011;178(4):1509-1516.
21 Lukiw W J,Surjyadipta B,Dua P et al.Common micro RNAs(miRNAs) target complement factor H(CFH) regulation in Alzheimer's disease(AD)and in age-related macular degeneration(AMD)[J].Int J Biochem Mol Biol,2012;3(1):105-116.
22 Fraser D A,Pisalyaput K and Tenner A J.C1q enhances microglial clearance of apoptotic neurons and neuronal blebs,and modulates subsequent inflammatory cytokine production[J].J Neurochem,2010;112(3):733-743.
23 Webster S D,Yang A J ,Margol L et al.Complement component C1q modulates the phagocytosis of Abeta by microglia[J].Exp Neurol,2000;161(1):127-138.
24 Rogers J,Li R,Mastroeni D et al.Peripheral clearance of amyloid beta peptide by complement C3-dependent adherence to erythrocytes[J].Neurobiol Aging,2006;27(12):1733-1739.
25 Fonseca M I,Chu S H,Berci A M et al.Contribution of complement activation pathways to neuropathology differs among mouse models of Alzheimer's disease[J].J Neuroinflammation,2011;8(1):4-4.
26 Wu Y,Chen D F.Anti-complementary effect of polysaccharide B3-PS1 in Herba Scutellariae Barbatae(Scutellaria barbata) [J].Immunopharmacol Immunotoxicol,2009;31(4):696-701.
27 Wiessner C,Wiederhold K H,Tissot A C et al.The second-generation active Aβ immunotherapy CAD106 reduces amyloid accumulation in APP transgenic mice while minimizing potential side effects[J].J Neurosci,2011;31(25):9323-9331.
28 Siemers E R,Friedrich S,Dean R A et al.Safety and changes in plasma and cerebrospinal fluid amyloid beta after a single administration of an amyloid beta monoclonal antibody in subjects with Alzheimer disease[J].Clin Neuropharmacol,2010;33(2):67-73.

