炭气凝胶纳米颗粒固定葡萄糖氧化酶的直接电化学
于志辉 宿婷婷 任翠华 李 钒 夏定国程水源
(1北京工业大学环境与能源工程学院,北京100124;2北京大学工学院,北京100871)
1 引言
酶是一种具有生物活性的蛋白质,酶的氧化还原活性中心与载体之间的直接电化学研究已成为生物电化学研究最重要的发展方向之一,1-5葡萄糖氧化酶(GOD)是一个具有刚性结构的氧化还原酶,由两条相同的多肽链组成的二聚体分子构成,每条肽链中包含一个氧化还原中心——黄素腺嘌呤二核苷酸(FADH2),6具有较高的催化活性和高度的稳定性,成为生物电化学研究领域中的一种理想的酶;所以将GOD用合适的方法固定在电极表面作为催化剂己得到广泛关注.7-11而具有良好的导电性能和生物性能的酶载体研究,是酶的直接电化学的研究重点.12-18影响酶在电极上的直接电化学性能行为因素主要有两方面:一是电极上载体的空间结构,大小匹配的空间结构可以使蛋白质进入到相应的位置中,保持合适的二级结构,从而完成电子的直接转移;二是载体的导电率,具有良好电子导电的载体能够在蛋白质和电极之间提供良好的电子通道,研究发现如果直接将酶吸附在平面型载体上,其电化学性能不好,但是如果是粗糙表面,其电化学性能则发生明显改善.
炭气凝胶是一种新型轻质纳米多孔无定形炭素材料,具有导电性好、多孔结构等性能,被广泛应用于催化剂载体研究,19,20将炭气凝胶应用于葡萄糖生物传感器中,可表现出较高的灵敏性、抗干扰性和较好的稳定性,目前纳米介孔炭气凝胶固定葡萄糖氧化酶的直接电化学研究尚未见报道.以介孔炭气凝胶为电极催化剂载体材料固定葡萄糖氧化酶,一方面利用纳米介孔材料实现酶催化剂的高表面原子分布进而提高传统催化剂的活性,另一方面酶与电极之间直接电子传递过程更接近生物氧化还原的原始模型,用电极充当电子的给予体或接受体,可以模拟生物体系电子传递机理,对了解生物分子的结构和各种物理化学性质具有重要的意义.本研究利用间苯二酚和甲醛在碱性环境下制备炭气凝胶,用其固定葡萄糖氧化酶修饰玻碳电极,在无电子媒介体的情况下,研究其直接电化学性能以及对葡萄糖的催化性能.
2 实验部分
2.1 试剂与仪器
葡萄糖氧化酶(EC 1.1.3.4,from Asperillus niger,147 units·mg-1,glucose oxidase,GOD)(Sigma公司);2%(质量分数,下同)Nafion溶液(美国Aldrich化学公司);缓冲溶液为0.1 mol·L-1的磷酸盐缓冲溶液(PBS).其余试剂均为分析纯试剂.实验用水为二次蒸馏水.葡萄糖储备溶液在使用前24 h配制,以完成其构型的转换.
PB-10酸度计(德国赛多利斯公司);PARSTAT2273电化学分析工作站(美国PAR公司);HITACHI S-4300扫描电子显微镜(日本日立公司); BET(ASAP 2010型美国亚特兰大Micromeritics Instrument Corporation);METTLER TOLEDO AL104-1C分析天平(梅特勒-托利多仪器上海有限公司); KQ-2200B超声波清洗器(中国昆山市超声仪器有限公司).
2.2 炭气凝胶固定葡萄糖氧化酶修饰玻碳(GOD/CA/GC)电极的制备
利用间苯二酚和甲醛在碱性环境下制备炭气凝胶(CA).21称取CA样品10 mg,加入1 mL 95%(w)的乙醇中,超声30 min后,再加入20 mg的GOD,机械摇匀,在4°C条件下放置24 h获得GOD/CA悬浊液.称取CA样品,用上述方法配置CA悬浊液.
将玻碳(GC)电极分别用粒径为0.3和0.05 μm的氧化铝浆打磨至光亮,在超声状态下依次用二次蒸馏水、无水乙醇和二次蒸馏水清洗GC电极.干燥后用微量进样器分别取8 μL GOD/CA、CA悬浊液滴到不同的GC电极表面.半干后,再滴加2 μL 0.1%Nafion溶液,室温下自然干燥,得到待测GOD/ CA/GC电极和CA/GC电极.
2.3 CA的结构表征及GOD/CA/GC的电化学性能测试
采用HITACHI S-4300扫描电子显微镜观察载体CA材料的表面形貌;BET测试在Micromeritics ASAP 2010(美国麦克仪器公司)上进行;傅里叶红外(FTIR)光谱测量在Nicolet 360 FTIR红外光谱仪上进行.电化学测试在室温下进行,采用三电极系统:铂电极作为对电极,饱和甘汞电极(SCE)作为参比电极,分别以CA/GC、GOD/CA/GC电极(直径4 mm)为工作电极.在pH值分别为6.0、6.5、7.0、7.5和8.0的PBS中测定GOD/CA/GC的循环伏安曲线.循环伏安扫描的电压范围为-0.68 V至-0.28 V(vs SCE).利用循环伏安法在pH=7.0的缓冲体系中测定不同葡萄糖浓度中GOD/CA/GC电极对葡萄糖的催化性能.
3 结果与讨论
3.1 CA表面结构分析

图1 载体材料CA的SEM图Fig.1 SEM image of carrier material CA

图2 载体材料CA的TEM图Fig.2 TEM image of carrier material CA
图1给出了利用间苯二酚和甲醛在碱性环境下制备的炭气凝胶(CA)载体材料的SEM图,放大倍数为50000倍,从中可以看到炭气凝胶载体表面为颗粒堆积形貌,颗粒大小约为200 nm,该表面可形成较大的比表面积从而有利于酶的附着.图2为CA载体材料的TEM图,从图中可以看出样品具有高度有序的微孔道结构,它们是由许多球状的介孔笼通过窗口相互连接排列而成.
图3为CA载体材料的N2吸脱附等温线和孔径分布图,可以看出CA载体材料的N2吸脱附等温线中有典型的IV型等温线并伴随有一个较明显的滞后环,表明CA载体材料有介孔结构存在.孔径分布图表明孔径分布范围主要集中在10 nm左右,与GOD的尺寸(7-8 nm)相接近,BET的测试结果表明CA载体材料比表面积为586 m2·g-1,大小匹配的介孔结构和较大的比表面积均有利于吸附固定GOD.图4为CA载酶前后的氮吸脱附等温曲线的对比图,可以看出CA在固定葡萄糖氧化酶后与固定前的N2吸脱附曲线相比有明显改变,载酶后N2的吸附量明显降低,比表面积的测试结果为80 m2·g-1,表明GOD已固定到载体CA上.22
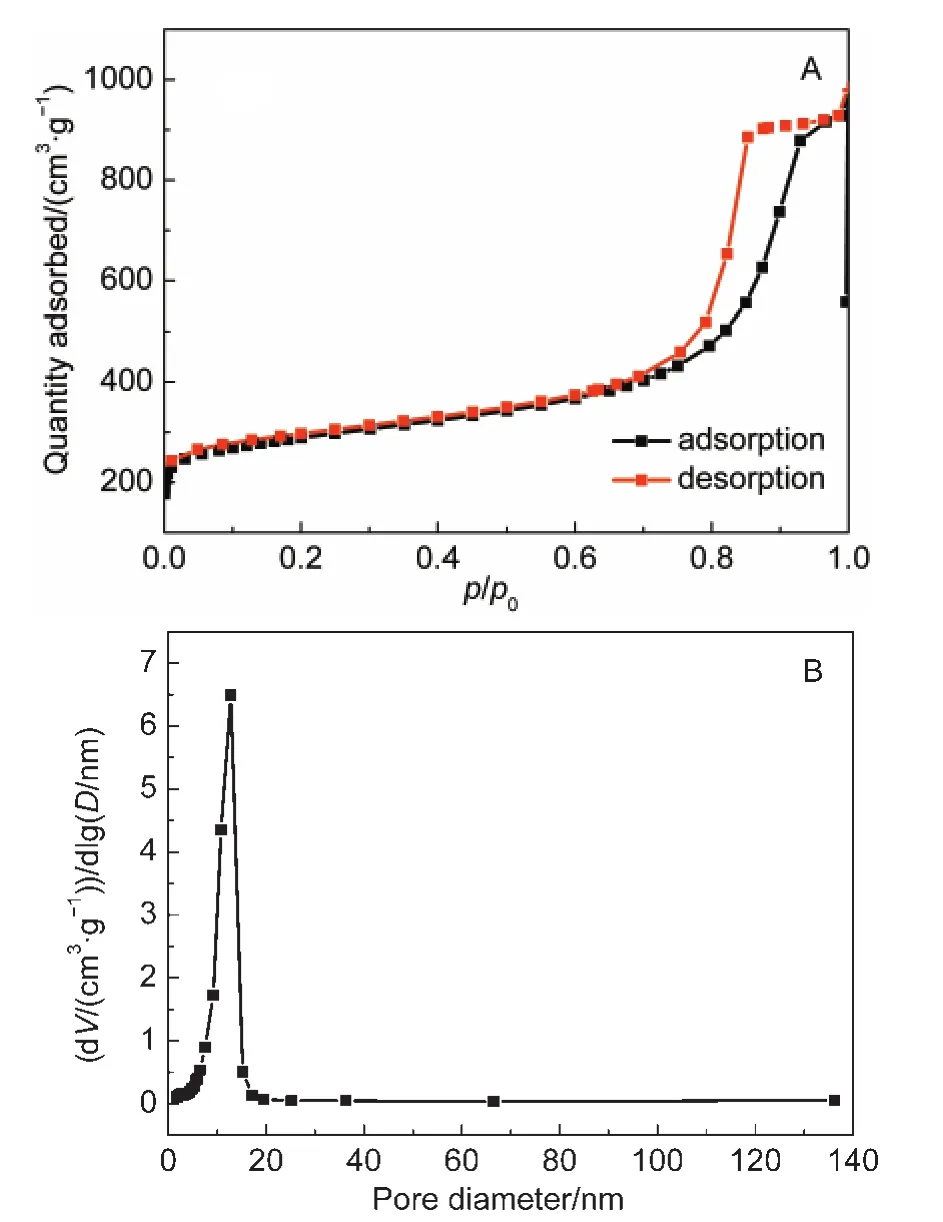
图3 CA的氮吸脱附等温曲线(A)和孔径分布图(B)Fig.3 N2adsorption-desorption isotherm(A)and pore size distribution curve(B)of CA
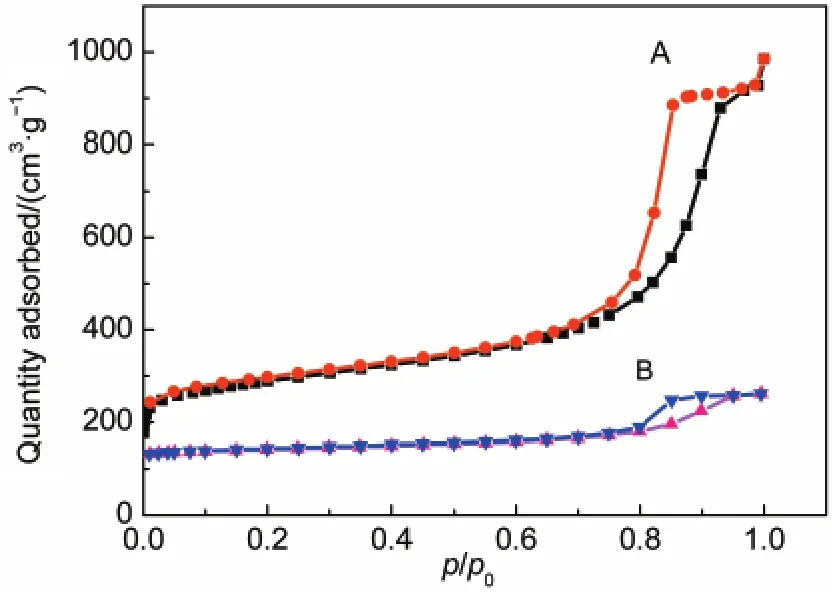
图4 CA载酶前(A)和载酶后(B)氮吸脱附等温曲线Fig.4 N2adsorption-desorption isotherms of CAbefore (A)and after(B)impregnation with GOD
图5为CA、GOD、GOD/CA的红外吸收光谱图.在蛋白质的红外光谱中,酰胺I和酰胺II是蛋白质肽链二级结构的特征吸收,酰胺I是蛋白质肽链骨架上C―O伸缩振动引起的,酰胺II则是N―H面内弯曲和C―N伸缩振动共同引起的,根据酰胺I和酰胺II的峰位置的变化可以判断蛋白质是否变性.22其中GOD的红外吸收光谱在1649和1538 cm-1处的吸收峰分别对应的是GOD的酰胺I和酰胺II,在1105 cm-1处对应的是GOD上C―O键的伸缩振动;GOD/ CA的红外吸收光谱在1635和1540 cm-1处仍有较强的吸收峰对应GOD的酰胺I和酰胺II,在1119 cm-1处吸收峰对应GOD上C―O键的伸缩振动,可以看出,用该种方法固定GOD保持了其天然构象.
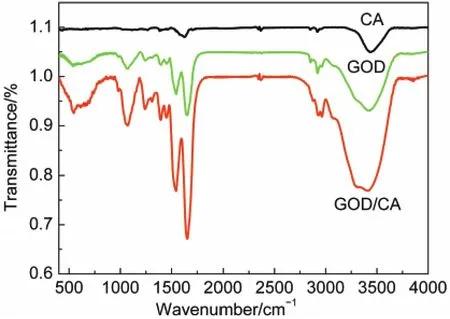
图5 CA、GOD和GOD/CA的红外吸收光谱图Fig.5 IR spectra of the samples CA,GOD,and GOD/CA
3.2 GOD/CA/GC电极的直接电化学研究
图6为CA/GC和GOD/CA/GC电极在pH=7.0的磷酸盐缓冲溶液中的循环伏安曲线(CV),从图中可以看出CA/GC电极在扫描电位范围内没有任何可观察到的电化学反应发生,而GOD/CA/GC电极在-471和-512 mV(vs SCE)出现了一对明显的氧化还原峰,其式量电位E0ʹ为-491.5 mV,峰电位差ΔEp为41 mV,显示了GOD在电极表面快的电子传递和良好的可逆性,表明GOD很好地固定在电极上,保持了很好的电化学活性.
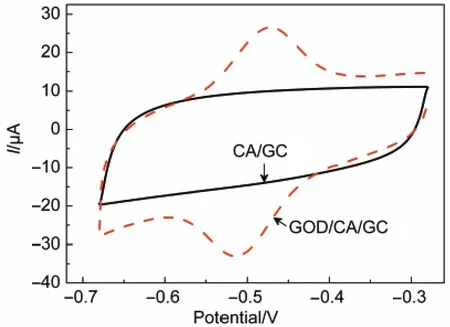
图6 CA/GC和GOD/CA/GC电极在0.1 mol·L-1 PBS(pH=7.0)中的循环伏安曲线Fig.6 Cyclic voltammograms of CA/GC and GOD/CA/ GC electrodes at a solution of 0.1 mol·L-1PBS(pH=7.0) PBS:phosphate buffered solution
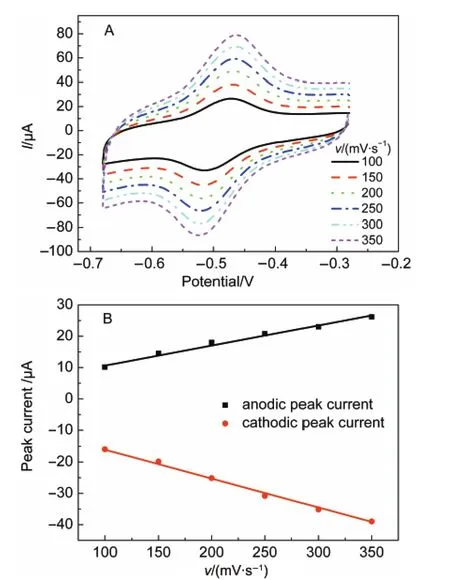
图7 (A)GOD/CA/GC电极在不同扫描速率(v)下的循环伏安曲线和(B)GOD/CA/GC电极阴极、阳极峰电流与扫描速率的线性关系Fig.7 (A)Cyclic voltammograms of the GOD/CA/GC electrode at different scan rates(v);(B)plots of the redox peak currents vs scan rate
图7A为GOD/CA/GC电极在不同扫描速率下得到的CV,可以看出峰电流随扫描速率的增大而增大,电极电流与扫描速率呈线性关系(见图7B),说明GOD的电化学反应受表面控制,23表明GOD很好地固定在CA/GC电极表面.随着扫描速率的增加,阳极、阴极峰电位分别向正、负方向产生较小的偏移,ΔEp增加,但E0ʹ几乎不变.由Laviron公式:24Ks= mnFv/RT(Ks:电子转移速率,s-1;m:与峰电位差相关的参数;n:电子转移数;F:法拉第常数,96485 C· mol-1;v:扫描速率,mV·s-1;R:气体常数,J·mol-1· K-1;T:热力学温度,K)可计算出GOD/CA/GC电极的Ks约为5.72 s-1,与已报道文献数据22,25,26相比该实验结果表明GOD/CA/GC电极具有较高的电子转移速率,说明GOD/CA/GC电极上固定的GOD具有较快的电子传递过程,CA/GC电极表面的微环境更有利于GOD的直接电子转移.
图8A为GOD/CA/GC电极在不同pH值下的循环伏安曲线.GOD/CA/GC电极的CV行为在很大程度上受溶液pH值的影响.溶液pH值的增加通常会导致其CV还原氧化峰电位的负移,从图8B式量电位与pH值的关系中可以看出,在pH=6.0-8.0范围内,电位(单位为V)随着pH值的变化而线性变化,且线性相关系数R=0.99453,求得其斜率为66.68,与公式E0ʹ=constant+0.059pH中的理论值(59)24非常接近.表明该GOD/CA/GC电极上发生了直接电化学反应:GOD-FAD+2e-+2H+=GOD-FADH2,FAD为黄素腺嘌呤二核苷酸,该反应伴随有两电子两质子的转移,且GOD在电极表面的直接电子转移反应具有较好的可逆性.
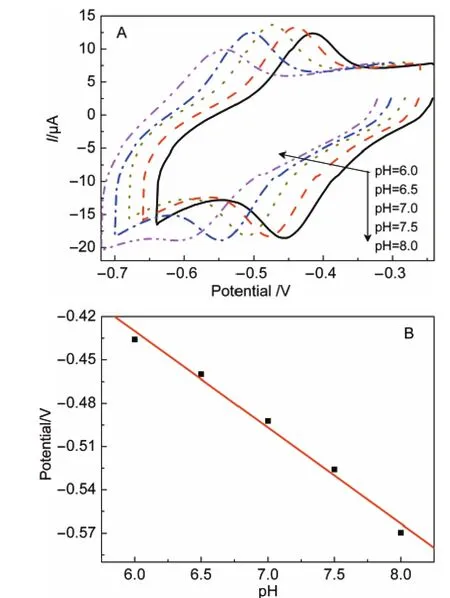
图8 (A)GOD/CA/GC电极在不同pH值下循环伏安曲线和(B)式量电位与pH值的关系图Fig.8 (A)Cyclic voltammograms of GOD/CA/GC electrode at various pH values;(B)plot of E0ʹof GOD/CA/GC vs pH value of the solution
Nafion是一种很好的固定膜,但对于电子的传递有一定的阻碍作用,对于GOD/CA/GC电极,在Nafion质量分数分别为1.0%、0.2%、0.1%,PBS浓度为0.1 mol·L-1、扫描速率为100 mV·s-1的条件下进行循环伏安测试,结果见图9.从图中可以看出随Nafion浓度的减小,ΔEp值减小;通过计算得到三种Nafion质量分数下Ks依次为1.52,2.96,3.02 s-1,结果表明选择低浓度的Nafion有利于电子的传递.但浓度进一步的降低造成测试过程中活性物质脱落.
3.3 GOD/CA/GC电极对葡萄糖的催化性能研究
图10为GOD/CA/GC电极在不含葡萄糖溶液和含有5 mmol·L-1葡萄糖溶液pH为7的0.1 mol· L-1PBS溶液中100 mV·s-1下的循环伏安曲线图.由图可见,向PBS中加入葡萄糖溶液后还原峰电流的绝对值明显减小,而氧化峰电流明显增加,这表明电极上的葡萄糖氧化酶与葡萄糖之间发生了酶催化反应,其反应表达式为:
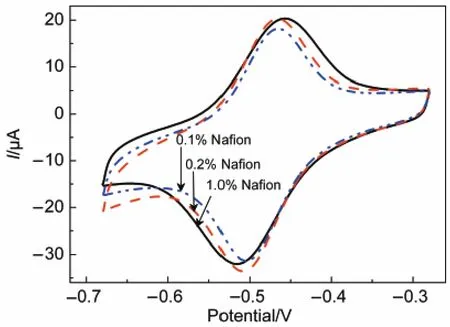
图9 GOD/CA/GC电极使用不同浓度Nafion(w)的循环伏安图Fig.9 Cyclic voltammograms of GOD/CA/GC electrode with different concentrations(w)of Nafion v=100 mV·s-1
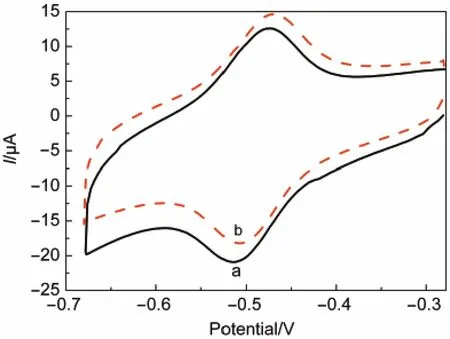
图10 GOD/CA/GCE在不含葡萄糖溶液(a)和葡萄糖浓度为5 mmol·L-1的溶液(b)中的循环伏安图Fig.10 Cyclic voltammograms of GOD/CA/GCE in absence(a)and presence(b)of 5 mmol·L-1glucose solution conditions:0.1 mol·L-1PBS(pH=7.0),v=100 mV·s-1
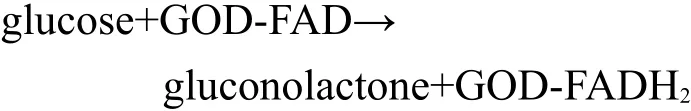
图11A为GOD/CA/GC电极对葡萄糖的催化性能测试,从图中可以看出,当连续加入浓度为0.4 mmol·L-1的葡萄糖溶液时,电流响应出现跳跃性增大,电极的电流响应时间小于10 s.随着葡萄糖的浓度增大,可以观察到电极响应出现了一个饱和平台,说明此电极反应具有典型的Michaelis-Menten酶反应动力学特征.图11B为电流响应值与葡萄糖浓度的关系图,二者在一定范围内呈现良好的线性关系,线性范围为0.4-2.0 mmol·L-1,线性相关系数为0.99114.由图可以得到该电极的灵敏度约为5.33 μA·mmol-1·cm-2,当信噪比为3时,电极检测限为0.266 mmol·L-1.结果表明GOD/CA/GC电极具有较高的灵敏度和较低检测限.
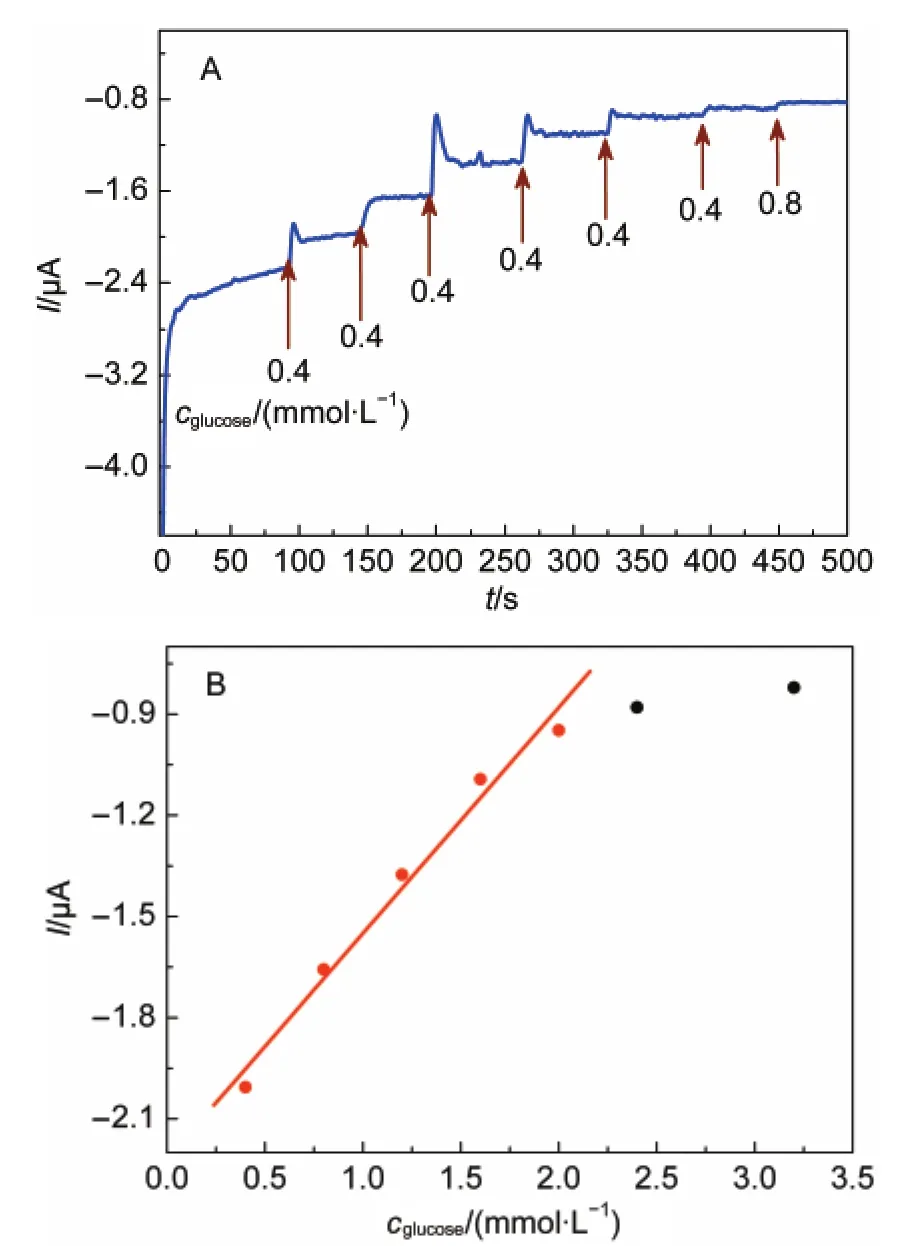
图11 GOD/CA/GC电极对葡萄糖的催化性能图(A)与电流响应值与葡萄糖浓度的关系(B)Fig.11 Amperometric response of GOD/CA/GC electrode during successive addition of glucose(A)and plots of chronoamperometric current vs glucose concentration(B) conditions:0.1 mol·L-1PBS(pH=7.0),potential of-480 mV
图12为干扰物对GOD/CA/GC电极催化葡萄糖性能影响的测试结果,从图中可以看出,加入浓度为0.8 mmol·L-1的葡萄糖溶液时有电流响应,而当分别加入浓度均为0.08 mmol·L-1的抗坏血酸(AA)、尿酸(UA)和多巴胺(DP)时,电流基本没有受到影响,表明该电极具有很好的抗干扰性.27
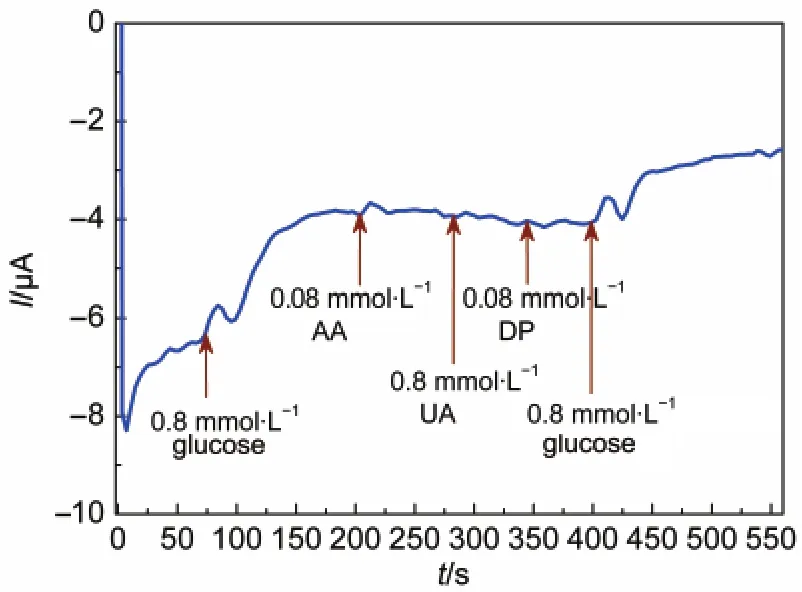
图12 干扰物对GOD/CA/GC电极催化葡萄糖性能的影响Fig.12 Effect of interfering species on response of GOD/CA/GC eletrode to glucose interfering species dissolved in 0.1 mol·L-1PBS(pH=7.0),at potential of-480 mV;AA:ascorbic acid,UA:uric acid,DP:dopamine
为了考察GOD/CA/GC电极的重现性,用6根不同的玻碳电极,分别固定GOD/CA,CV测定结果为6条曲线几乎重合,说明该电极有很好的重现性;在缓冲溶液中,将电极在100 mV·s-1的扫描速率下连续扫描90圈,其循环伏安曲线基本保持不变,工作稳定性很好;将GOD/CA/GC电极放在4°C冰箱中保存2天后在缓冲溶液中再次测定其对葡萄糖的催化活性,发现CV曲线中的电催化电流并没有明显的改变,这说明GOD/CA/GC电极具有很好的贮存稳定性.
4 结论
表面结构和孔径分布结果表明,CA载体材料具有与葡萄糖氧化酶大小相匹配的介孔结构和较大的表面积,该结构有利于酶的负载.以CA载体采用吸附法得到GOD/CA/GC电极,该电极在磷酸盐缓冲溶液中的循环伏安曲线说明,CA载体可以很好地固定GOD并保持其生物活性,且氧化还原峰的电流与扫描速率呈线性关系,说明电极反应受表面控制;GOD/CA/GC电极在不同pH值下循环伏安曲线分析结果表明,GOD在电极上实现了直接电子转移;I-t曲线表明,GOD/CA/GC电极对葡萄糖具有良好的催化性能并表现出较好的稳定性和重现性.
(1) Qian,J.Q.;Yan,S.C.;Xiao,Z.D.J.Colloid Interface Sci. 2012,366(1),130.doi:10.1016/j.jcis.2011.09.082
(2)Alwarappan,S.;Boyapalle,S.;Kumar,A.;Li,C.Z.;Mohapatra, S.J.Phys.Chem.C 2012,116(11),6556.doi:10.1021/ jp211201b
(3) Gu,T.;Zhang,Y.;Deng,F.;Zhang,J.;Hasebe,Y.J.Environ. Sci.2011,23(Supplement),S66.
(4) Vasylieva,N.;Barnych,B.;Meiller,A.;Maocler,C.;Pollegioni, L.;Lin,J.S.;Barbier,D.;Marinesco,S.Biosens.Bioelectron. 2011,26(10),3993.doi:10.1016/j.bios.2011.03.012
(5)Guo,C.X.;Li,C.M.Phys.Chem.Chem.Phys.2010,12(38), 12153.
(6) Hecht,H.J.;Kalisz,H.M.;Hendle,J.;Schmid,R.D.; Schomburg,D.J.Mol.Biol.1993,229(1),153.doi:10.1006/ jmbi.1993.1015
(7)Ma,G.X.;Zhong,H.;Lu,T.H.;Xia,Y.Y.Acta Phys.-Chim. Sin.2007,23(7),1053. [马国仙,仲 慧,陆天虹,夏永姚.物理化学学报,2007,23(7),1053.]doi:10.3866/PKU. WHXB20070717
(8) Chen,Z.C.;Xu,S.H.;Lin,H.F.;Yang,S.M.;Lin,X.F.Acta Phys.-Chim.Sin.2004,20(10),1267.[陈志春,徐善浩,林汉枫,杨绍明,林贤福.物理化学学报,2004,20(10),1267.]doi: 10.3866/PKU.WHXB20041021
(9)Guo,X.L.;Guo,M.;Wang,X.D.Acta Phys.-Chim.Sin.2007, 23(4),585.[郭小丽,郭 敏,王新东.物理化学学报,2007, 23(4),585.]doi:10.3866/PKU.WHXB20070426
(10)Yang,Z.J.;Huang,X.C.;Zhang,R.C.;Li,J.;Xu,Q.;Hu,X.Y. Electrochim.Acta 2012,70,325.
(11)Luo,Z.M.;Yuwen,L.H.;Han,Y.J.;Tian,J.;Zhu,X.R.;Weng, L.X.;Wang,L.H.Biosens.Bioelectron.2012,36(1),179.doi: 10.1016/j.bios.2012.04.009
(12)Tsai,T.W.;Heckert,G.;Neves,L.F.;Tan,Y.Q.;Kao,D.Y.; Harrison,R.G.;Resasco,D.E.;Schmidtke,D.W.Anal.Chem. 2009,81(19),7917.doi:10.1021/ac900650r
(13)Kang,X.H.;Wang,J.;Wu,H.;Aksayet,I.A.;Liu,J.;Lin,Y.H. Biosens.Bioelectron.2009,25(4),901.doi:10.1016/j. bios.2009.09.004
(14) Xu,X.;Jiang,S.;Hu,Z.;Liu,S.Q.ACS Nano 2010,4(7), 4292.doi:10.1021/nn1010057
(15)Wang,Y.;Yuan,R.;Chaia,Y.;Li,W.J.;Zhuo,Y.;Yuan,Y.L.; Li,J.J.J.Mol.Catal.B:Enzym.2011,71(3-4),146.doi: 10.1016/j.molcatb.2011.04.011
(16)You,C.;Xu,X.;Tian,B.;Kong,J.L.;Zhao,D.Y.;Liu,B.H. Talanta 2009,78(3),705.doi:10.1016/j.talanta.2008.12.032
(17)You,C.;Yan,X.;Kong,J.;Zhao,D.Y.;Liu,B.H.Talanta 2011, 83(5),1507.doi:10.1016/j.talanta.2010.11.041
(18) Patil,D.;Dung,N.Q.;Jung,H.;Ahn,S.Y.;Jang,D.M.;Kim, D.Biosens.Bioelectron.2012,31(1),176.doi:10.1016/j. bios.2011.10.013
(19) Moreno-Castilla,C.;Maldonado-Hodar,F.J.Carbon 2005,43 (3),455.doi:10.1016/j.carbon.2004.10.022
(20)Zhu,H.;Guo,Z.;Zhang,X.;Han,K.F.;Guo,Y.B.;Wang,F. H.;Wang,Z.M.;Wei,Y.S.Int.J.Hydrog.Energy 2012,37(1), 873.doi:10.1016/j.ijhydene.2011.04.032
(21) Pekala,R.W.J.Mater.Sci.1989,24(9),3221.
(22) Wu,S.;Ju,H.;Liu,Y.Adv.Funct.Mater.2007,17(4),585.
(23) Bao,S.J.;Li,C.M.;Zang,J.F.;Cui,X.Q.;Qiao,T.;Guo,J. Adv.Funct.Mater.2008,18(4),591.
(24) Laviron,J.Electroanal.Chem.1979,101(1),19.doi:10.1016/ S0022-0728(79)80075-3
(25) Ivnitski,D.;Artyushkova,K.;Rincon,R.A.;Atanassov,R.P.; Luckarift,H.R.;Johnson,G.R.Small 2008,4(3),357.
(26) Janegitz,B.C.;Pauliukaite,R.;Ghica,M.E.;Brettb,C.B.A.; Fatibello-Filho,O.Sens.Actuators B 2011,158(1),411.doi: 10.1016/j.snb.2011.06.048
(27) Meng,L.;Jin,J.;Yang,G.X.;Lu,T.H.;Zhang,H.;Cai,C.X. Anal.Chem.2009,81(17),7271.doi:10.1021/ac901005p

