不同营养水体对喜旱莲子草化感抗藻的影响
叶良涛,钱家忠,左胜鹏,李蜀萍,陈雅琼
(1.安徽师范大学环境科学与工程学院,安徽 芜湖241003;2.合肥工业大学资源与环境工程学院,安徽 合肥230009)
一些水生植物能产生化感物质抑制有害藻类的生长,因此利用水生植物的化感潜力抑藻成为一种很有前景的藻类控制技术[1,2]。如挺水植物中的芦苇(Phragmitescommunis)释放2-甲基乙酰乙酸乙酯[3]、浮水植物中的凤眼莲(Eichhorniacrassipes)释放 N-苯基-2-萘胺[4]、沉水植物中的穗花狐尾藻(Myriophyllumspicatum)[5]产生五倍子酸、焦棓酸等,均能抑制水体中有害藻类的生长。两栖植物喜旱莲子草(Alternantheraphiloxeroides)是苋科多年生草本植物,原产南美洲,后被引入北美洲、大洋洲、东南亚和中国等地,现已成为一个世界性的入侵植物种[6]。目前关于喜旱莲子草的研究多集中于喜旱莲子草生物入侵性[7]、生态适应性[8]、生物防治[9]、环境效应[10]以及对草坪草的化感作用[11]等方面的内容,而关于入侵植物喜旱莲子草抗藻方面的研究鲜有报道。由于在我国巢湖、滇池、太湖等众多浅型湖泊中几乎连年暴发水华,有害藻中以蓝藻和绿藻居多。因此,本研究选择铜绿微囊藻为实验对象,设计不同的喜旱莲子草水体营养环境,比较分析了喜旱莲子草活体和残体植株对铜绿微囊藻生长的影响,同时调查水体理化性质,试图揭示富营养化水体中入侵植物喜旱莲子草化感控藻的机制,为有效地管理和利用入侵植物,以及合理控制水华提供理论参考。
1 材料与方法
1.1 材料
铜绿微囊藻购自中国科学院水生生物研究所淡水藻种库。实验前用BG11培养基在GHP-160光照培养箱(三发,上海)中对铜绿微囊藻进行扩大并稳定继代培养,光暗周期12h∶12h,昼间温度25℃,光强70μmol/(m2·s);夜间温度20℃。喜旱莲子草于2009年7月采自于巢湖忠庙湿地,实验前分别经自来水、蒸馏水各冲洗3次,每次10min,去除植株上携带泥沙、附着物等杂质。其中一部分植株在水族箱作为活体培养,备用;另一部分在110℃下杀青15min,再自然晾干,剪成5cm小段,放于低温冰箱保存,备用。
1.2 喜旱莲子草活体和残体植株化感抗藻测定
实验共设3种培养环境:富营养化湖水(巢湖西半湖湖心,其水体特征见表1)、标准BG11培养液和二次蒸馏水。选取30株形态相似(30cm/株)、生物量相近、幼嫩鲜活的喜旱莲子草植株,分别移植于装有上述3种培养液(培养液体积为10L)的水族箱中(20cm×40cm×60cm),每箱移栽10株。当移植成活后,分别在第0,5,10,15和20天用酸度计(雷磁,上海)测定培养水体的pH值和氧化还原电位。同时分别取2类材料在3种不同水体营养状态下所对应天数的种植水和腐解液100mL,先用定性滤纸过滤,再用0.45μm的滤膜(新亚,上海)进行抽滤,最后通过0.22μm的滤膜(新亚,上海)滤除微生物和杂质,储藏于4℃冰箱备用。

表1 来自巢湖的富营养化培养水体特征Table 1 Water features of eutrophic culture medium from Chaohu Lake mg/L
前期实验结果显示在接种铜绿微囊藻的同时,分别加1,2,5,10,20mL上述3种滤液,培养3,6,9,12,15d后,发现10mL添加液对处于迟滞期(即0~6d)的铜绿微囊藻有显著抑制,而且处理间差异显著(P<0.01,20mL为100%抑制,数据未显示)。在已装有50mL灭菌BG11培养液的锥形瓶中,于DL-CJ-2ND医用型超净工作台上,分别接种5mL铜绿微囊藻液。
因此,本实验先采用喜旱莲子草活体植株、3类水体(蒸馏水、BG11、富营养水)、每类水体各取5个培养时期水样(第0,5,10,15和20天),每时期均取20mL水样,最后得到10mL滤液,加入到已接种4d的藻类培养液中,用带微生物过滤的封口膜包裹好,放入光照培养箱进行培养,培养3d后,从各处理的锥形瓶中取10mL于试管中用低频漩涡混合振荡器振荡2min,使藻细胞分布均匀,然后分别在显微镜(欧依卡,重庆)下用血球计数板进行计数,测定藻密度。培养过程中,每天定时振摇4次,进行藻类扰动,增强活力和保持正常增殖。活体植株共15个处理,每处理重复6次。同理,进行残体植株腐解实验,以上步骤基本相同,只是在以上3种培养液中,以50 g/L的标准进行添加喜旱莲子草残体植株,在水族箱自然腐解,最后测定藻密度。
化感指数(allelopathic index)的确立是根据 Williamson和Richardson[12]提出的化感作用评价方法。
1.3 数据处理
实验数据采用Excel 2003软件进行作图和统计分析。
2 结果与分析
2.1 不同营养水体对喜旱莲子草化感抗藻的影响
在3种不同的水体营养状态下,喜旱莲子草活体植株对铜绿微囊藻的抑制效应为:蒸馏水>富营养化湖水>标准BG11营养液(图1A)。喜旱莲子草第5天的种植水已达到抗藻的一个高峰,随后的第10天到第20天的种植水抑藻效应趋于稳定,但有轻微波动。在蒸馏水培养下,其第5天种植水对铜绿微囊藻的化感指数为70.7%,为最高值;之后从第5天到第15天的种植水化感指数持续下降,到第15天降到最低值;随后其种植水化感指数又开始缓慢上升。在富营养湖水培养下,喜旱莲子草活体植株第5天种植水对铜绿微囊藻的化感指数为56.5%;在第5~10天,其种植水化感指数开始缓慢上升,第10天达到最高(63.2%);之后化感指数开始缓慢下降,第20天下降到最低值,仅为54%。在BG11营养液培养下,喜旱莲子草活体植株第5天种植水对铜绿微囊藻的化感指数为48.5%,达到最高值;随后第5~20天,化感指数先下降再上升,然后再下降,直到最低值37.1%。喜旱莲子草残体植株腐解液化感抗藻动态在3种不同营养水体中差异显著,表现为:富营养化湖水>标准BG11营养液>蒸馏水,但总体趋势基本相同(图1B),即第5天的腐解液化感指数达到最大值,随后的第10~20天抑藻效应趋于稳定。在富营养化湖水中腐解的喜旱莲子草残体植株表现出最佳的化感抑藻效应,其第5天的腐解液就对铜绿微囊藻的化感指数达到91.7%;之后在第5~15天,其化感指数逐渐上升,并达到最高值(96%);随后,在第15~20天,其值略有下降。在BG11营养液中腐解的喜旱莲子草残体植株抑藻效应中等,其第5天的腐解液对铜绿微囊藻化感指数达到87.1%,仅次于第10天的腐解液对铜绿微囊藻87.9%的最高化感指数;之后在第10~20天,其化感指数持续下降。在蒸馏水中腐解的喜旱莲子草残体植株化感抑藻效应在3类模拟水体环境中最低,其腐解液对铜绿微囊藻的化感指数最高值仅为78.5%。
2.2 喜旱莲子草培养水体的pH变化
喜旱莲子草的活体植株和残体植株的水培养液pH值随时间推移而发生改变,残体植株腐解液的pH值主要呈酸性,而活体植株培养液的pH值变化趋势不一致(图2)。活体植株的富营养化湖水培养液pH值偏碱性,在标准BG11培养液中pH值近似为中性,在蒸馏水培养液中pH值偏酸性,即3类水体的pH值按降序排列为:富营养化湖水>标准BG11营养液>蒸馏水(图2A)。在不同的水体环境中喜旱莲子草残体植株腐解液的pH值变化趋势很明显,都是随时间的推移缓缓下降,但到了15d以后pH变化趋势平稳,基本无变化(图2B)。喜旱莲子草残体植株可能在腐解的过程中释放某些酸性物质,使得pH缓缓下降。
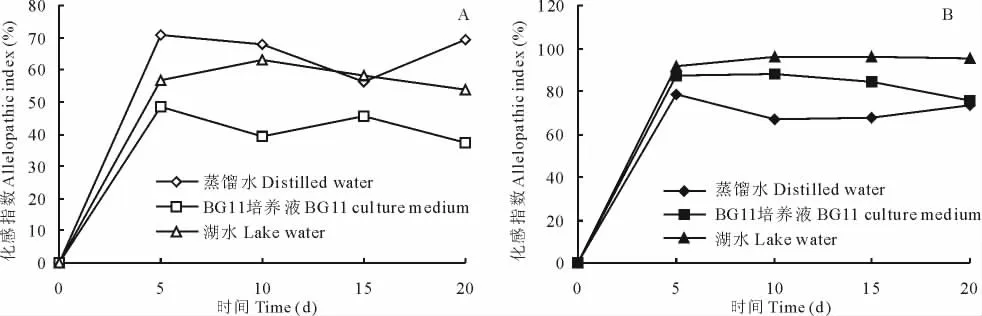
图1 不同营养水体中的喜旱莲子草活体植株(A)和残体植株(B)对铜绿微囊藻生长的影响Fig.1 Effects of living plants(A)and dead plants(B)of A.philoxeroides on the growth of M.aeruginosain different trophic status

图2 喜旱莲子草的培养液在不同培养时间下的pH变化Fig.2 pH variation of cultivated solution of A.philoxeroides at different cultivated period A:活体植株 Living plants;B:残体植株 Dead plants.
2.3 喜旱莲子草培养水体氧化还原电位变化
喜旱莲子草的活体植株培养液和残体植株腐解液的氧化还原电位随时间发生显著变化,且两者氧化还原电位变化趋势不同(图3)。喜旱莲子草活体植株蒸馏水培养液的氧化还原电位的总变化趋势是先逐渐下降到最低点再逐渐上升。喜旱莲子草活体植株富营养化湖水培养液的氧化还原电位总变化趋势是先缓慢上升后逐渐下降。喜旱莲子草活体植株标准BG11培养液的氧化还原电位也是先缓慢上升,但后期大幅下降。喜旱莲子草残体植株的3类水体环境腐解液的氧化还原电位变化趋势基本一致,都是逐渐下降的,按降序来排列大致顺序为:蒸馏水>标准BG11营养液>富营养化湖水。总之,活体植株培养液的氧化还原电位变化较缓,按降序来排列大致顺序为:蒸馏水>富营养化湖水>标准BG11营养液,其氧化还原电位值大部分比残体植株腐解液氧化还原电位值高;残体植株腐解液的氧化还原电位值变化幅度较大,且氧化还原电位值随时间推移逐渐降低(图3)。

图3 喜旱莲子草的培养液在不同培养时间下的氧化还原电位的变化Fig.3 Oxidation and reduction potential variation of cultivated solution of A.philoxeroides at different cultivated period A:活体植株 Living plants;B:残体植株 Dead plants.
3 讨论
3.1 喜旱莲子草对铜绿微囊藻生长特性的影响
植物化感物质的释放途径主要包括植物挥发、根系分泌、雨雾淋溶、残株分解等[13,14]。因此推测喜旱莲子草活体植株主要通过根系分泌方式释放化感物质,而残体植株主要采用腐解方式释放化感物质。本研究发现入侵植物喜旱莲子草的活体植株和残体植株培养液均对铜绿微囊藻的生长和繁殖表现出一定的化感抑制效应,且喜旱莲子草的残体植株腐解液比活体植株种植水对铜绿微囊藻的生长抑制效应更强。喜旱莲子草活体植株在不同水体培养环境下化感作用强弱关系,按降序排列为:蒸馏水>富营养化湖水>标准BG11营养液。孔垂华等[15]认为在缺水、缺肥等环境胁迫条件下,植物可以通过释放化感物质的方式抑制周围其他植物的生长,从而增加其对养分、水分等的相对竞争能力。蒸馏水中培养的活体植株正是在缺肥的环境胁迫下,释放大量化感物质抑制周围其他植物生长,其种植水对铜绿微囊藻生长抑制效应最强;同样,在富营养化湖水中培养的活体植株由于其营养物质过剩,也会释放大量化感物质,但对铜绿微囊藻的抑制效应比蒸馏水培养液要弱;而在营养成分适中的BG11培养液生长的喜旱莲子草由于不受任何环境因子胁迫,释放的化感物质量最少,其化感指数也最低。研究还发现喜旱莲子草残体植株在不同水体培养环境下所呈现的化感作用也存在明显的强弱关系,其顺序为:富营养化湖水>标准BG11营养液>蒸馏水。而3种不同营养状态下的水体环境中的营养成分排列顺序也为:富营养化湖水>BG11培养液>蒸馏水。这表明营养物质中某些成分可能会加快残体植株分解的速度和程度,所以在营养物质含量越高的情况下,残株越容易腐解释放大量化感物质,抑制铜绿微囊藻的生长和繁殖。
3.2 培养水体性质pH和氧化还原电位对化感抗藻的影响
pH值是藻类生长的非常重要的理化指标。一般认为,蓝藻偏好较高的pH[16],但本实验发现在酸性pH和碱性pH条件下的活体植株培养液和残体植株腐解液均对铜绿微囊藻有很好的抑制效应,只是在低pH环境条件下,残株腐解液的抑藻效应表现得更强烈些。本研究中的喜旱莲子草残体植株腐解液比活体植株培养液对铜绿微囊藻的生长抑制效应更强,残体植株可能分解产生更多的酸性化感物质,pH值开始下降,导致藻的生长受到抑制,而后pH值又慢慢趋于稳定,抑藻效应也随之趋于稳定。目前还未见氧化还原电位变化与水生植物化感物质释放强度关系的相关报道。本研究中喜旱莲子草活体植株培养液氧化还原电位变化较缓,而残体植株腐解液的氧化还原电位表现为持续下降,这可能是活体植株培养液释放化感物质速率较慢,量较少,而残体植株腐解液释放化感物质较快,量较多。喜旱莲子草的残体植株可能释放一些具有还原性化学物质,消耗了水中氧化性物质,所以导致出现培养液中氧化还原电位缓缓下降现象,这些物质具体化学成分还需进一步分析。
[1]Hong Y,Hu H Y.Effects of the aquatic extract ofArundodonaxL.(giant reed)on the growth of freshwater algae[J].Allelopathy Journal,2007,20(2):315-325.
[2]Sutfeld R,Petereit F,Nahrstedt A.Resorcinol in exudates ofNupharlutea[J].Journal of Chemical Ecology,1996,22:2221-2231.
[3]Li F M,Hu H Y.Allelopathic effects of different macrophytes on the growth ofMicrocystisaeruginosa[J].Allelopathy Journal,2005,15(1):145-152.
[4]俞子文,孙文浩,郭克勤,等.几种高等水生植物的克藻效应[J].水生生物学报,1992,16(1):1-7.
[5]Nakai S,Inoue Y,Hosomi M,etal.Myriophyllumspicatum-released allelopathic polyphenols inhibiting growth of bluegreen algae,Microcystisaeruginosa[J].Water Research,2000,34(11):3026-3032.
[6]Julien M,Skarratt B,Maywald G F.Potential geographical distribution of alligator weed and its biological control byAgasicleshygrophila[J].Journal of Aquatic Plant Management,1995,33:55-60.
[7]Shelley B,Andrew N.Alligator weed(Alternantheraphiloxeroides)in New South Wales,Australia:A status report[J].Weed Biology and Management,2008,(8):284-290.
[8]Wang N,Yu F H,Li P X,etal.Clonal integration supports the expansion from terrestrial to aquatic environments of the amphibious stoloniferous herbAlternantheraphiloxeroides[J].Plant Biology,2009,(11):483-489.
[9]Tan W Z,Li Q J,Qing L.Biological control of alligatorweed(Alternantheraphiloxeroides)with aFusariumsp.[J].Bio-Control,2002,(47):463-479.
[10]Naqvi S M,Rizvi S A.Accumulation of chromium and copper in three different soils and bioaccumulation in an aquatic plant,Alternantheraphiloxeroides[J].Bulletin of Environmental Contamination and Toxicology,2000,65:55-61.
[11]刘爱荣,张远兵,张雪梅,等.空心莲子草水浸液对黑麦草和高羊茅种子发芽和幼苗生长的影响[J].草业学报,2007,16(5):96-101.
[12]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[13]孔垂华,徐涛,胡飞.胜红蓟化感作用研究Ⅱ.主要化感物质的释放途径和活性[J].应用生态学报,1998,9(3):257-260.
[14]张悦丽,秦立琴,高兴祥,等.小根蒜对花生田3种主要杂草马唐、稗草和反枝苋的化感作用[J].草业学报,2010,19(5):57-62.
[15]孔垂华,徐涛,胡飞,等.环境胁迫下植物的化感作用及其诱导机制[J].生态学报,2000,20(5):849-854.
[16]刘春光,金相灿,孙凌,等.pH值对淡水藻类生长和种类变化的影响[J].农业环境科学学报,2005,24(2):294-298.

