虫草菌多糖对吸烟引起的树突状细胞氧化损伤的保护作用*
王晨浩,徐 珺,王文梅,张伟云
南京大学医学院 江苏省医学分子技术重点实验室,南京 210093
越来越多的实验证明,从高等植物、微生物或藻类提取的多糖具有良好的抗氧化、抗肿瘤、抗衰老、免疫调节活性[1-4]。虫草菌多糖是冬虫夏草(Cordyceps sinensis)的主要活性成分之一,具有多种生物活性。野生冬虫夏草分布地域狭窄、资源稀少,需求量极大。研究发现,虫草菌丝体的药理作用与野生冬虫夏草相似,且易于大规模发酵培养。本课题组从一株虫草无性型真菌的发酵液中分离纯化出胞外多糖(EPS)并且已发现其具有免疫调节作用[5]。我们之前的研究表明,虫草菌多糖可抑制荷瘤小鼠体内肿瘤的生长和转移,且进一步的实验表明这一抑制作用是通过EPS调节小鼠体内的免疫系统和提高其抗氧化能力来发挥作用的[5-6]。
树突状细胞(DC)是机体专职抗原递呈细胞,它在机体的特异性免疫和非特异性免疫中发挥着重要的桥梁作用,且它是机体免疫反应的重要启动者,对于调节和维持机体内免疫系统的平衡与稳定有着重要的作用。在吸烟引起的相关疾病如慢性阻塞性肺病和肺癌的发病过程中树突状细胞起着重要的作用[7-8]。
吸烟造成的氧化应激损害机体的免疫防御功能已被广泛认可,本文首次研究虫草菌多糖(EPS)对于吸烟引起的树突状细胞的氧化损伤的保护作用。
1 材 料
1.1 药品与试剂
南京(精品)香烟(南京卷烟厂,焦油:12 mg/支、尼古丁:1.2 mg/支);DCS细胞系(北京协和医科大学);胎牛血清、RPMI-1640培养基(美国Gibco公司);MTT、二甲基亚砜(DMSO)、DCFH-DA(美国Sigma公司);CAT试剂盒、SOD试剂盒和LDH试剂盒(南京建成科技有限公司);其它试剂均为生化试剂或分析纯。
1.2 仪器
TE2000-S倒置相差显微镜(日本Nikon公司);FACS Cailbur流式细胞仪(美国Becton-Dickson公司);MCO-15AC二氧化碳培养箱(日本Sanyo公司);Model-550酶标仪(美国Bio-Rad公司);Heraeus Fersco 17高速冷冻离心机(美国Thermo公司)。
2 方 法
2.1 EPS的制备
按照本实验室建立的方法进行真菌发酵培养。收集虫草菌发酵液,制备胞外多糖EPS[5]。EPS为均一多糖,其分子量为1.04×105,糖基组成为甘露糖-葡萄糖-半乳糖(23∶1∶2.6)。
2.2 香烟提取物的制备
将点燃的香烟通过吸烟泵导入RPMI-1640培养基,每支烟溶于10 mL培养液,通过调节流速控制一支烟在5 min左右燃完,过滤除菌即制得100%的烟提取物(CSE),于-20℃保存备用。使用时按比例用培养基稀释。
2.3 MTT法测定香烟提取物对DCS细胞增殖的影响
取对数生长的DCS细胞,调整为以1×105·mL-1,接种于96孔培养板,100 μL/孔,贴壁。加入不同浓度的CSE,在培养液中终浓度分别为0%、3.75%、7.5%、15%、30%(原提取物为100%)。设5个平行孔,培养 48 h。加 10 μL MTT(5 mg·mL-1),培养 4 h,然后加入10%十二烷基硫酸钠(SDS)过夜,用酶标仪于570 nm处测定OD值。
2.4 香烟提取物对DCS的作用及ROS含量测定
将 DCS 细胞(1×105·mL-1)接种于 24 孔板,1 mL/孔,贴壁。加入不同浓度CSE,设4个复孔,继续培养 48 h。胰酶消化,收集细胞,离心(1000 r·min-1,10 min)去上清液,加入 DCFH-DA(150 μL/管,终浓度为 10 μmol·L-1),室温避光孵育 30 min。添加 PBS(300 μL/管),用流式细胞仪检测10000个细胞内的DCFH-DA平均荧光强度,激发波长488 nm,发射波长530 nm,用FLOWJO软件分析数据。
2.5 EPS对DCS的保护后ROS含量测定
将 DCS 细胞(1×105·mL-1)接种于 24 孔板,1 mL/孔,贴壁。加不同浓度药物 EPS(12.5、25、50、100 μg·mL-1),设 4 个复孔。培养 24 h 后加 7.5%CSE,继续培养24 h。胰酶消化,收集细胞,离心(1000 r·min-1,10 min)去上清液,同上述方法检测细胞内的DCFH-DA平均荧光强度。
2.6 EPS保护后DCS细胞乳酸脱氢酶(LDH)的测定
DCS 细胞稀释成 1×105·mL-1,接种于 24 孔板,1 mL/孔,贴壁。加不同浓度 EPS(12.5、25、50、100 μg·mL-1),设 4 个复孔,培养 24 h 加 7.5%CSE(7.5%CES可引起ROS显著增加)处理24 h。吸取培养上清液用于LDH活检测。测定方法参照试剂盒说明书。
2.7 EPS保护后DCS细胞过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活力的测定
DCS 细胞稀释成 1×105·mL-1,接种于 24 孔板,1 mL/孔,贴壁。加不同浓度药物 EPS(12.5、25、50、100 μg·mL-1),设 4 个复孔,作用 24 h 后加 7.5%CSE处理24 h,然后换新鲜培养基继续培养。24 h后收集细胞,用PBS洗两遍,重悬于0.2 mL 0.1 mol·L-1PBS(含 0.05 mmol·L-1EDTA)中,反复冻融3 次,4℃ 10200 r·min-1离心 30 min,取上清液用于CAT、SOD检测。测定方法参照试剂盒说明书。
2.8 统计方法
3 结 果
3.1 香烟提取物对DCS细胞增殖的抑制作用
香烟提取物作用DCS细胞48 h后,其增殖能力明显受抑制,在30%CSE作用下,具有显著抑制作用(P<0.05),见图 1。
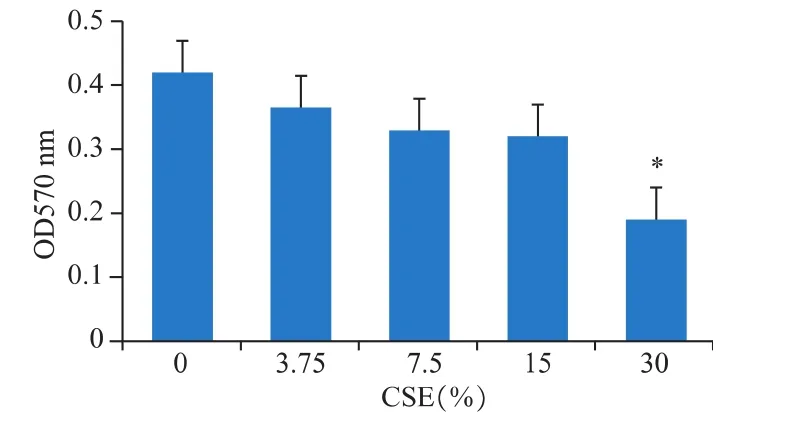
图1 香烟提取物对DCS细胞增殖能力的影响
3.2 香烟提取物对DCS细胞ROS产生的影响
流式细胞仪检测结果如图2所示。香烟提取物作用DCS细胞48 h后,其ROS产生水平在CSE浓度为7.5%、15%和30%时有显著增加(P<0.05),且呈剂量依赖关系。

图2 香烟提取物对DCS细胞ROS水平的影响
3.3 EPS对DCS细胞ROS产生的保护作用
EPS与DCS细胞共同孵育24 h后,在25、50、100 μg·mL-1剂量组ROS产生的量明显降低,可以抵抗烟引起的ROS增加(见图3)。
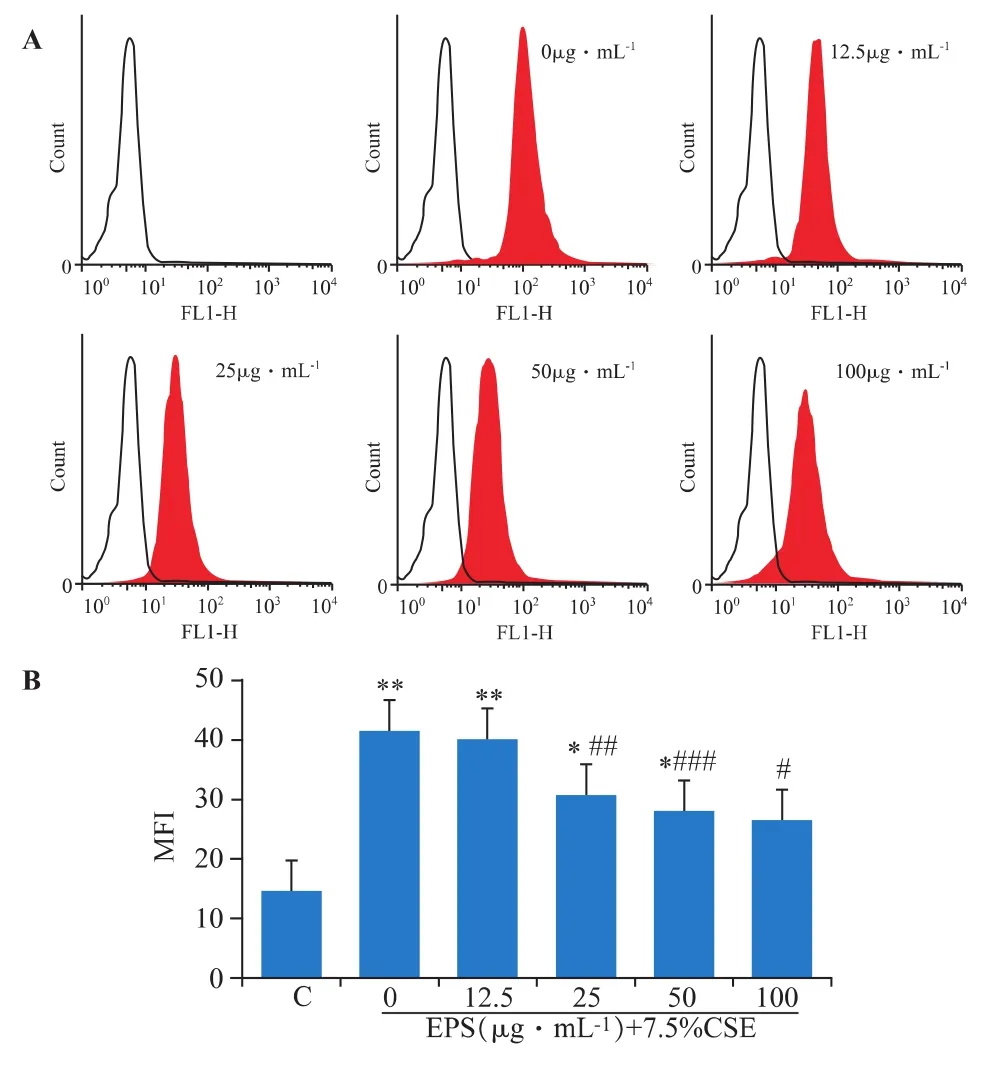
图3 EPS对CSE诱导DCS细胞产生的ROS的抑制作用
3.4 EPS对DCS细胞LDH过度释放的保护作用
LDH是广泛存在于细胞中参与能量代谢的一类重要酶。LDH的过度释放是细胞受损的一个重要指标。如图4所示,由于烟的伤害导致DCS细胞释放到细胞外的LDH活性显著提高(P<0.001)。而采用EPS预孵育24 h,则显著降低了LDH的水平(12.5 μg·mL-1和 25 μg·mL-1,P<0.05;50 μg·mL-1,P<0.01;100 μg·mL-1,P<0.001),且呈浓度依赖关系。
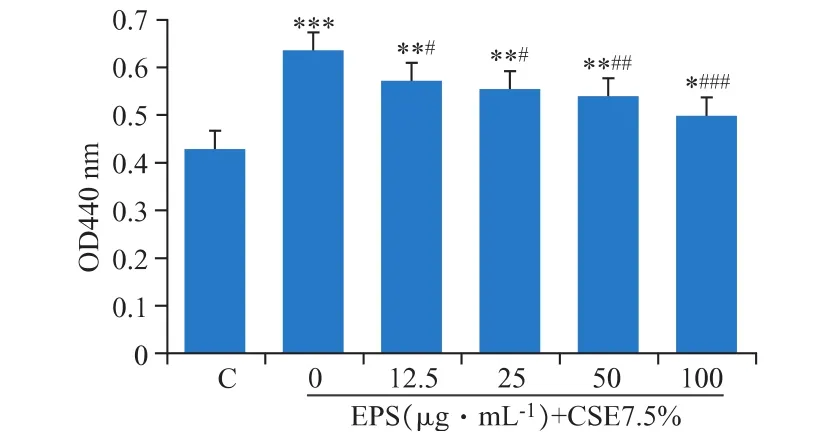
图4 EPS对CSE诱导DCS细胞产生的LDH的抑制作用
3.5 EPS对DCS细胞CAT产生的保护作用
CAT是胞内催化H2O2分解的一类重要的抗氧化酶。如图5所示,CSE的处理损耗了胞内大量的CAT(P<0.001),使 CAT 活性从 0.23 U·(mg prot)-1下降到 0.03 U·(mg prot)-1,而 EPS 的预处理,缓解了CAT活性的下降,效果极其显著(P<0.001)。
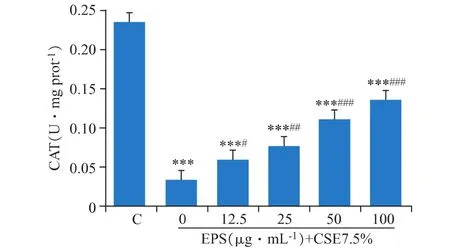
图5 EPS对CSE处理的DCS细胞的CAT活性的影响
3.6 EPS对DCS细胞SOD产生的保护作用
SOD可以清除超氧阴离子自由基,从而保护细胞免受损伤。如图6所示,CSE处理之后,细胞内SOD活性显著下降(P<0.001),EPS预处理后对胞内SOD活力有非常显著地提升(P<0.001)。
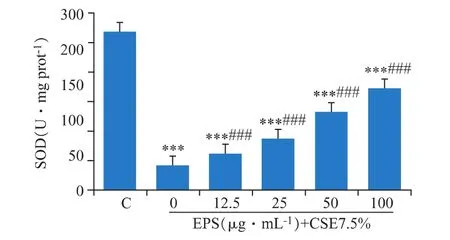
图6 EPS对CSE处理的DCS细胞的SOD活性的影响
4 讨 论
氧是人正常代谢所必须的成分,在人体中,需要用氧参与体内很多反应以维持生命。但在反应过程中,会产生一系列的活性氧(reactive oxygen species,ROS)。在正常的生理状态下,ROS会在抗氧化酶及外源性和内源性的抗氧化剂的作用下处于生成与清除的动态平衡中,维持在极低水平,发挥其正常的生理功能[9]。但在内源性或外源性的刺激下,使机体代谢异常而骤然产生大量的ROS,或机体抗氧化防御能力不足时,则使得机体处于氧化应激状态,导致细胞可逆或不可逆的损伤,引起细胞凋亡或坏死[10]。
已有研究显示,吸烟可导致细胞内ROS升高,高浓度的ROS在细胞内可以攻击生物膜中的多不饱和脂肪酸,使细胞质膜损伤,乳酸脱氢酶泄露,并导致细胞凋亡[11]。本实验使用CSE诱导损伤的DCS,观察EPS对氧化应激下细胞的保护作用。
实验结果表明,CSE作用于DCS后,细胞的存活率明显下降且LDH释放量上升,说明CSE导致DCS细胞明显损伤;而使用EPS预处理后,细胞LDH释放量和ROS水平都显著降低,说明细胞所受损伤减轻,证实EPS对氧化损伤状态下的DCS有保护作用。CAT、SOD是广泛存在于组织细胞中抗氧化酶类,可以通过清除过多的活性氧,保持胞内的氧化平衡,避免细胞氧化损伤[12]。在本实验中CSE作用24 h可使DCS细胞内抗氧化酶活性明显下降,其下降趋势可以被不同浓度的EPS减弱。这些结果表明,EPS对DCS细胞的氧化应激有保护作用,并且其保护作用与调节细胞内抗氧化酶活性有关。
[1]Wu F,Yan H,Ma X,et al.Structural characterization and antioxidant activity of purified polysaccharide from cultured Cordyceps militaris[J].Afr J Microbiol Res,2011,5(18)∶2743-51.
[2]Umehara S,Fujiwara H,Shiozaki A,et al.PSK induces apoptosis through the inhibition ofactivated STAT3 in human esophageal carcinoma cells[J].Int J Oncol,2012,41(1)∶61-6.
[3]Xiao JH,Xiao DM,Chen DX,et al.Polysaccharides from the medicinal mushroom Cordyceps taii show antioxidant and immuno enhancing activities in a D-galactose-induced aging mouse model[J].Evid Based Complement Alternat Med,2012∶273435.
[4]Li XT,Zhang YK,Kuang HX,et al.Mitochondrial protection and anti-aging activity of Astragalus polysaccharides and their potential mechanism[J].Int J Mol Sci,2012,13(2)∶1747-61.
[5]Zhang W,Yang J,Chen J,et al.Immunomodulatory and antitumour effects of an exopolysaccharide fraction from cultivated Cordyceps sinensis(Chinese caterpillar fungus)on tumour-bearing mice[J].Biotechnol Appl Biochem,2005,42(1)∶9-15.
[6]Chen JP,Zhang WY,Lu TT,et al.Morphological and genetic character- ization of a cultivated Cordyceps sinensis fungus and its polysaccharide component possessing antioxidant property in H22 tumor-bearing mice[J].Life Sci,2006,78(23)∶2742-8.
[7]Givi ME,Redegeld FA,Folkerts G,et al.Dendritic cells in pathogenesis of COPD [J].Curr Pharm Des,2012,18(16)∶2329-35.
[8]Vassallo R,Tamada K,Lau JS,et al.Cigarette smoke extract suppresses human dendritic cell function leading to preferential induction of Th-2 priming[J].J Immunol,2005,175(4)∶2684-91.
[9]Sardina JL,López-Ruano G,Sánchez-Sánchez B,et al.Reactive oxygen species∶are they important for haematopoiesis[J].Crit Rev Oncol Hematol,2012,81(3)∶257-74.
[10]Gibson GE,Huang HM.Oxidative stress in Alzheimer’s disease[J].Neurobiol Aging,2005,26(5)∶575-8.
[11]Asano H,Horinouchi T,Mai Y,et al.Nicotine-and tar-free cigarette smoke induces cell damage through reactive oxygen species newly generated by PKC-dependent activation of NADPH oxidase[J].J Pharmacol Sci,2012,118(2)∶275-87.
[12]Ray G,Husain SA.Oxidants,antioxidants and carcinogenesis[J].Indian J Exp Biol,2002,40(11)∶1213-32.