LC-MS/MS 同时测定卷烟主流烟气中4 种芳香胺
余晶晶,王,谢复炜,陈玉松,赵 阁,张晓兵
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
芳香胺类化合物在烟叶和烟气中均有分布,但烟气中的含量略高。1-氨基萘、2-氨基萘、3-氨基联苯、4-氨基联苯4种芳香胺被列入Hoffmann名单中[1],且被国际癌症研究机构(IARC)列为致癌物[2]。目前,芳香胺化合物的检测方法主要有气相色谱法[3-4]、液相色谱法[5-7]、毛细管电泳法[8]、气相色谱-质谱联用(GC/MS)[9-11]、液相色谱-质谱联用(LC-MS/MS)[12-15]等。GC/MS是分析卷烟主流烟气中主要芳香胺类化合物最常用的手段,相关的国家标准GB/T 23358—2009《卷烟 主流烟气总粒相物中主要芳香胺的测定 气相色谱-质谱联用法》已发布实施。然而,由于烟气样品的基质十分复杂,4种芳香胺化合物含量极低(ng/支),采用GC/MS测定时,样品前处理需要多步液液萃取、浓缩操作,且需要衍生化反应,1次样品前处理约需2 d。LC-MS/MS因具有灵敏度高、选择性好等特点,特别适用于复杂基质中超低含量物质的定量分析,已用于不同基质中芳香胺的测定。Saha等[12]采用LC-MS/MS测定了卷烟主流烟气中的6种芳香胺,但其样品前处理采用液液萃取方式,操作繁琐费时,且未测定4-氨基联苯。因此,采用阳离子交换固相萃取柱对样品进行纯化处理,建立同时测定卷烟主流烟气中4种芳香胺的LC-MS/MS方法,可为卷烟烟气中有害成分分析及卷烟安全性评价提供技术支持。
1 材料与方法
1.1 材料、试剂和仪器
20种市售卷烟样品。其中1~15为国产烤烟型卷烟,16~18为国产混合型卷烟,19为进口烤烟型卷烟,20为进口混合型卷烟。其盒标烟气焦油、烟碱和CO量如表1所示。
1-氨基萘、2-氨基萘、3-氨基联苯、4-氨基联苯、d7-1-氨基萘、d9-4-氨基联苯(纯度≥98%,上海安谱公司);甲醇(色谱纯,美国J&T Baker公司);乙腈(色谱纯,美国Dikma公司);甲酸(色谱纯,美国Tedia公司);甲酸铵(色谱纯,美国Alfa Aesar公司);氨水(AR,美国CNW公司);盐酸(AR,洛阳市化学试剂厂)。
API5500质谱仪(美国AB SCIEX公司);Agilent 1200高效液相色谱仪(美国Agilent公司);SM450直线式吸烟机(英国Cerulean公司);Milli-Q50超纯水仪(美国Millipore公司);KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司);CP2245电子天平(感量:0.0001 g,德国Sartorius公司);Dikma ProElut PXC固相萃取柱(150 mg/6 mL,美国Dikma公司);Agilent Bond Elut Plexa PCX固相萃取柱(200 mg/6 mL,美国Agilent公司);Waters Oasis®MCX固相萃取柱(150 mg/6 mL,美国Waters公司)。
1.2 样品处理与分析
将卷烟样品放置于(22±1)℃,相对湿度为(60±2)%的环境中平衡48 h,然后挑选(平均质量±0.02)g和(平均吸阻 ±49)Pa/支的烟支作为测试烟支。采用直线式吸烟机按照ISO标准条件抽吸卷烟,即每60 s抽吸一口,每口抽吸容量35 mL,抽吸持续时间2 s。用Ø44 mm剑桥滤片捕集卷烟主流烟气总粒相物,每张滤片收集4支或5支卷烟的总粒相物,取收集20支卷烟烟气总粒相物的滤片置于200 mL锥形瓶中,准确加入100 mL 5%(质量分数)HCl和100µL氘代内标标准溶液(d7-1-氨基萘和d9-4-氨基联苯浓度分别为2µg/mL 和 0.4µg/mL),超声萃取30 min,然后用移液管准确移取50 mL萃取液,上样到Dikma ProElut PXC阳离子交换固相萃取柱[使用前用10 mL甲醇和10 mL 5%(体积分数)HCl活化],依次用10 mL水和10 mL甲醇洗涤,最后用5 mL 5%(体积分数)氨水甲醇溶液洗脱,洗脱液混匀后取样进行LC-MS/MS分析。分析条件为:
色谱柱:Waters Symmetry ShieldTMRP18(150 mm × 2.1 mm i.d.,3.5 μm);柱温:30 ℃;流动相:A:0.1%(体积分数)甲酸溶液(V/V),B:0.1%(体积分数)甲酸乙腈溶液;洗脱方式:75%A+25%B,等度洗脱;流速:200 μL/min;分析时间:15 min,进样体积10 μL。离子源:电喷雾电离源(ESI);扫描方式:正离子扫描;检测方式:多反应监测(MRM);电喷雾电压:4500 V;气帘气压力:206.8 kPa(30 psi);辅助气 1压力:482.6 kPa(70 psi);辅助气 2压力:482.6 kPa(70 psi);离子源温度:500℃;化合物的定量离子对、定性离子对、驻留时间、碰撞能量(CE)及去簇电压(DP)见表2。
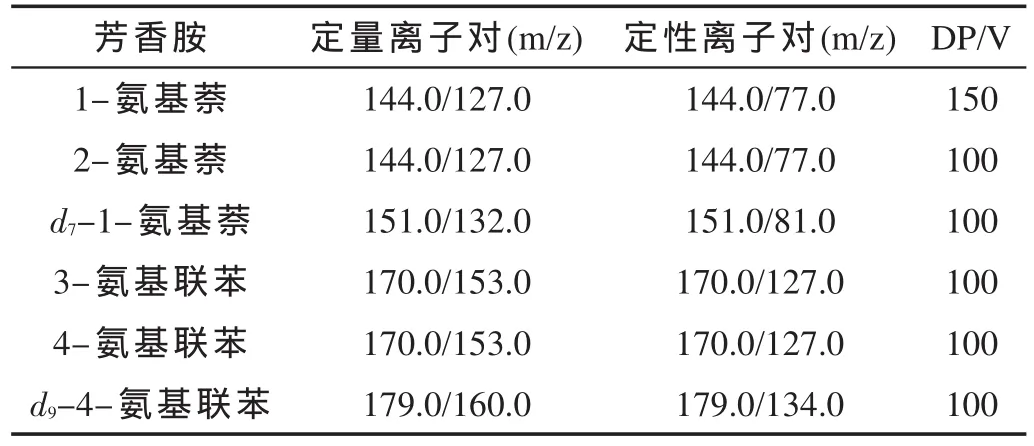
表2 各芳香胺的MRM参数①
2 结果与讨论
2.1 液相色谱条件的选择
芳香胺同分异构体结构、性质极为相似,液相色谱分离困难。为实现1-氨基萘、2-氨基萘及3-氨基联苯、4-氨基联苯的液相色谱分离,考察了Agilent Poroshell 120 EC-C18(100 mm×2.1 mm i.d.,2.7 μm)、Agilent Eclipse XDB-C18(50 mm × 2.1 mm i.d.,1.8 μm)、Waters Symmetry ShieldTMRP18(150 mm × 2.1 mm i.d.,3.5 μm)等色谱柱对4种芳香胺的分离效果,结果发现,Waters Symmetry ShieldTMRP18柱能实现4种芳香胺的同时分离,如图1所示。由图2可知,主流烟气样品中4种芳香胺峰型较好,与干扰物能较好分离,可以满足定性、定量分析要求。
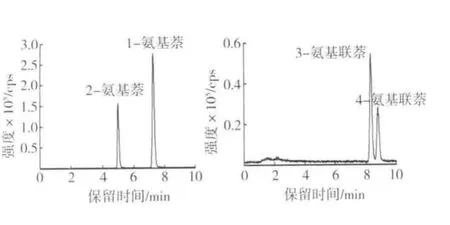
图1 4种芳香胺标样的MRM图
图2 卷烟主流烟气样品中4种芳香胺的MRM图
对流动相组成及梯度条件进行了优化。研究表明,流动相组成为75%A(0.1%甲酸溶液)+25%B(0.1%甲酸乙腈溶液),等度洗脱时,两组芳香胺同分异构体可实现基线分离,且出峰完全仅需9 min。流动相中加入一定比例的甲酸有助于芳香胺的离子化,提高质谱响应。此外,考察了色谱柱柱温对4种芳香胺质谱响应的影响,当柱温为20,30,40℃时,质谱响应无显著差异;当柱温为50℃时,质谱响应降低,噪声增大。因此,选择柱温为30℃。
2.2 烟气捕集条件的选择
采用剑桥滤片捕集卷烟主流烟气中的总粒相物;采用2个装有50 mL 5%HCl溶液的吸收瓶串联捕集气相物。分别采用固相萃取柱净化处理后进LC-MS/MS分析,结果表明,两个吸收瓶溶液中均未检出4种芳香胺,可见主流烟气中的4种芳香胺主要分布在总粒相物中。因此,用剑桥滤片捕集主流烟气中的4种芳香胺。
2.3 剑桥滤片萃取条件的优化
采用5%HCl溶液萃取剑桥滤片,考察了超声和振荡萃取2种不同的方式。研究发现,采用振荡萃取时,剑桥滤片容易破碎,在固相萃取过程中,滤片碎末容易堵塞上样管。另外,振荡萃取30 min与超声萃取30 min所测得的4种芳香胺含量接近。因此,实验中选择超声萃取。同时,考察了超声萃取时间的影响,30 min最佳。
2.4 固相萃取条件的确定
芳香胺类化合物为碱性化合物,阳离子交换固相萃取柱对碱性化合物具有高的选择性和灵敏度,适合复杂基质中目标物的除杂和纯化。实验考察了Dikma ProElut PXC,Agilent Bond Elut Plexa PCX和 Waters Oasis®MCX 3种不同厂家生产的阳离子交换固相萃取柱,实验结果表明,采用不同固相萃取柱所测得的结果无明显差异。由于采用Dikma固相萃取柱处理时所需时间最短,故实验中选其进行样品前处理。
烟气样品十分复杂,基质干扰往往会掩盖低浓度目标物的信息。在5%HCl溶液中加入一定量的标样作为模拟样品,以更准确地反映目标分析物在固相萃取过程中的保留及洗脱情况。首先考察固相萃取过程中目标物的保留情况,分别收集上样、淋洗和洗脱等步骤的流出液,LC-MS/MS分析结果表明,流出液中均未检出这4种芳香胺,由此可知在上样和净化过程中4种芳香胺几乎都保留在固相萃取小柱上。为将固相萃取柱上保留的目标分析物完全洗脱下来,考察了洗脱液组成的影响。图3为不同组成的洗脱液洗脱固相萃取柱时,目标分析物被洗脱的比例,由图3可知,采用5%氨水+95%甲醇溶液才能将目标分析物完全洗脱。因此,选择含5%氨水的甲醇作为洗脱溶液。同时,考察了洗脱液体积的影响,同样采用模拟样品进行实验。增大洗脱体积能够保证把目标物尽可能全部洗脱出来,但目标物的浓度也会随着体积增大而降低。实验中分别采用5,10,15,20,25 mL洗脱液进行洗脱。图4为采用不同体积洗脱液洗脱后,4种芳香胺与其相应内标物质谱响应面积比(A/As)。由图4可知,采用5 mL洗脱液洗脱时,即能将待测目标物完全洗脱。因此,选择5 mL洗脱液进行洗脱。
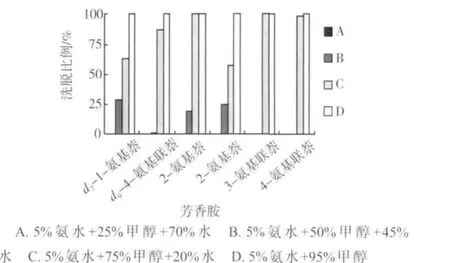
图3 洗脱液组成对芳香胺净化效果的影响
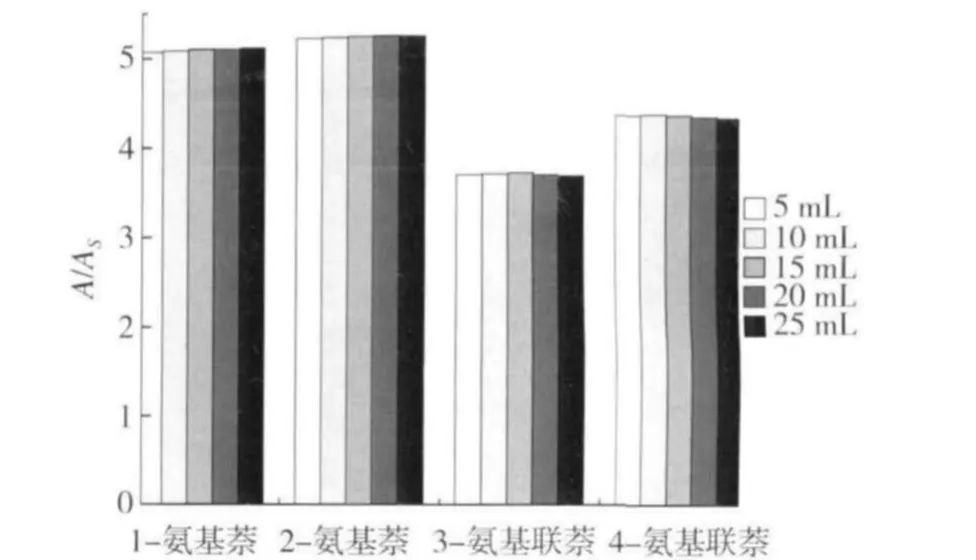
图4 洗脱液体积对芳香胺净化效果的的影响
2.5 工作曲线与检测限
标准储备液配制。准确称取100 mg 1-氨基萘、50 mg 2-氨基萘、20 mg 3-氨基联苯和10 mg 4-氨基联苯,分别置于100 mL棕色容量瓶中,用甲醇定容,则1-氨基萘、2-氨基萘、3-氨基联苯和4-氨基联苯标准储备液的浓度分别为1.0,0.5,0.2和0.1 mg/mL。该标准储备溶液于-18℃下避光保存,有效期为3个月。一级混合标准溶液配制:分别移取1-氨基萘、2-氨基萘、3-氨基联苯和4-氨基联苯的标准储备液1.0 mL至100 mL容量瓶中,用甲醇定容,4种芳香胺的浓度分别为10.0,5.0,2.0和1.0 μg/mL。二级混合标准溶液配制:移取10.0 mL一级混合标准溶液至100 mL容量瓶中,用甲醇定容,4种芳香胺的浓度分别为1.0,0.5,0.2和0.1 μg/mL。
内标储备液配制。准确称取100 mg d7-1-氨基萘和20 mg d9-4-氨基联苯,分别置于不同的100 mL棕色容量瓶中,用甲醇定容,得浓度为1.0和0.2 mg/mL的内标储备液。该内标储备溶液于-18℃下避光保存,有效期为3个月。一级混合内标溶液配制:分别移取d7-1-氨基萘、d9-4-氨基联苯储备液1.0 mL置于100 mL容量瓶中,用甲醇定容,浓度分别为10.0和2.0 μg/mL。二级混合内标溶液配制:移取10.0 mL一级混合内标溶液至50 mL容量瓶中,用甲醇定容,浓度分别为2.0和0.4 μg/mL。
标准工作溶液配制。分别移取0.1,0.2,0.5,1.0,2.0,5.0和10 mL二级混合标准溶液置于不同的100 mL容量瓶中,再分别准确加入1.0 mL二级混合内标溶液,用5%氨水甲醇溶液定容,即得表3所示的7级标准工作溶液,d7-1-氨基萘和d9-4-氨基联苯浓度分别为20.0和4.0 ng/mL。
分别对标准工作溶液进行LC-MS/MS分析,并以芳香胺与内标物峰面积比(Y)对其浓度比(X)进行线性回归,得到各目标化合物的标准工作曲线,见表4。其中,1-氨基萘、2-氨基萘内标为d7-1-氨基萘;3-氨基联苯、4-氨基联苯内标为d9-4-氨基联苯。
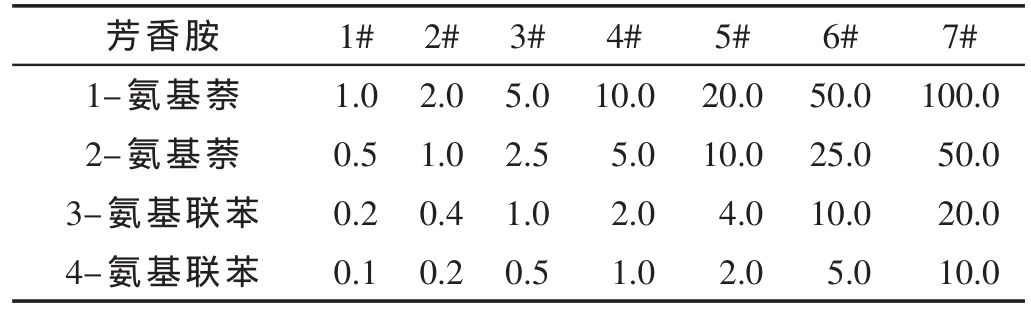
表3 4种芳香胺的系列标准工作溶液 (ng/mL)
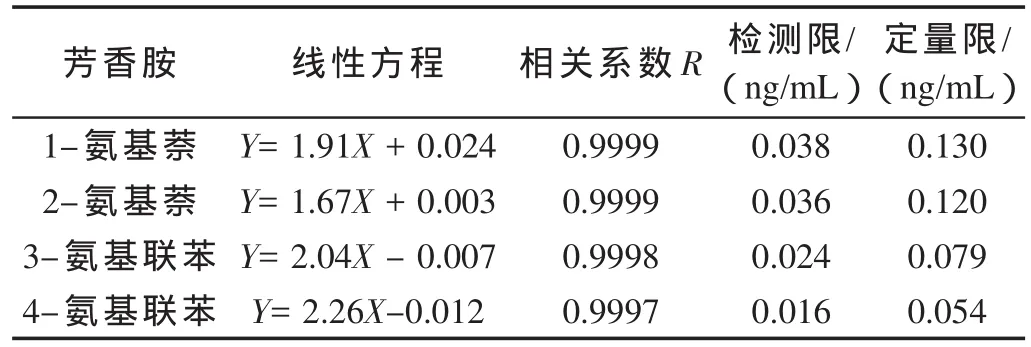
表4 4种芳香胺的线性方程、相关系数、检测限及定量限
取最低浓度的标准工作溶液,平行测定10次,计算其标准偏差,以3倍标准偏差为检测限,10倍标准偏差为定量限,结果如表4所示。1-氨基萘、2-氨基萘、3-氨基联苯、4-氨基联苯的检测限分别相当于0.019,0.018,0.012和0.008 ng/支,定量限分别相当于0.065,0.060,0.039和0.027 ng/支。
2.6 回收率与精密度
取烤烟型和混合型卷烟样品各1种,平行测定3次,并在高、中、低3个水平上进行加标回收率测定,结果(表5)表明,方法的加标回收率范围分别在72.1%~104.6%,70.5%~104.5%,83.1%~104.4%和86.6%~116.5%之间。4种芳香胺的日内精密度<6%,日间精密度<9%,可知日内及日间精密度较好。为考察样品的稳定性,将前处理后的样品密闭于2 mL色谱样品瓶中,同一天连续进样5次,4种芳香胺变异系数分别为1.34%,2.05%,1.89%和4.06%。分别在前处理当天和第3,5,7 d进样分析,4种芳香胺变异系数分别为3.22%,8.12%,5.45%和9.09%,表明4种芳香胺在一周内稳定性良好。
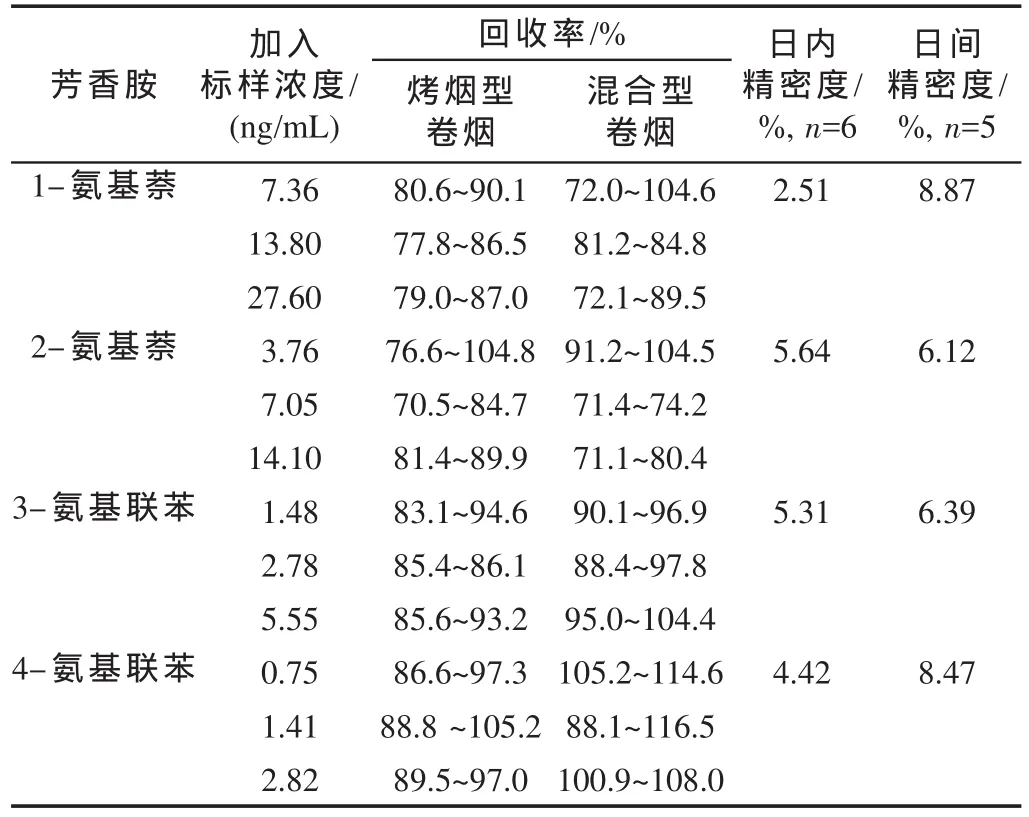
表5 4种芳香胺的加标回收率、日内及日间精密度
2.7 样品分析及与GC/MS测定结果比较
选择国内外不同焦油量的烤烟及混合型卷烟20种,采用本方法及GB/T 23358—2009中的GC/MS方法分别对卷烟样品主流烟气中的4种芳香胺进行测定,结果如表6所示。采用本方法所测得20种卷烟主流烟气中1-氨基萘、2-氨基萘、3-氨基联苯、4-氨基联苯的含量 范 围 分 别 为 5.18~20.88,2.17~7.78,0.66~1.92,0.39~1.46 ng/支,平均值分别为 11.80,3.87,1.05,0.75 ng/支。与GC/MS测定结果进行比较,以本方法结果对GC/MS结果作线性回归曲线,1-氨基萘、2-氨基萘、3-氨基联苯及4-氨基联苯的线性相关系数R分别为0.91,0.77,0.86和0.87。可见,两种分析方法的结果相关性较好。
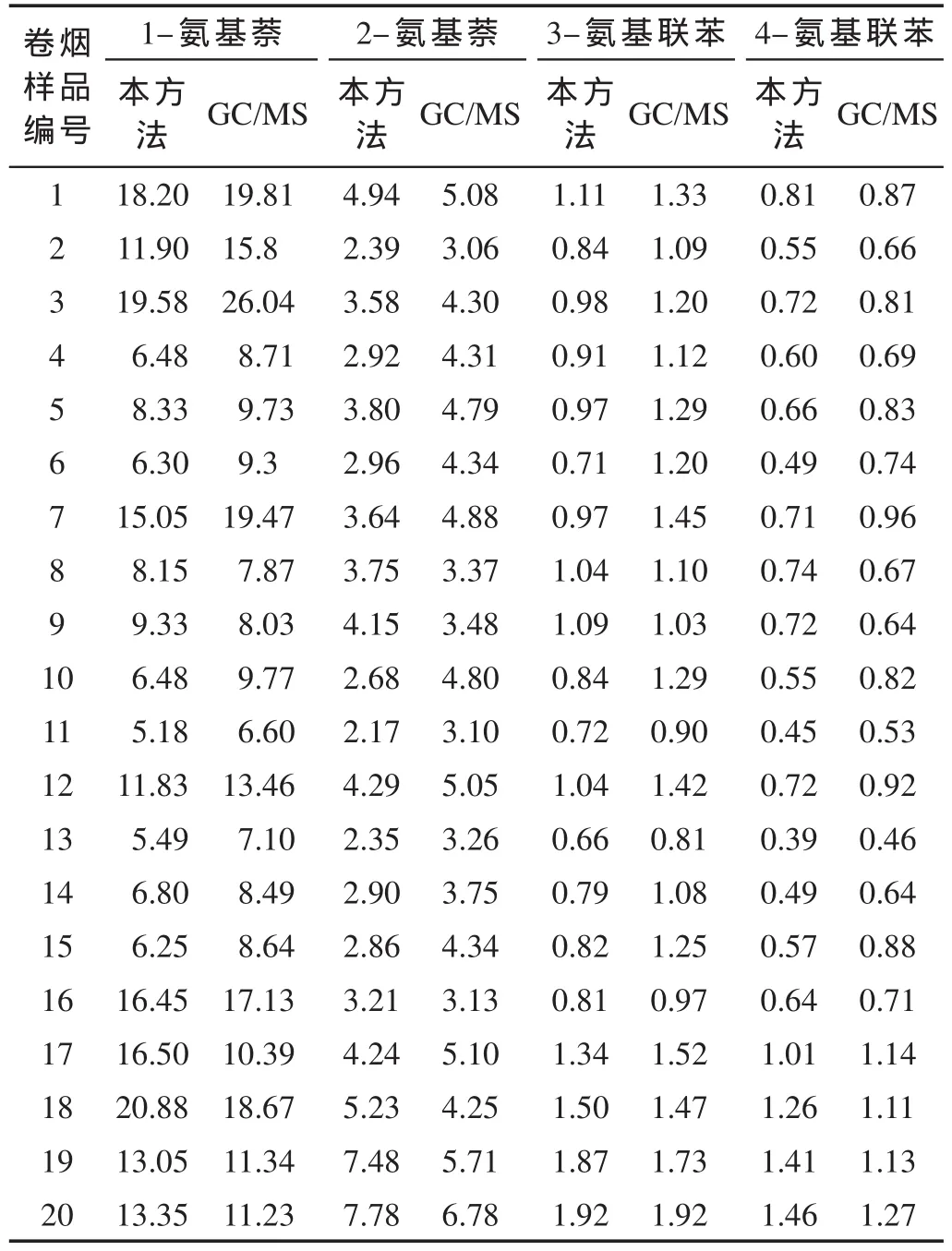
表6 采用本方法与GC/MS测定的20种卷烟主流烟气中4种芳香胺的含量 (ng/支)
3 结论
建立了检测卷烟主流烟气中4种主要芳香胺的LC-MS/MS方法。本方法采用Dikma ProElut PXC阳离子交换固相萃取柱净化样品,省去了衍生化操作,整个样品前处理过程不超过1.5 h;通过对液相色谱条件的优化,实现了1-氨基萘、2-氨基萘、3-氨基联苯和4-氨基联苯两组同分异构体的同时检测。采用本方法及GC/MS对国内外20种不同焦油量卷烟样品进行了分析比较,两种方法的测定结果相关性良好。本方法适合于卷烟主流烟气中4种芳香胺的快速、灵敏测定。
[1]Hoffmann D,Hoffmann I,El-Bayoumy K.The less harmful cigarette:A controversial issue.A tribute to Ernst L.Wynder[J].ChemicalResearch inToxicology,2001,14(7):767-790.
[2]IARC.IARC Monographs on the evaluation of carcinogenic risks to Humans:A review of human carcinogens[M].Lyon:International Agency for Research on Cancer ,2010,100:1-8.
[3]Masuda Y,Hoffmann D,Determination of 1-naphthylamine and 2-naphthylamine in cigarette smoke[J].Analytical Chemistry,1969,41(4):650-652.
[4]Hoffmann D,Masuda Y,Wynder E L.α-Naphthylamine and β-naphthylamine in cigarette smoke[J].Nature,1969,221:254-256.
[5]Zeng Z R,Qiu W L,Yang M,et al. Solid-phase microextraction of monocyclic aromatic amines using novel fibers coated with crown ether[J].Journal of Chromatography A,2001,934(1-2):51-57.
[6]Sarafraz-Yazdi A,Mofazzeli F,Eshaghi Z.A new high-speed hollow fiber based liquid phase microextraction method using volatile organic solvent for determination of aromatic amines in environmental water samples prior to high-performance liquid chromatography[J].Talanta,2009,79(2):472-478.
[7]Sandeep-Kumar M,Devasish B,Abhilasha D,et al.Determination of some banned aromatic amines in waste water using micellar liquid chromatography[J].Analytical Methods,2011,3(9):2032-2040.
[8]王晓瑜,陈义.芳香胺的碱坝聚焦-毛细管电泳分析[J].高等学校化学学报,2010,31(8):1506-1509.
[9]Stabbert R,Schäfer K H,Biefel C,et al. Analysis of aromatic amines in cigarette smoke[J].Rapid Communications in Mass Spectrometry,2003,17(18):2125-2132.
[10]Brede C,Skjevrak I,Herikstad H.Determination of primary aromatic amines in water food stimulant using solid-phase analyticalderivatization followed by gaschromatography coupled with mass spectrometry[J].Journal of Chromatography A,2003,983(1-2):35-42.
[11]Smith C J,Dooly G L,Moldoveanu S C.New technique using solid-phase extraction forthe analysis ofaromatic amines in mainstream cigarette smoke[J].Journal of Chromatography A,2003,991(1):99-107.
[12]Saha S,Mistri R,Ray B C.Rapid and sensitive method for simultaneous determination ofsix carcinogenic aromatic amines in mainstream cigarette smoke by liquid chromatography/electrospray ionization tandem mass spectrometry[J].Journal of Chromatography A,2009,1216(15):3059-3063.
[13]Aznar M,Canellas E,Nerín C.Quantitative determination of 22 primary aromatic amines by cation-exchange solid-phase extraction and liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2009,1216(27):5176-5181.
[14]Mortensen S K,Trier X T,Foverskov A,Petersen J H,Specific determination of 20 primary aromatic amines in aqueous food simulants by liquid chromatography-electrospray ionization-tandem mass spectrometry [J]. Journal of Chromatography A,2005,1091(1-2):40-50.
[15]MoriwakiH,HarinoaH,HashimotobH,etal.Determination of aromatic amine mutagens,PBTA-1 and PBTA-2,in river water by solid-phase extraction followed by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2003,995(1-2):239-243.

