共轭酸碱对缓冲能力大小影响因素实验初探
陈鲜丽 郑锋华
(1韶关学院医学院 广东韶关 512026;2广西师范大学化学化工学院 广西桂林 541004)
在文献[1]中有一道这样的题目:下列缓冲溶液缓冲容量最大的是?
(1) 20mL 0.1mol/L HAc-20mL 0.1mol/L NaAc混合
(2) 20mL 0.4mol/L HAc-20mL 0.2mol/L NaAc混合
(3) 15mL 0.1mol/L HAc-25mL 0.1mol/L NaAc混合
在文献[1-3]中说影响缓冲容量的因素有两个:① 总浓度:对于同一缓冲溶液,当缓冲比一定时,总浓度越大,缓冲容量越大。② 缓冲比:对于同一缓冲对,总浓度一定时,缓冲容量随着缓冲比的改变而改变,当缓冲比为1时,缓冲溶液具有最大缓冲容量。
上述3种缓冲溶液的总浓度分别是0.1mol/L、0.3mol/L、0.1mol/L;它们的缓冲比分别是1、1/2、5/3。如果比较缓冲溶液(1)和(3),它们的总浓度一定,缓冲溶液(1)的缓冲比为1,所以得出结论,缓冲溶液(1)的缓冲能力比缓冲溶液(3)要大,但是这样的结论是不恰当的;而要让学生比较缓冲溶液(2)的缓冲容量大小,就更是无能为力了。
为了正确解答上述题目,并对β的影响因素作进一步的探讨,笔者做了以下实验。
1 实验部分1.1 仪器与试剂
仪器:上海精密科学仪器有限公司ZD-2自动电位滴定仪,上海精密科学仪器有限公司雷磁E-201-CpH复合电极,雷磁JB-1A搅拌器。
试剂:0.1mol/L NH3·H2O,0.1mol/L NH4Cl,0.1mol/L Na2HPO4,0.1mol/L KH2PO4,0.1mol/L HAc,0.1mol/L NaAc,0.5mol/L NaOH,0.5mol/L HCl,0.05mol/L邻苯二甲酸氢钾标准缓冲溶液,0.025mol/L混合磷酸盐标准缓冲溶液,0.01mol/L硼砂标准缓冲溶液。
1.2 滴定过程
一般情况下,缓冲溶液的总浓度控制在0.05~0.20mol/L之间,因此本文选择共轭酸碱的浓度均为0.1mol/L,按照表1配制成缓冲溶液。考虑到稀释效应的影响[4],分别用0.5mol/L NaOH溶液和0.5mol/L HCl溶液滴定,记录pH和滴定液的体积V,由β=n/(V︱ΔpH︱)(n为外加的一元强酸或强碱的物质的量,V为缓冲溶液的体积,ΔpH为缓冲溶液pH的变化量)计算出缓冲容量β,做出β-V图。
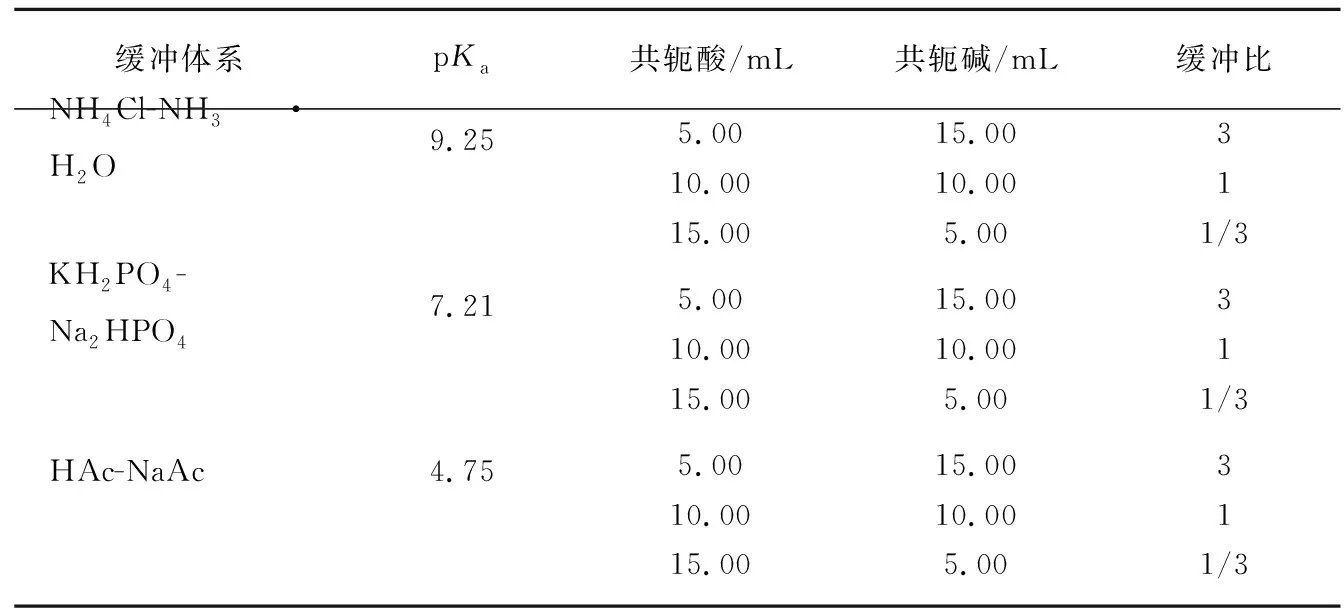
表1 缓冲溶液的配制
2 结果与讨论2.1 同一缓冲体系不同缓冲比的抗酸抗碱能力对比
由图1~6可知,对同一个缓冲体系进行比较,缓冲比为3时,缓冲溶液的抗酸能力是最强的,抗碱能力是最弱的;缓冲比为1/3时,缓冲溶液的抗酸能力是最弱的,抗碱能力是最强的;缓冲比为1的体系,抗酸能力和抗碱能力都不是最强的,而是居于中等。因此在描述缓冲容量时,必须说明是抗酸能力还是抗碱能力,而不是笼统地说缓冲容量。
每个滴定实验重复了3次,实验的重现性良好。
为什么实验结果是这样的呢?原因在于:抗酸能力的大小取决于抗酸成分即共轭碱的浓度大小,抗碱能力的大小取决于抗碱成分即共轭酸的浓度大小。缓冲比为3,缓冲溶液的抗酸成分即共轭碱的浓度是最大的,抗碱成分即共轭酸的浓度是最小的;缓冲比为1/3,则刚好相反;缓冲比为1时,它的共轭碱和共轭酸浓度都不是最大的,因此它的抗酸能力和抗碱能力都居于中等。
2.2 3个缓冲体系缓冲比为1的抗酸抗碱能力对比
尽管缓冲比为1的缓冲溶液的抗酸和抗碱能力都不是最大的,但是它们的抗酸和抗碱能力却都是比较大的。所以在选择缓冲溶液时可以选择合适的pKa的缓冲对,然后选择缓冲比接近1的缓冲溶液。下面比较不同缓冲体系缓冲比为1时的抗酸抗碱能力(图7)。
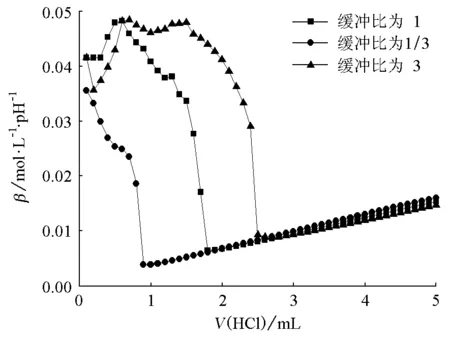
图1 NH4Cl-NH3·H2O缓冲体系抗酸能力对比
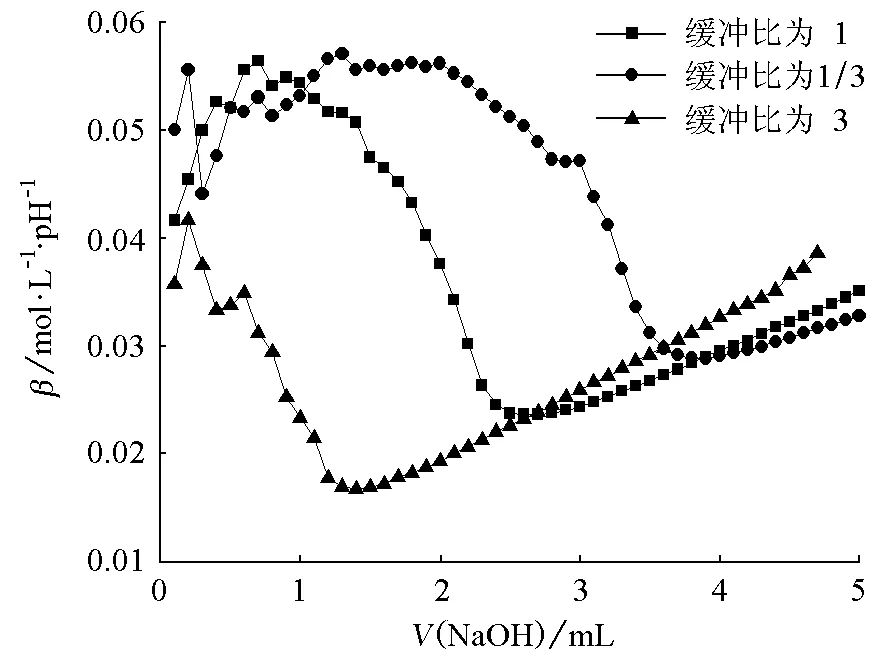
图2 NH4Cl-NH3·H2O缓冲体系抗碱能力对比
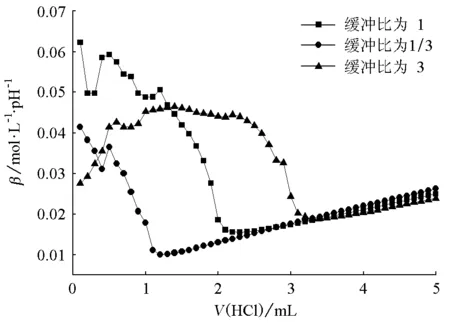
图3 KH2PO4-Na2HPO4缓冲体系抗酸能力对比
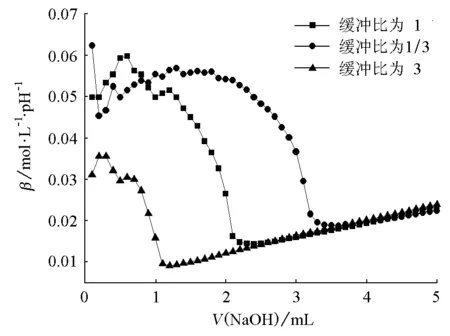
图4 KH2PO4-Na2HPO4缓冲体系抗碱能力对比
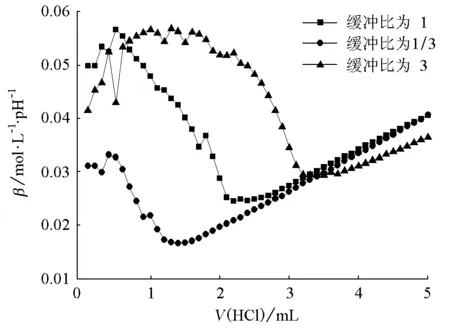
图5 HAc-NaAc缓冲体系抗酸能力对比
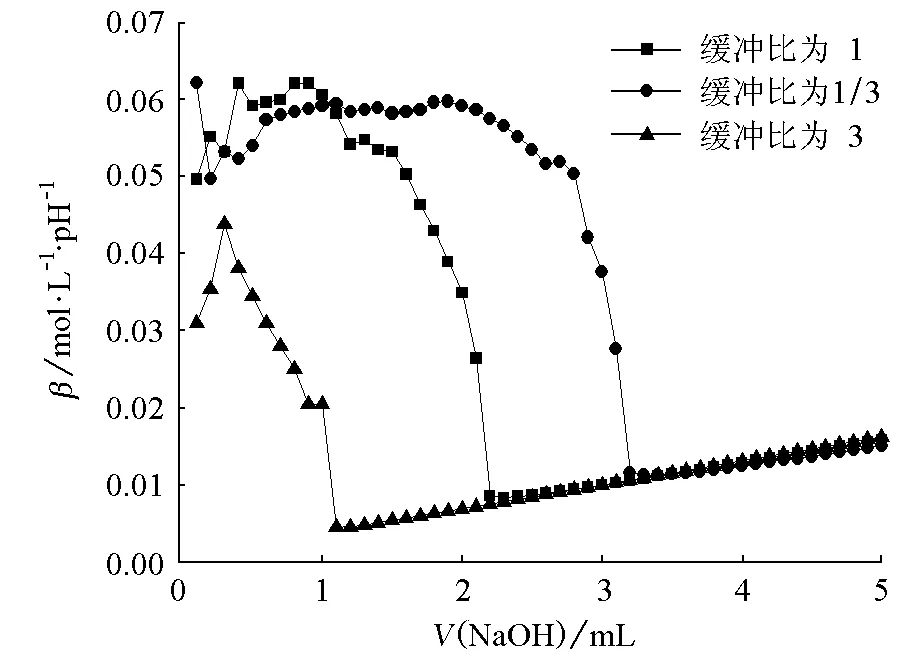
图6 HAc-NaAc缓冲体系抗碱能力对比
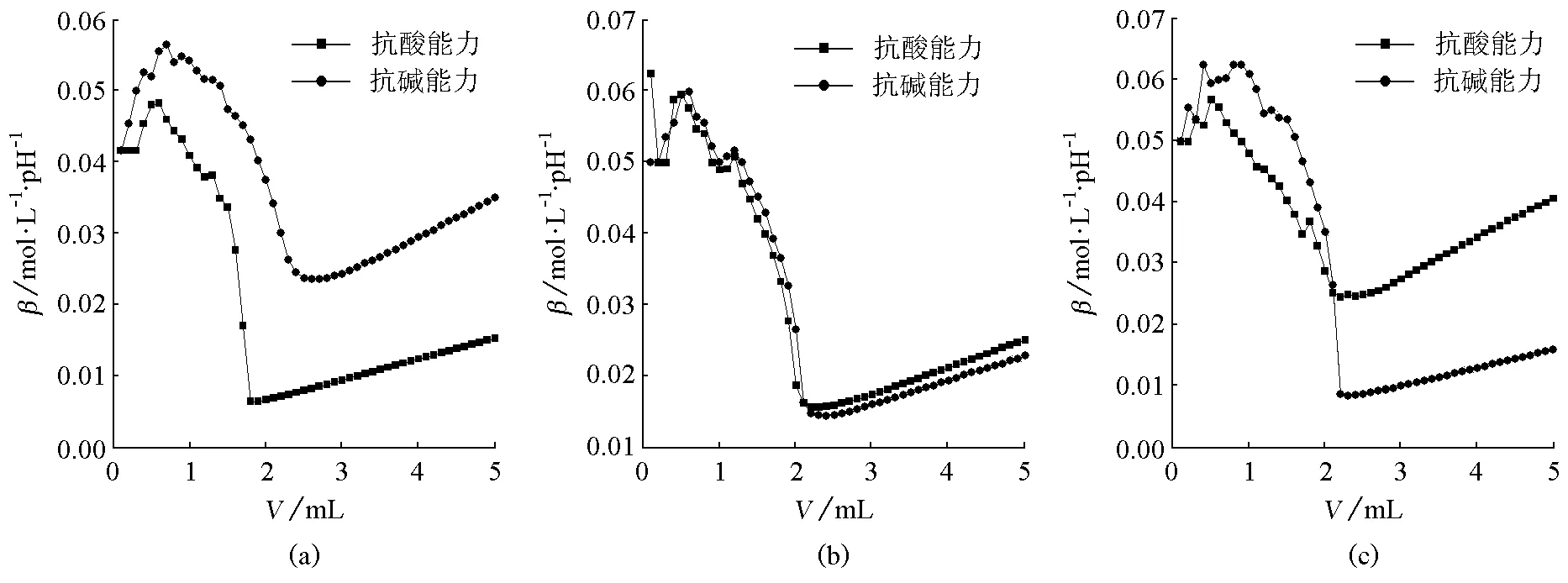
图7 3种缓冲体系缓冲比为1的抗酸抗碱能力对比(a) NH4Cl-NH3·H2O缓冲体系;(b) KH2PO4-Na2HPO4缓冲体系;(c) HAc-NaAc缓冲体系
由图7(a)可看出,NH4Cl-NH3·H2O缓冲体系的pKa=9.25,是碱性缓冲体系,缓冲比为1时,前段的抗碱能力比抗酸能力强;由图7(b)可看出,KH2PO4-Na2HPO4缓冲体系的pKa接近7,是中性缓冲体系,缓冲比为1时,抗酸能力与抗碱能力相当;由图7(c)可看出,HAc-NaAc缓冲体系的pKa=4.75,是酸性缓冲体系,缓冲比为1时,前段的抗碱能力比抗酸能力强。
每个滴定实验重复3次,实验的重现性良好。
总的来说,同一缓冲体系,当缓冲比为1时,碱性溶液、中性溶液、酸性溶液的抗碱能力与抗酸能力没有明显规律。并不像文献[4]所说,“酸性缓冲溶液和碱性缓冲溶液的抗酸能力不同,一般来说,酸性缓冲溶液的抗酸能力较强”。
2.3 β-V图变化趋势的解读
当外加的强酸或强碱比较少时,所有缓冲体系中的抗酸成分和抗碱成分的浓度都比较大,β先有一个比较大的值,但随着外加的强酸或强碱的量增加时,β都会经过一个急剧下降的过程,因为缓冲溶液的缓冲能力到了最大值后,就要下降。选择缓冲溶液时,应该选择β比较大的范围。
3 题目的解答
抗酸能力的大小取决于抗酸成分即共轭碱的浓度大小,抗碱能力的大小取决于抗碱成分即共轭酸的浓度大小。依据上述结论可以很顺利地解出本文开头的题目。缓冲溶液(1)和缓冲溶液(3)的总浓度相同,它们的缓冲比分别为1和5/3,前者的抗碱能力比后者强,而抗酸能力则比后者弱;缓冲溶液(2)的总浓度和缓冲比与(1)、(3)不一样,要比较出抗酸能力和抗碱能力只能分别比较NaAc和HAc的浓度。表2列出了3种缓冲溶液NaAc和HAc的浓度。

表2 3种缓冲溶液的NaAc和HAc的浓度
从表2中可以看出,抗酸能力的强弱顺序是:缓冲溶液(2)>缓冲溶液(3)>缓冲溶液(1),抗碱能力的强弱顺序是:缓冲溶液(2)>缓冲溶液(1)>缓冲溶液(3)。
4 本文结论对缓冲溶液选择的意义
缓冲比大的缓冲溶液的抗酸能力强,但是抗碱能力弱,缓冲比小的缓冲溶液的抗酸能力弱,但是抗碱能力强。这有点类似于“短板效应”:盛水的木桶是由许多块木板箍成的,盛水量也是由这些木板共同决定的。若其中一块木板很短,这块短板就成了这个木桶盛水量的“限制因素”。而选择缓冲溶液时,一般希望抗酸能力和抗碱能力都比较强。
尽管缓冲比为1的缓冲溶液的抗酸和抗碱能力都不是最大的,但是它们的抗酸和抗碱能力却都是比较大的。所以综合考虑的话,在选择缓冲溶液时通常是选择有合适的pKa的缓冲对,然后配制成缓冲比接近1的缓冲溶液。但是如果有所侧重,比如在配位滴定中,因为M+H2Y=MY+2H+,侧重抗酸能力的话,可以选择缓冲比大、共轭碱浓度大的缓冲溶液。
参 考 文 献
[1] 陈常兴,秦子平,许新.医学化学.第6版.北京:人民卫生出版社,2009
[2] 孙毓庆,胡育筑.分析化学.第2版.北京:科学出版社,2006
[3] 华中师范大学,东北师范大学,陕西师范大学.分析化学.北京:高等教育出版社,2001
[4] 王克强,冯瑞英.化学通报,1990(11):52

