荧光探针法快速检测果汁中罗丹明B残留量
梁 宇,黄世江,王超海,程定玺,*
(1.河南师范大学化学与环境科学学院,河南 新乡 453007;2.新乡学院化学与化工学院,河南 新乡 453003)
荧光探针法快速检测果汁中罗丹明B残留量
梁 宇1,2,黄世江1,王超海2,程定玺1,*
(1.河南师范大学化学与环境科学学院,河南 新乡 453007;2.新乡学院化学与化工学院,河南 新乡 453003)
建立以伊红Y为荧光探针测定罗丹明B残留量的荧光光谱法。在pH6.8的Sфrensen缓冲溶液中,一定浓度的阳离子表面活性剂溴化十六烷基三甲基铵(CTMAB)能使阴离子染料伊红Y的荧光强度显著增强,当加入一定量的罗丹明B后其荧光发生猝灭,且猝灭程度在一定范围内与加入的罗丹明B浓度呈正比。通过改变单因素,优化实验条件,获得的线性范围为0~0.9mg/L,检出限为0.0016mg/L,回收率为101.3%~113.7%,相对标准偏差为2.76%~4.98%。该方法具有简便快捷、选择性好、灵敏度高等优点,适用于果汁饮料制品中罗丹明B的检测。
荧光探针;伊红Y;罗丹明B;残留
罗丹明B(rhodamine B,RhB)是一种人工合成染料,常用做荧光分析试剂[1]。有研究表明:罗丹明B能引起皮下组织生瘤,具有致癌性[2]。根据国际癌症研究署(IARC)化学品致癌风险评价表明:摄取、吸入以及皮肤接触该物质均会造成急性和慢性的中毒伤害[3]。早在20世纪末,欧美、日本等国家和地区就己明令禁止将罗丹明B用于食品加工中,我国也将其列入《食品中可能违法添加的非食用物质名单(第一批)》进行重点监管。但由于罗丹明B具有价格低廉、着色稳定、色泽鲜艳等特点,将其添加到食品中的违法事件仍时有发生,严重危害人们的饮食安全。
然而目前对食品中罗丹明B的检测仍没有国家标准,现行的行业标准[4]和现有的检验方法主要是色谱法[5-9]和酶联免疫法[10-11],这些方法分析仪器昂贵,样品前处理繁琐,检测耗时。罗丹明B本身虽具有很强的荧光,但在本实验测量范围内其荧光强度较低,而且在处理样品时有机溶剂对罗丹明B的荧光强度影响很大。本研究探究并建立用荧光探针快速检测罗丹明B的荧光光谱法,快速测定果汁中罗丹明B残留量,可为国家标准的建立和测定提供参考依据。
1 材料与方法
1.1 材料与试剂
果汁饮料 市售。
罗丹明B(分析纯) 天津市化学试剂一厂;伊红Y(EY)(分析纯) 上海化学试剂总厂;溴化十六烷基三甲基铵(CTMAB)(分析纯) 上海试剂一厂;甲醇、乙醇、丙酮和乙睛(均为分析纯) 北京化工厂。
1.2 仪器与设备
HC-2064高速冷冻离心机 上海金鹏分析仪器有限公司;FP-6500型荧光光谱仪 日本Jasco公司;KQ-218超声波清洗器 昆山市超声仪器有限公司;RE-2000旋转蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 样品处理方法
[12]方法:准确移取1.0mL果汁于50mL具塞离心管中,加入25mL 20%的甲醇溶液后超声振荡30min,然后以8000r/min的速度离心10min。取部分上清液于10rnL容量瓶中,并用水定容,即得到待测样品溶液,备用。
1.3.2 实验方法
在一系列10mL容量瓶中依次加入1.0mL浓度为1.0×10-4mol/L的伊红Y溶液,0.8mL pH值为6.8的Sфrensen缓冲溶液,0.8mL浓度为1.0×10-2mol/L的CTMAB和10mg/L罗丹明B溶液,振荡使其充分反应,静置15min后,用波长为531nm的激发光激发,测定其在547nm波长处的发射光强度I,同时在相同条件下测定空白对照液的荧光强度I0。
2 结果与分析
2.1 荧光光谱
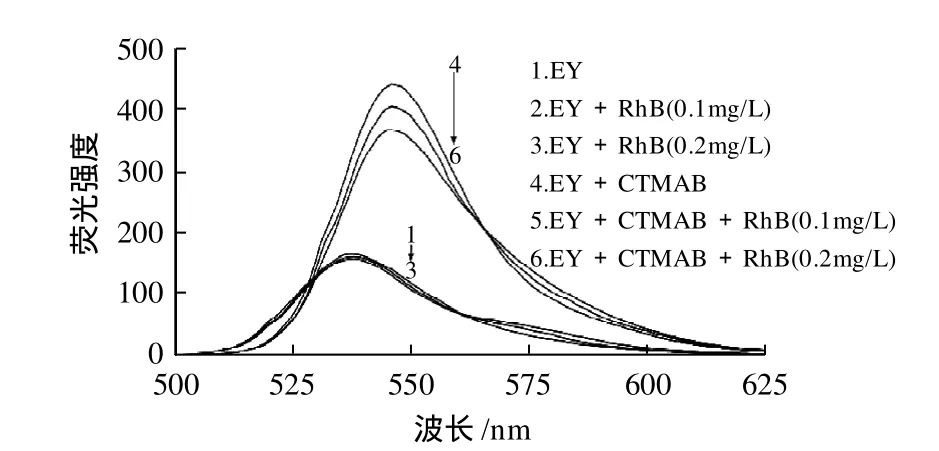
图1 荧光光谱Fig.1 Fluorescence spectra
如图1所示,在pH值为6.8的Sфrensen缓冲溶液中,EY的最大激发和发射波长分别为520nm和538nm(曲线1),当向其中加入一定量的罗丹明B后,其荧光强度随着罗丹明B浓度的增大而略有降低(曲线2、3)。相同条件下,当向EY中加入一定浓度的CTMAB后,溶液的颜色由粉红色变成桃红色,体系的最大激发和发射波长分别红移至531nm和547nm,且荧光强度明显增强(曲线4);当再向其中加入一定量的罗丹明B后,体系的荧光强度降低(曲线5、6),且降低的程度与加入罗丹明B的量在一定范围内呈良好的线性关系,因此该体系可用于罗丹明B残留量的测定。
实验机理可能是:表面活性剂CTMAB浓度达到一定浓度后,形成胶束,对EY有增敏效应,使其荧光强度显著增强。因为EY与罗丹明B之间的作用力大于EY与CTMAB之间的作用力,所以当向EY-CTMAB体系中加入罗丹明B后,罗丹明B替代了CTMAB的位置。又由于罗丹明B对EY的荧光增敏效应小于CTMAB的胶束增敏效应,所以体系的总体荧光强度随罗丹明B浓度的增加而呈下降趋势。
2.2 条件优化实验
2.2.1 反应体系的选择
分别选取阳离子型、阴离子型和非离子型表面活性剂各两种,与EY形成EY-CTMAB、EY-CPB、EYSDBS、EY-SDS、EY-OP和EY-Tween-80等体系进行对比实验。结果表明:以EY-CTMAB体系进行测定时,ΔI值最大(ΔI=I0-I,I0和I分别为未加入和加入罗丹明B时体系的荧光值),灵敏度最高且体系最稳定,故本实验选取EY-CTMAB体系。
2.2.2 缓冲溶液及酸度的选择
已知EY在近中性和微碱性环境中发强荧光,因此选取pH值为7.0的Kolthoff、Sφrensen、Michaelis、Britton-Robinson、Clark-Lubs等几种缓冲溶液进行实验,结果表明:在Sфrensen缓冲溶液中得到的ΔI值最大,因此本实验选取Sфrensen缓冲溶液。接着使用pH值为5.0~10.0的系列Sфrensen缓冲溶液进行实验,结果表明:当pH≤7.0时,体系的荧光强度随着pH值的增大逐渐增强,体系的灵敏度也逐渐升高;当pH 7.0~9.0时,体系的荧光强度基本稳定;当pH≥9.0时,体系的荧光强度随着pH值的增大而迅速降低。当pH≥7.0时,体系的灵敏度先略有降低后保持稳定。当pH6.8时,体系的荧光强度和灵敏度均达到最大,且此时获得的线性关系良好。因此本实验选取缓冲溶液的pH值为6.8。
2.2.3 最佳EY浓度的选择
在一定范围内,体系的荧光强度随着EY浓度的增加而逐渐增强,并且体系的灵敏度ΔI值随EY浓度的增大增加到最大后趋于稳定。当EY浓度达到1.0×10-5mol/L时,体系的荧光强度达到最大,灵敏度最大且稳定,并且此时体系具有很好的线性关系,所以本实验选取1.0×10-5mol/L为EY的最佳浓度。
2.2.4 最佳CTMAB浓度的选择
在一定浓度范围内,体系的荧光强度随着CTMAB浓度的增加迅速增大到最大值后保持稳定,灵敏度先迅速升高后又略微降低。当CTMAB的浓度为8.0×10-4mol/L时,体系的灵敏度ΔI有最大值,且此时体系的荧光强度较高,因此本体系选择8.0×10-4mol/L为CTMAB的最佳浓度。
2.2.5 缓冲溶液用量的选择
随着缓冲溶液用量的增加,体系的荧光强度逐渐增加到最大后保持不变,而灵敏度随着缓冲溶液用量的增加却有所降低。当缓冲溶液用量为0.8mL时,体系的灵敏度最高且体系的荧光强度有最大值。本实验最终选定0.8mL为缓冲溶液最合适用量。
2.2.6 试剂加入顺序的选择
按照排列组合原理,本实验考察4种不同试剂共24种不同加入顺序对体系荧光强度的影响。当加入顺序为EY→CTMAB→Sфrensen→罗丹明B和EY→Sфrensen→CTMAB→罗丹明B时,体系的灵敏度ΔI较大,荧光强度较强,本实验选择的加入顺序为:EY→CTMAB→Sфrensen→罗丹明B。
2.2.7 反应温度和时间的影响
随着温度的升高,体系的荧光强度逐渐降低,体系的灵敏度也略有降低,因此实验应在较低温度下进行。体系在反应15min后达到稳定且在2h内荧光强度减幅在5%以内。本实验选取在室温20℃条件下反应15min后进行测定。
2.2.8 离子强度的影响
通过加入0.1mol/L的NaCl溶液来考察离子强度对体系的影响。离子强度对体系的影响很小,随着NaCl加入量的增加,体系的荧光强度略有增强,而灵敏度却稍有降低。因此本实验在测定时选择不加入NaCl溶液,不改变溶液的离子强度。
2.2.9 有机溶剂的影响
通过向体系中添加甲醇、乙醇、丙酮和乙腈等几种常见有机溶剂,来考察处理样品时带入的有机溶剂对测定结果的影响。随着甲醇含量的增加,体系的荧光强度逐渐降低。随着乙醇和乙腈含量的增加,体系的荧光强度均略有增强。当丙酮含量小于7%时,体系的荧光强度基本不变;当丙酮含量大于7%时,随着丙酮含量的增加体系的荧光强度迅速降低。但是随着4种有机溶剂含量的增加,体系的灵敏度均逐渐降低。因此,在处理样品时,应避免使用或尽量少用有机溶剂。本实验在处理样品时引入的甲醇经多次稀释后,其含量不会对测量结果造成明显影响。
2.3 工作曲线
按前述实验方法,得到测定罗丹明B残留量的标准工作曲线,线性方程为:I=450.6-347.1C/(mg/L),R=0.9996,线性范围为0~0.9mg/L。对含量为0.4mg/L的罗丹明B标准溶液11次平行测定的平均值为0.3963mg/L,相对标准偏差(RSD)为3.29%。
2.4 干扰物质的影响
在优化的实验条件下,考察果汁饮料中常见离子和物质对罗丹明B含量测定的影响。当罗丹明B溶液质量浓度为0.2mg/L,相对误差控制在±5%以内,测定时各种物质的最大允许倍数分别是:Na+、K+、Cl-、Br-(2000),L-精氨酸、L-赖氨酸、L-脯氨酸、L-半光氨酸、L-甘氨酸、葡萄糖(1000),VC、VE、NH4+(500),Mg2+、Zn2+(300),Ca2+(200),Fe3+、Cu2+(100)。由于样品被稀释,测定时上述共存物质允许倍数均大于其在果汁饮料中的相对值,对罗丹明B的测定不会有明显的干扰。
2.5 样品测定及回收率实验
对市售的5种果汁饮料进行测定,均未检出罗丹明B。准确量取1.0mL果汁4份于4支50mL具塞离心管中做加标回收率实验,加标水平为0.1、0.2、0.4、0.8mg/L,混合均匀,密封放置1d,然后按1.3.1节对样品进行处理,每个平行测定6次,测得回收率为101.3%~113.7%,RSD为2.76%~4.98%。
3 结 论
本研究建立了以伊红Y为荧光探针测定果汁类饮料中罗丹明B残留量的荧光光谱法。该方法样品处理简单,操作简便,具有灵敏度高、选择性强、用样量少、检测时间短、检测成本低等优点。为罗丹明B残留量的检测提供了一种快速简便灵敏准确可靠的新检测方法。
参考文献:
[1]姚型军, 袁倩, 刘道杰, 等. 罗丹明类化合物作为分析试剂的应用进展[J]. 理化检验: 化学分册, 2006(6): 499-504.
[2]NAINGGOLAN-SIHOMBING G. The toxic effect of rhodamine B in rats[S]. Paediatrica Indonesiana, 1984, 24(7/8): 125-138.
[3]陈纪刚. 国际癌症研究所(IARC)最新公布的对人致癌危险的评价表[J]. 劳动医学, 1995, 12(3): 50-60.
[4]SN/T 2430—2010 进出口食品中罗丹明B的检测方法(中英文版)[S]. 2010.
[5]程慧, 李兵, 占春瑞. 腊肠中罗丹明B的高效液相色谱串联质谱检测方法[J]. 食品科学, 2010, 31(4): 223-225.
[6]MASON R W, EDWARDS I R. High-performance liquid chromatographic determination of rhodamine B in rabbit and human plasma[J].Journal of Chromatography, 1989, 491(2): 468-472.
[7]SOYLAK M, UNSAL Y E, YILMAZ E, et al. Determination of rhodamine B in soft drink, waste water and lipstick samples after solid phase extraction[J]. Food Chem Toxicol, 2011, 49(8): 1796-1799.
[8]OPLATOWSKA M, ELLIOTT C T. Development and validation of rapid disequilibrium enzyme-linked immunosorbent assays for the detection of yethyl yellow and rhodamine B dyes in foods[J]. Analyst,2011, 136(11): 2403-2410.
[9]李小燕, 李梅, 陈其锋, 等. 固相萃取-高效液相色谱检测葡萄酒中罗丹明B[J]. 食品科学, 2011, 32(8): 238-243.
[10]CHIANG T L, WANG Y C, DING W H. Trace determination of rhodamine B and rhodamine 6G dyes in aqueous samples by solid-phase extraction and high-performance liquid chromatography coupled with fluorescence detection[J]. J Chin Chem Soc, 2012, 59(4): 515-519.
[11]SONG Shanshan, LIN Fei, LIU Liqiang, et al. Immunoaffinity removal and immunoassay for rhodamine B in chilli powder[J]. Int J Food Sci Technol, 2010, 45(12): 2589-2595.
[12]孙磊龙, 杨志华. 高效液相色谱测定食品中的罗丹明B[J]. 中国卫生检验杂志, 2011(7): 1648-1649.
Rapid Determination of Rhodamine B Residues in Fruit Drink by Fluorescent Probe Assay
LIANG Yu1,2,HUANG Shi-jiang1,WANG Chao-hai2,CHENG Ding-xi1,*
(1. School of Chemistry and Environmental Science, Henan Normal University, Xinxiang 453007, China ;2. College of Chemistry and Chemical Engineering, Xinxiang University, Xinxiang 453003, China)
A new fluorescence spectrometr y method for the determination of rhodamine B (RhB) was established by the use of eosin Y (EY) as fluorescent probe. In Sфrensen buffer solution at pH 6.8, the fluorescence intensity of anionic dye EY can be significantly enhanced by adding cetyltrimethylammonium bromide (CTMAB), a cationic surfactant. However, RhB has the ability to quench the fluorescence in a proportional manner within a certain concentration range. In this study, one-factor-at-atime designs were used to determine the optimal experimental conditions for the determination of RhB. The linear range,detection limit and average recovery rate of the developed assay were 0-0.9 mg/L, 0.0016 mg/L, and 101.3%-113.7% with relative standard deviation of 2.76%-4.98%, respectively. This method is simple, quick, selective and sensitive so that it is suitable for the determination of RhB residues in fruit drink products.
fluorescent probe;eosin Y;rhodamine B;residue
O657.3
A
1002-6630(2012)18-0258-03
2012-05-20
河南省重点科技攻关项目(102102210043)
梁宇(1970—),女,副教授,硕士,研究方向为环境分析。E-mail:sunrain732002@sina.com
*通信作者:程定玺(1964—),男,教授,博士,研究方向为药物分析和食品添加剂及农药残留检测。E-mail:chengdingxi@yahoo.com.cn

