蜱传莱姆螺旋体跨物种传播的信号调控*
杨章女,朱函坪,蒋宝贵,徐海君,曹务春
2.中国军事医学科学研究院微生物流行病研究所,北京100071;
3.浙江大学昆虫科学研究所 ,杭州 310058
莱姆病(LD)是由硬蜱属(Ixodes)传播的自然疫源性疾病,其病原体是呈革兰氏阴性的伯氏疏螺旋体(Borreliaburgdorferisensulato)。莱姆病可引起皮肤、关节、心血管和中枢神经系统组织等多系统感染,从而被世界卫生组织列为应重点防治研究的新发现传染病之一。近年来,全球莱姆病的发生呈上升的趋势,据美国疾病预防与控制中心公布,2009年全美已确诊的莱姆病人达近3万例,另有约1万例疑似病例,主要分布在美国东北部的纽约、康涅狄格以及中部的威斯康辛等州。在我国,莱姆病的分布也相当广泛,在20多个省、自治区、直辖市都有报道,由于临床症状复杂易于误诊,致残率较高,已成为我国重要的虫媒传播疾病之一[1]。
莱姆螺旋体完成生活史需要进化关系甚远的两类动物,即媒介蜱和哺乳动物宿主(如鼠)。由于这两类动物拥有截然不同的生理生化内环境,所以病原体的跨物种传播机制一直是莱姆病研究领域的热点,也是疫苗开发、疾病预防与控制的前期基础。本文现就莱姆螺旋体的二元信号系统和非核心转录因子在病原体跨物种传播时的信号调控研究进展作一简要综述。
1 Rrp2-RpoN-RpoS信号途径
已有的研究表明,莱姆螺旋体的基因调控往往是转录水平的调控,二元信号系统和非核心转录因子在这过程中扮演着重要的角色。在描述Rrp2-RpoN-RpoS这个信号途径之前,我们先对莱姆螺旋体的两个主要外膜蛋白(膜蛋白A和膜蛋白C)的研究进展进行概述,因为正是对这两个外膜蛋白的长期探索,才导致了Rrp2-RpoN-RpoS信号途径的发现。
早期的科研工作者对莱姆螺旋体进行实验室培养时发现了一个非常有趣的现象,不同的培养条件(如不同的pH和温度)会极大地改变菌体膜蛋白的成分。在较高的温度(约37。C)和较低的pH(pH≈7)条件下,螺旋体主要产生膜蛋白C;反之,较低的温度(23。C)和较高的pH(pH≈8)则使螺旋体表达膜蛋白A,那么该现象对应的生物学意义作何解释呢?一种比较认可的解释是较高的温度(约37。C)和较低的pH(pH≈7)条件模拟了哺乳动物内环境,而较低的温度(23。C)和较高的pH(pH≈8)条件则更接近于蜱中肠内环境。在过去的大概15年内,大量的实验表明膜蛋白C具有以下这些特征和功能[2-8]:1)只有当蜱刺吸哺乳动物宿主时,膜蛋白 C的启动子被激活,引起膜蛋白C大量表达,在吸血后48h达到表达高峰,而它在螺旋体寄生蜱中肠及在蜱的蜕皮过程中不表达;2)膜蛋白C是病原体侵染哺乳动物的关键致病因子,敲除膜蛋白C基因的螺旋体完全丧失了感染哺乳动物宿主的能力,也是第一个被发现与莱姆病毒力直接相关的膜蛋白;3)膜蛋白C功能的缺损使莱姆螺旋体丧失了从蜱中肠到唾液腺体的迁移能力,从而切断了感染哺乳动物的途径;4)膜蛋白C蛋白具有很强的免疫原性,早期莱姆病病人体内存在着大量的膜蛋白C抗体。据报道,膜蛋白C抗体具有良好的免疫保护作用,但是由于膜蛋白C序列在不同地区间有较大的差异性,直接限制了其实际应用价值。相反,研究表明膜蛋白A拥有与膜蛋白C完全不同的生物学功能[5,9-14]:1)膜蛋白 A 是病原体从哺乳动物进入蜱中肠后被诱导的膜蛋白,所以缺失膜蛋白A基因的病原体丧失了寄生虫媒蜱的能力,膜蛋白A也是目前发现的唯一一个寄生蜱必需的膜蛋白;2)膜蛋白A与膜蛋白C的表达呈相互排斥的关系,当膜蛋白A表达的时候膜蛋白C则不表达,反之亦然;3)缺失膜蛋白A基因的病原体虽然丧失了寄生蜱的能力,但能通过人工接种方式感染哺乳动物,说明膜蛋白A不是感染哺乳动物必需的;4)膜蛋白A蛋白具有很强的免疫原性,经膜蛋白A免疫的小鼠对病原体具有长期的免疫保护作用。特别值得一提的是膜蛋白A曾作为疫苗在美国使用了4年,但后来撤出市场,所以目前国际上还没有供人类使用的莱姆病疫苗。
正是由于膜蛋白A和膜蛋白C分别是病原体寄生虫媒蜱和哺乳动物必需的毒力因子,所以在过去的几十年间对它们进行了最广泛和深入的研究。近年,美国西南医学中心和国立卫生研究所的两个课题组利用遗传操作方法又发现这两蛋白的表达是受Rrp2-RpoN-RpoS信号途径控制。这条途径是由一个原核二元信号系统和两个选择性转录因子的组成,控制着与毒力相关的膜蛋白的表达(图1),其中Rrp2是原核二元信号系统的反应调节蛋白,RpoN和RpoS是病原体的两个选择性转录因子。如图1所示,当蜱刺吸哺乳动物时,反应调节蛋白Rrp2被磷酸化,磷酸化的Rrp2与选择性转录因子RpoN(sigma 54,σ54)、RNA 聚合酶(RNAP)一起结合于另一选择性转录因子rpoS(也称sigma 38,σ38)的启动子,从而激活rpoS的转录,而表达的RpoS直接激活像膜蛋白C这类毒力因子的转录,同时压制像膜蛋白A这类基因的转录[15-22]。该致病信号途径和致病因子的发现为了解莱姆病的传播途径、病原体与宿主的相互关系提供非常有价值的理论基础。
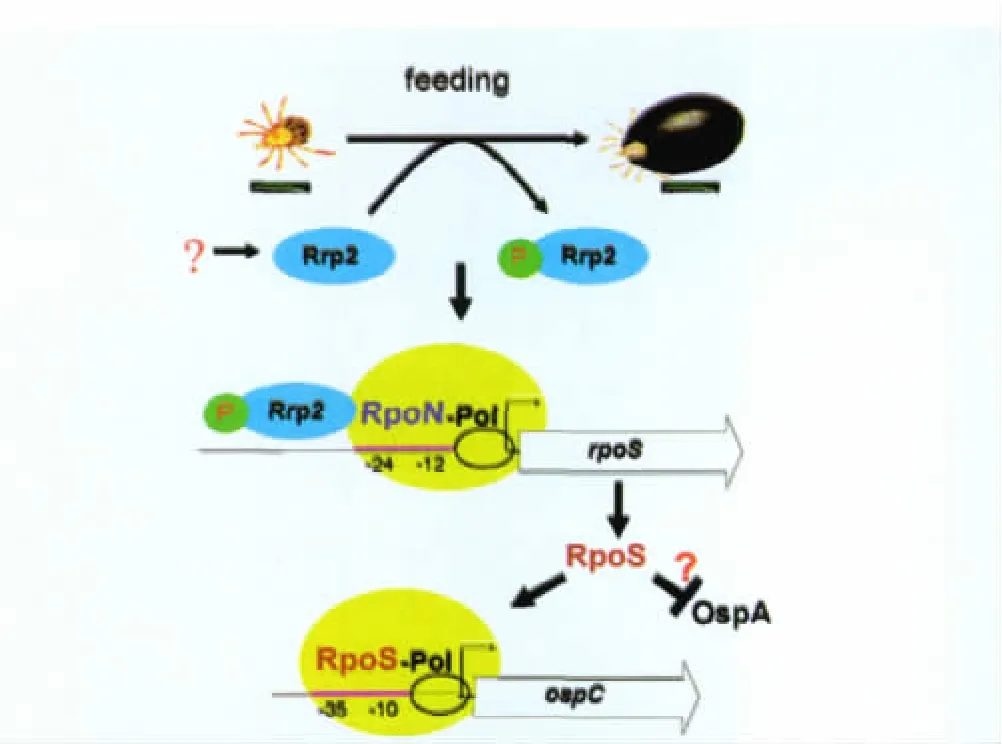
图1 莱姆螺旋体的Rrp2-RpoN-RpoS致病信号途径
2 HK1-Rrp1信号途径
对莱姆螺旋体的基因组进行分析发现,与大肠杆菌多达30多个二元信号系统相比,莱姆螺旋体基因组只编码了三组二元信号系统,即CheA-CheY、Hk1-Rrp1和Hk2-Rrp2,这三组信号途径负责感受外界环境变化,控制了病原体为适应逆环境的因子表达,帮助病原菌完成其生活史。CheA-CheY主要负责病原菌的趋化作用,破坏该信号系统后的螺旋体丧失了运动能力。Hk2-Rrp2二元信号系统的功能则如上所述,它们直接参与了病原体侵染哺乳动物时激活的Rrp2-RpoN-RpoS信号系统。至今,有关对Hk1-Rrp1二元信号系统的报道还非常有限,最近美国印地安纳大学和康涅狄格医疗健康中心的两个课题组的研究表明,Hk1-Rrp1二元信号系统在病原菌从哺乳动物传播到虫媒蜱的过程中被激活(图2),控制了一些与病原体寄生蜱中肠所需因子的表达,hk1-rrp1的删除使病原体丧失了寄生蜱中肠的能力。为了解释这一现象背后蕴含的生理机制,他们进一步利用基因芯片技术对其进行了更透彻的剖析,研究发现反应调节因子Rrp1正调控了病原体寄生蜱中肠时甘油的代谢,可以设想的是当病原体寄生蜱中肠时,它是以甘油作为碳源维持自身代谢,所以Hk1-Rrp1的失效直接降低了病原体的存活能力。如果这个设想成立,那么hk1-rrp1的删除是不会影响病原体对哺乳动物的感染,因为哺乳动物体内存在着其它可利用的碳源。以上的诸多设想经缜密实验也逐一得到了验证,相关研究成果也已得到发表[23-24]。
3 选择性转录因子Card
除了致病信号途径中的RpoN和RpoS这两个选择性转录因子外,莱姆螺旋体还编码了第3个非核心转录因子,即转录调节因子Card。Card的同源蛋白首先发现于色粘球菌(Myxococcusxanthus),它参与了色粘球菌光诱导的胡萝卜素形成、饥饿诱导的子实体形成、营养相关基因的表达等多个发育进程[25-32]。最近,对肺结核分支杆菌(Mycobacterim Tuberculosis)Card蛋白的研究发现了一个新的调节核糖体RNA转录的机制,结核杆菌Card能够控制核糖体RNA的转录,从而降低蛋白翻译速率使结核杆菌能够长期潜伏宿主,因此Card也成为了治疗肺结核的潜在药物靶标之一[33]。对Card蛋白序列分析又发现,该蛋白也是报道的原核生物中唯一一类与真核生物高迁移率蛋白家族A(High-mobility group A,HMGA)转录因子具有相似结构和功能的蛋白,高迁移率蛋白家族A具有结构转录因子的功能,能与DNA小沟结合激活多种途径的靶基因启动子,从而调节细胞生长进程[34],比如多种恶性肿瘤的发生与高迁移率蛋白的表达量升高呈正相关关系。所以,Card这类蛋白无论是在原核生物还是在真核生物中都发挥着重要的生物学功能。
为了探索莱姆螺旋体Card的生物学功能,我们曾对其进行了初步分析,发现Card在病原体模拟蜱的内环境条件下被激活,而且其表达模式是独立的,不受已发现的其它莱姆螺旋体信号途径调控[35],所以根据我们前期研究成果,结合已报道的Card同源蛋白的功能研究,提出了关于莱姆螺旋体Card生物学功能的一个假说(图2),即Card调控的基因产物使螺旋体在蜱体内具有了长期“休眠”的能力,此假说的验证工作正在进行中。
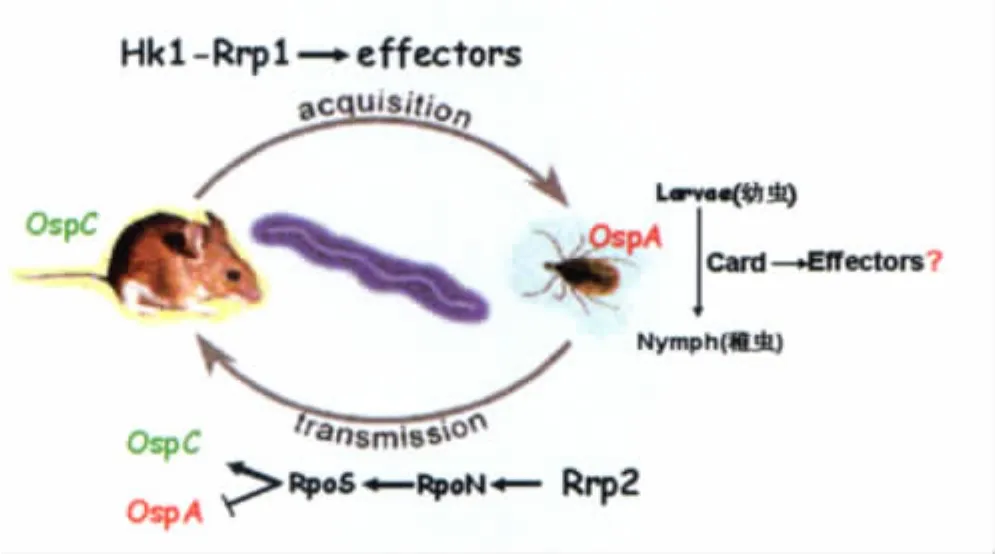
图2 莱姆螺旋体跨物种传播的致病机理假说
4 存在问题与展望
相对于其它虫媒传播疾病而言,由于莱姆螺旋体的潜在危害性、遗传操作的可行性、动物模型建立的简易性以及在病原菌分类学上的重要意义,现已成为揭露虫媒传播疾病致病机理的一个主要研究对象。虽然全世界科研工作者经过几十年的努力使有关莱姆螺旋体致病机制的信号传导途径初见端倪,但仍有一些基本的科学问题有待进一步的明确:(1)Rrp2-RpoN-RpoS致病信号途径的Rrp2是如何被磷酸化的?我们已有的结果已清楚表明组氨酸激酶II并不是Rrp2的激活因子,而乙酰磷酸虽然可以磷酸化Rrp2,但它并不是充分必要因子,所以后续工作只有在完全鉴定了与Rrp2互作蛋白的基础上,此问题才有望解决;(2)选择性转录因子RpoS具体的调控机制是什么?由于最近的研究表明铁离子摄取蛋白能够与RpoS的启动子紧密结合,敲除了铁离子摄取蛋白基因的螺旋体丧失了表达RpoS的能力。这与现有的假说即RpoS仅仅受Rrp2和RpoN直接控制是有出入的,所以有关RpoS启动子的研究工作有待进一步完善;(3)Hk1-Rrp1在蜱体内的生物学意义有待进一步探讨。甘油代谢途径仅仅是 Hk1-Rrp1途径控制的一个效应因子,Microarray结果显示了Hk1-Rrp1还控制其他一些重要的生化途径,这些途径有待螺旋体的遗传操作、生化实验和动物模型实验的验证;(4)除此之外,还有一些列其他重要现象有待解决,如病原体是如何对抗蜱媒的免疫系统、蜱体内微生物间的相互作用是否对螺旋体的致病途径产生影响、如何利用螺旋体自身蛋白或宿主蛋白开发多价疫苗等,所以要真正达到蜱传莱姆病的预防与控制的目标丞需长期的坚持不懈的研究探索。
[1]万康林,张哲夫,张金声,等.中国20个省、区、市动物莱姆病的初步调查研究[J].中国媒介生物学及控制杂志,1998,9(5):366-371.
[2]Grimm D,Tilly K,Byram R,et al.Outer surface protein C of the Lyme disease spirochete:aprotein induced in ticks for infection of mammals[J].Proc Natl Acad Sci U S A,2004,101(9):3142-3147.
[3]Gilmore RD,Piesman J.Inhibition ofBorreliaburgdorferimigration from the midgut to the salivary glands following feeding by ticks on OspC-immunized mice[J].Infect and Immun,2000,68(1):411-414.
[4]Ramamoorthi N,Narasimhan S,Pal U,et al.The Lyme disease agent exploits a tick protein to infect the mammalian host[J].Nature,2005,436(7050):573-577.
[5]Schwan TG,Piesman J,Golde WT,et al.Induction of an outer surface protein onBorreliaburgdorferiduring tick feeding[J].Proc Natl Acad Sci U S A,1995,92(7):2909-2913.
[6]Schwan TG,Piesman J.Temporal changes in outer surface protein A and C of the Lyme disease-associated spirochete,Borrelia burgdorferi,during the chain of infection in ticks and mice[J].J Clin Microbiol,2000,38(1):382-388.
[7]Stewart PE,Wang X,Bueschel DM,et al.Delineating the requirement for theBorreliaburgdorferivirulence factor OspC in the mammalian host[J].Infect and Immun,2006,74(6):3547-3553.
[8]Tilly K,Krum JG,Bestor A,et al.BorreliaburgdorferiOspC protein required exclusively in a crucial early stage of mammalian infection[J].Infect and Immun,2006,74(6):3554-3564.
[9]de Silva AM,Telford SR,Brunet LR,et al.BorreliaburgdorferiOspA is an arthropod-specific transmission-blocking Lyme disease vaccine[J].J Exp Med,1996,183(1):271-275.
[10]Fikrig E,Barthold SW,Marcantonio N,et al.Roles of OspA,OspB,and flagellin in protective immunity to Lyme borreliosis in laboratory mice[J].Infect and Immun,1992a,60(2):657-661.
[11]Fikrig E,Barthold SW,Kantor FS,et al.Long-term protection of mice from Lyme disease by vaccination with OspA[J].Infect and Immun,1992b,60(3):773-777.
[12]Montgomery RR,Malawista SE,Feen JM,et al.Direct demonstration of antigenic substitution ofBorreliaburgdorferiex vivo:exploration of the paradox of the early immune response to outer surface proteins A and C in Lyme disease[J].J Exp Med,1996,183(1):261-269.
[13]Ohnishi J,Piesman J,de Silva AM,Antigenic and genetic heterogeneity ofBorreliaburgdorferipopulations transmitted by ticks[J].Proc Natl Acad Sci U S A,2001,98(2):670-675.
[14]Pal U,Montgomery R R,Lusitani D,et al.Inhibition ofBorreliaburgdorferi-tick interactions in vivo by outer surface protein A antibody[J].J Immunol,2001,166(12):7398-7403.
[15]Burtnick MN,Downey JS,Brett PJ,et al.Insights into the complex regulation ofrpoSinBorreliaburgdorferi[J].Mol Micro-biol,2007,65(2):277-293.
[16]Caimano MJ,Eggers CH,Hazlett RO,et al.RpoS is not central to the general stress response inBorreliaburgdorferibut does control expression of one or more essential virulence determinants[J].Infect and Immun,2004,72(11):6433-6445.
[17]Caimano MJ,Iyer R,Eggers CH,et al.Analysis of the RpoS regulon inBorreliaburgdorferiin response to mammalian host signals provides insight into RpoS function during the enzootic cycle[J].Mol Microbiol,2007,65(5):1193-1217.
[18]Fisher MA,Grimm D,Henion AK,et al.Borreliaburgdorferiσ54is required for mammalian infection and vector transmission but not for tick colonization[J].Proc Natl Acad Sci U S A,2005,102(14):5162-5167.
[19]H bner A,Yang X,Nolen DM,et al.Expression ofBorrelia burgdorferiOspC and DbpA is controlled by a RpoN-RpoS regulatory pathway[J].Proc Natl Acad Sci U S A,2001,98(22):12724-12729.
[20]Ouyang Z,Blevins JS,Norgard MV,et al.Transcriptional interplay among the regulators Rrp2,RpoN and RpoS inBorrelia burgdorferi[J].Microbiology,2008,154(Pt9):2641-2658.
[21]Smith AH,Blevins JS,Bachlani GN,et al.Evidence that RpoS(σS)inBorreliaburgdorferiis controlled directly by RpoN(σ54/σN)[J].J Bacteriol,2007,189(5):2139-2144.
[22]Yang XF,Alani SM,Norgard MV.The response regulator Rrp2 is essential for the expression of major membrane lipoproteins inBorreliaburgdorferi[J].Proc Natl Acad Sci U S A,2003,100(19):11001-11006.
[23]Caimano MJ,Kenedy MR,Kairu T,et al.The hybrid histidine kinase Hk1is part of a two-component system that is essential for survival ofBorreliaburgdorferiin feedingIxodesscapularisticks[J].Infect Immun,2011,79(8):3117-3130.
[24]He M,Ouyang Z,Troxell B,et al.Cyclic di-GMP is essential for the survival of the Lyme disease spirochete in ticks[J].PLoS pathog,2011,7(6):e1002133.
[25]Balsalobre JM,Ruiz-Vázquez RM,Murillo FJ.Light induction of gene expression inMyxococcusXanthus[J].Proc Natl Acad Sci U S A,1987,84(8):2359-2362.
[26]El as-Arnanz M,Padmanabhan S,Murillo FJ.The regulatory action of the myxobacterial CarD/CarG complex:a bacterial enhanceosome[J].FEMS Microbiol Rev,2010,34(5):764-778.
[27]Fontes M,Galbis-Mart nez L,Murillo FJ.A novel regulatory gene fro light-induced carotenoid synthesis in the bacteriumMyxococcusxanthus[J].Mol Microbiol,1993,47(2):561-571.
[28]Galbis-Mart nez M,Fontes M,Murillo FJ.The high-mobility group A-type protein CarD of the bacteriumMyxococcusXanthusas a transcription factor for several distinct vegetative genes[J].Genetics,2004,167(4):1585-1595.
[29]Kaiser D.Myxococcus-from single-cell polarity to complex multicellular patterns[J].Annu Rev Genet,2008,42:109-130.
[30]Kroos L.TheBacillusandMyxococcusdevelopmental networks and their transcriptional regulators[J].Annu Rev Genet,2007,41:13-39.
[31]Mart nez-Laborda A,Murillo FJ.Genic and allelic interactions in the carotenogenic response ofMyxococcusxanthusto blue light[J].Genetic,1989,122(3):481-490.
[32]Nicol s FJ,Ruiz-V zquez RM,Murillo FJ.A genetic link between light response and multicellular development in the bacteriumMyxococcusxanthus[J].Genes Dev,1994,8(19):2375-2387.
[33]Stallings CL,Stephanou NC,Chu L,et al.CarD is an essential regulator of rRNA transcription required forMycobacteriumtuberculosispersistence[J].Cell,2009,138(1):146-159.
[34]Nicol s FJ,Cayuela ML,Mart nez-Argudo IM,et al.High mobility group I(Y)-like DNA-binding domains on a bacterial transcrition factor[J].Proc Natl Acad Sci U S A,1996,93(14):6881-6885.
[35]Yang X F,Goldberg MS,He M,et al.Differential expression of aputative CarD-like transcriptional regulator,LtpA,inBorreliaburdorferi[J].Infect and Immun,2008,76(10):4439-4444.

