舌下特异性免疫治疗前后哮喘患儿过敏原及血清总IgE的变化
韦 欢 欧维琳 朱春江 孟 文 张 明
桂林医学院附属医院儿科,广西桂林 541001
舌下特异性免疫治疗前后哮喘患儿过敏原及血清总IgE的变化
韦 欢 欧维琳▲朱春江 孟 文 张 明
桂林医学院附属医院儿科,广西桂林 541001
目的 分析粉尘螨滴剂舌下含服特异性免疫治疗(sublingual immunotherapy,SLIT)前后,哮喘患儿尘螨及其他过敏原皮肤点刺试验局部红斑直径改变以及血清总IgE变化情况,探讨粉尘螨滴剂免疫治疗在儿童过敏性哮喘脱敏治疗中的作用及时效性。 方法 收集本院2009年10月~2011年12月确诊哮喘并进行皮肤点刺试验及血清总IgE检测的患儿资料,所有患儿均予哮喘规范化吸入治疗,其中未加用SLIT者为对照组,加用SLIT维持6个月者为治疗6个月组,加用SLIT维持12个月者为治疗12个月组。检测入组前、完成治疗后血清总IgE值和过敏原皮试直径变化。 结果 研究结束共收集病例52例,其中对照组18例、治疗6个月组18例、治疗12个月组16例,入组前三组患儿皮肤点刺试验显示至少1种螨皮试反应≥(+++),其中粉尘螨、屋尘螨同时阳性者占82.58%(43/52),螨合并其他过敏原阳性者占63.46%(33/52),血清总IgE均大于同龄儿童正常值高限,平均升高(5.12±1.06)倍;治疗6个月组和治疗12月组疗程结束后螨、狗毛及蟑螂过敏原皮试直径较治疗前均有显著下降(P<0.01),治疗12个月组各种过敏原皮试直径均明显下降(猫毛、蒲公英、荨麻 P<0.05,其他 P<0.01);两组血清总IgE升高倍数在治疗后的下降幅度分别为(2.65±0.78)、(3.88±1.02),差异有高度统计学意义(P<0.01);对照组过敏原皮试直径和血清总 IgE的变化无统计学意义 (P>0.05)。 结论 粉尘螨滴剂舌下含服特异性免疫治疗可以有效抑制哮喘患儿对尘螨和其他常见吸入类过敏原的过敏反应,12个月疗程的脱敏效果明显优于6个月疗程。
舌下特异性免疫治疗;儿童哮喘;过敏原;血清总IgE
支气管哮喘是儿童常见的呼吸道过敏性疾病,且发病率正逐年上升,而尘螨是诱发过敏性哮喘最主要的吸入性过敏原[1-2]。粉尘螨滴剂舌下含服特异性免疫治疗(Sublingual immunotherapy,SLIT)作为哮喘防治的一种新的病因疗法,已越来越多的受到关注,但目前国内文献所提及更多的是粉尘螨SLIT对儿童哮喘症状的改善作用,关于其对不同尘螨以及对其他过敏原的脱敏效果的报道甚少。本文通过分析不同疗程粉尘螨滴剂治疗前后,哮喘患儿尘螨及其他过敏原皮肤点刺试验(Skin prink test,SPT)结果的改变以及血清总IgE的变化情况,探讨粉尘螨滴剂免疫治疗在儿童过敏性哮喘脱敏治疗的作用及时效性。
1 对象与方法
1.1 对象
选择2009年10月~2011年12月我院儿科哮喘门诊中,根据儿童哮喘诊断标准[3]确诊支气管哮喘的患儿,入组标准:均非哮喘急性发作期,伴或不伴过敏性鼻炎或湿疹,且至少1种螨皮试结果≥(+++);排除标准:除外变态反应以外的自身免疫性疾病、感染性疾病、心肝肾疾病。所有患儿分为三组,均予哮喘规范化吸入治疗,其中未加用SLIT者为对照组,加用SLIT维持6个月者为治疗6个月组,加用SLIT维持12个月者为治疗12个月组。本研究通过我院伦理委员会批准,所有患儿家属均签署知情同意书。
1.2 方法
1.2.1 检测设计 三组患儿均于治疗开始前完成1次包括10种常见吸入类过敏原(粉尘螨、屋尘螨、霉菌Ⅰ组、霉菌Ⅱ组、蟑螂、猫毛、狗毛、绵羊毛、蒲公英、荨麻)的皮肤点刺试验以及血清总IgE检测;治疗6个月组和治疗12个月组分别于疗程结束后1周复查过敏原皮肤点刺试验以及血清总IgE;对照组分别于疗程满6个月后及12个月后1周各复查1次过敏原皮肤点刺试验和血清总IgE。
1.2.2 过敏原皮肤点刺试验 选用默克集团Allergopharma公司生产的阿罗格变应原皮肤点刺试液,选用阿罗格组胺1+999液作为阳性对照液,以生理盐水作为阴性对照液。严格按阿罗格点刺试验使用说明进行点刺试验,作出结果判断并记录阳性结果的风团和红晕直径。所有患者皮肤点刺试验前停用抗过敏药及激素≥3 d。
1.2.3 血清总IgE检测方法 采集患儿外周静脉血2 mL,采用德国罗氏电化学发光IgE试剂盒,以E170电化学发光免疫分析仪按试剂盒说明书对标本进行检测。
1.2.4 治疗方法 所有患儿均根据《儿童支气管哮喘诊断与防治指南(2008年修订)》[3]予以哮喘规范化吸入治疗,治疗组在吸入治疗基础上加用由浙江我武生物科技股份有限公司生产的粉尘螨滴剂行SLIT维持6个月或12个月。SLIT分4个逐级递增浓度(1~4 号),其总蛋白浓度分别为 1、10、100、333 mg/L。1~3号用于递增期,4号用于维持期;免疫治疗从1号开始,按说明量每天舌下滴药,含服1~2 min后吞服,于前3周依次服用1号、2号、3号滴剂,从第4周起用4号滴剂每日1次,每次服3滴维持治疗。中途如出现不良反应,减3级剂量服用,耐受后逐渐递增;若停服2周以上则从递增期开始从头服用。
1.3 统计学方法
应用SAS 8.10软件包进行统计学处理,计量资料数据以均数±标准差(±s)表示,比较采用t检验,配对数据进行配对秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 入组结果
根据入组标准收集病例共52例,其中,男28例,女24例,年龄4~14岁;合并有过敏性鼻炎、湿疹/荨麻疹者分别为67.31%(35/52)、23.08%(12/52)。治疗 6个月组 18例, 治疗12个月组16例,对照组18例,三组间患儿性别、年龄、病情、治疗前过敏原皮试和血清总IgE结果比较基本相似(P>0.05),具有可比性。
2.2 SLIT治疗前后SPT结果
三组患儿粉尘螨及屋尘螨同时阳性者占82.58%(43/52);螨合并其他吸入类过敏原阳性占63.46%(33/52);治疗6个月组18例患儿SLIT疗程结束后,SPT结果显示两种螨虫、狗毛、蟑螂过敏原皮试直径较治疗前有显著下降 (P<0.01);16例患儿经SLIT 12个月后,SPT结果示各过敏原的皮试直径均有明显下降(猫毛、蒲公英、荨麻P<0.05,其他P<0.01);螨阴转率:治疗 6 个月组为 1.92%(1/52),治疗 12 个月组为7.69%(4/52);其他吸入类过敏原转阴率:治疗6个月组为 13.46%(7/52),治疗 12 个月组为 21.15%(11/52);对照组治疗前、治疗6个月、治疗12个月SPT变化比较无差异(P>0.05)。见表 1。
2.3 SLIT治疗前后IgE检测值
52例哮喘患儿治疗前血清总IgE均大于试剂盒说明书所提供的同龄儿童正常值 (1~5 岁:0~144 ng/mL;6~9 岁:0~216 ng/mL;10~15 岁:0~480 ng/mL),最高达正常值高限 10倍以上,平均较同龄儿童正常值高限升高(5.12±1.06)倍。SLIT治疗后,两治疗组血清总IgE均明显下降,降幅在治疗前后变化有差异(P<0.01),而对照组在治疗前、治疗6个月和治疗12个月后血清总IgE变化无统计学意义(P>0.05)。见表2。
2.4 哮喘及其他过敏表现变化
治疗6个月组和治疗12个月组SLIT前后比较,哮喘发作次数显著减少、过敏性鼻炎和湿疹/荨麻疹症状轻重程度明显减轻,其中2例呈季节性湿疹表现的病例在免疫治疗12个月后在原好发季节湿疹症状基本消失;对照组除哮喘发作次数明显减少外,其他变化不大。
表1 舌下含服免疫治疗前后各过敏原皮肤点刺试验直径变化(±s,mm)
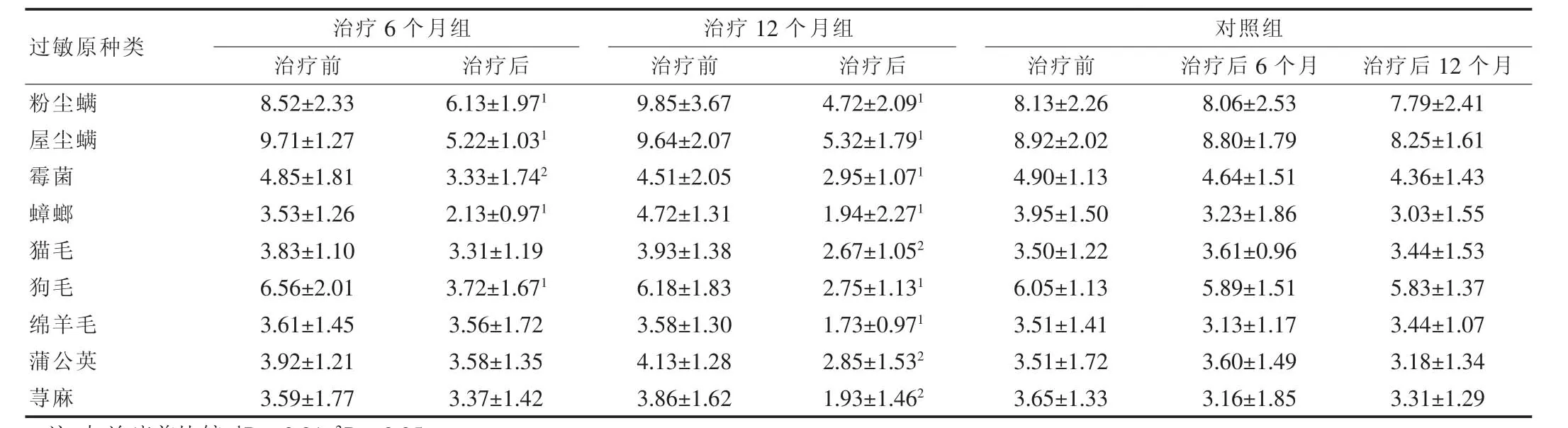
表1 舌下含服免疫治疗前后各过敏原皮肤点刺试验直径变化(±s,mm)
注:与治疗前比较,1P<0.01;2P<0.05
过敏原种类 治疗6个月组治疗前 治疗后治疗12个月组治疗前 治疗后粉尘螨屋尘螨霉菌蟑螂猫毛狗毛绵羊毛蒲公英荨麻8.52±2.33 9.71±1.27 4.85±1.81 3.53±1.26 3.83±1.10 6.56±2.01 3.61±1.45 3.92±1.21 3.59±1.77 6.13±1.971 5.22±1.031 3.33±1.742 2.13±0.971 3.31±1.19 3.72±1.671 3.56±1.72 3.58±1.35 3.37±1.42 9.85±3.67 9.64±2.07 4.51±2.05 4.72±1.31 3.93±1.38 6.18±1.83 3.58±1.30 4.13±1.28 3.86±1.62对照组治疗前 治疗后6个月 治疗后12个月4.72±2.091 5.32±1.791 2.95±1.071 1.94±2.271 2.67±1.052 2.75±1.131 1.73±0.971 2.85±1.532 1.93±1.462 8.13±2.26 8.92±2.02 4.90±1.13 3.95±1.50 3.50±1.22 6.05±1.13 3.51±1.41 3.51±1.72 3.65±1.33 8.06±2.53 8.80±1.79 4.64±1.51 3.23±1.86 3.61±0.96 5.89±1.51 3.13±1.17 3.60±1.49 3.16±1.85 7.79±2.41 8.25±1.61 4.36±1.43 3.03±1.55 3.44±1.53 5.83±1.37 3.44±1.07 3.18±1.34 3.31±1.29
表2 三组治疗前后血清总IgE平均较同龄儿童正常值高限升高倍数比较(±s)
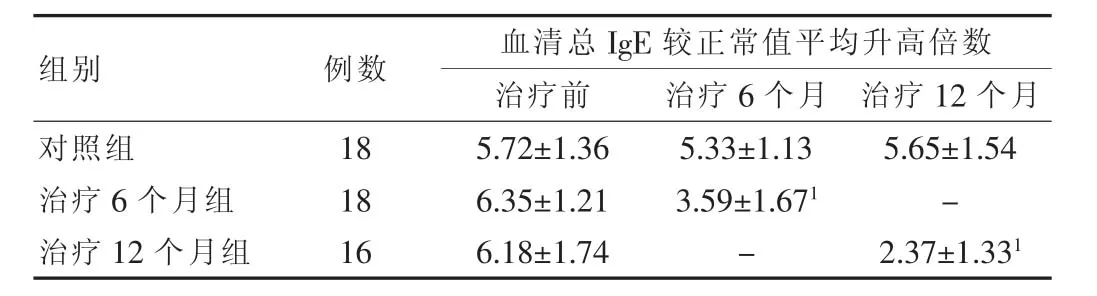
表2 三组治疗前后血清总IgE平均较同龄儿童正常值高限升高倍数比较(±s)
注:“-”为无数值;与治疗前比较,1P<0.01
组别例数 血清总IgE较正常值平均升高倍数治疗前 治疗6个月 治疗12个月对照组治疗6个月组治疗12个月组18 18 16 5.72±1.36 6.35±1.21 6.18±1.74 5.33±1.13 3.59±1.671-5.65±1.54-2.37±1.331
2.5 特异性免疫治疗不良反应
两治疗组共34例患儿,在SLIT过程中仅1例在递增至粉尘螨滴剂3号8滴时出现轻度哮喘发作,予雾化平喘后降低至3号1滴,递增速度减慢至每3天在耐受的情况下递增1级,哮喘未再发作。另有2例分别于递增期和维持初期湿疹加重,经采取退回最小剂量重新开始并根据耐受情况缓慢递增浓度的措施后,湿疹逐渐好转未再反复。
3 讨论
支气管哮喘是由肥大细胞、嗜酸性粒细胞和淋巴细胞等多种细胞参与的慢性气道炎症性疾病,其病因与遗传过敏体质及环境因素有关,多数患者有过敏性鼻炎、湿疹或其他过敏疾病史。流行病学调查表明尘螨是最主要的吸入性过敏原[4],且尘螨与狗毛、猫毛、蟑螂及其他过敏原之间存在过敏原交叉反应性[5-6]。近年来多项研究表明哮喘的发病机制与过敏原选择性的激发T辅助细胞亚群中的Th2细胞,从而导致Th1/Th2分化和调控比例失衡存在密切关系,Th1型细胞因子IL-2、IFN-γ 减少,Th2 细胞因子 IL-4、IL-5、IL-13 增多,其中IL-4被认为在哮喘发病中扮演着重要角色[7],它诱导IgE产生,导致IgE介导的变态反应。
吸入皮质激素(ICS)对哮喘的气道炎症和症状控制的有效性已得到确认,但需长期使用,而目前研究认为,药物治疗对过敏性哮喘停药后疗效的长期维持无明显作用[8],而近20多年来,随着过敏原提纯技术发展,采用标准化过敏原提取液对过敏性哮喘进行特异性免疫治疗(SIT)已被世界卫生组织(WHO)[9]和欧洲变态反应与临床免疫学会(EAACI)[10]充分认可,并被认为是目前唯一针对哮喘病因的治疗,儿童早期进行SIT还可能改变哮喘的自然病程。SIT防治过敏性疾病的作用机制目前认为主要是通过调整失衡的Th1/Th2型免疫应答得以实现,Wynn[11]研究提出免疫治疗可以诱导变应原特异性的IL-4细胞的凋亡,国内相关文献[12]也提示随着免疫治疗的进行,外周血单个核细胞中IFN-γ mRNA表达水平较IL-4升高,均证实免疫治疗可使哮喘患儿体内Th1/Th2细胞失衡得到一定纠正。
SIT的两大径路——皮下径路(SCIT)和舌下径路(SLIT)在临床上均广为应用。前者疗效明确但由于频繁的注射缺乏便捷性,并可能导致儿童恐惧和因交通及占用学习时间造成间接损失;后者安全、方便,“WAO舌下变应原特异性免疫治疗白皮书(2009)”指出,理论上认为SLIT与传统免疫疗法SCIT具有相似的原理,此外舌下停留的变应原疫苗可能通过刺激口腔黏膜的郎格尔汉斯细胞上皮细胞和单核细胞合成IL-10、TGF-β和激活素类,参与口腔黏膜导致的免疫耐受的建立和维持。
本文观察34例过敏性哮喘患儿在接受粉尘螨滴剂SLIT 6个月和12个月后过敏症状的改变,以及包括2种不同螨虫在内的10种吸入类过敏原SPT反应和血清总IgE的变化,结果无论症状还是过敏原皮试反应,在免疫治疗6个月后即已表现出明显统计学意义的变化,而这种变化在治疗12个月后的患儿身上体现得更为显著,并且随着治疗的继续,除螨以外的多种吸入类过敏原的皮试反应亦显示出不同程度的抑制甚至转阴改变,提示粉尘螨滴剂SLIT在过敏性哮喘防治上具有良好的临床疗效,其作用存在一定的时效性,而过敏性哮喘的常见各致敏原之间可能存在着交叉反应,通过粉尘螨等单一过敏原提取液制剂的SLIT可能达到对其他过敏原理想的治疗。至于SLIT的最佳疗程和长期疗效等,还有待进一步研究。
[1]陈育智,马煜,王红玉,等.中国三城市儿童个人过敏原与喘息及气道高反应的相关性研究[J].中华儿科杂志,2003,41(7):538.
[2]孙劲旅,张宏誉,陈君,等.尘螨与过敏性疾病的研究进展[J].北京医学,2004,26(3):199.
[3]中华医学会儿科学分会呼吸学组.儿童支气管哮喘诊断与防治指南(2008 年修订)[J].中华儿科杂志,2008,46(10):724-726.
[4]Miraglia DGM,Pedulia M,Hacentini GL,et al.Atopy and house dust mitesensitizationasriskfactorsforasthmainchildren[J].Allergy,2002,57:169-172.
[5]陈媳,陈同辛,朱亚忠,等.变态反应性疾病患儿猫、狗上皮的变应原反应性及抗原交叉性[J].实用儿科临床杂志,2006,21(10):615-616.
[6]孙劲旅,陈军,张宏誉,等.尘螨过敏原的交叉反应性[J].昆虫学报,2006,49(4):695.
[7]Rifkin IR,Marshak RA.T bet:the Toll-brigdge to class-switch recombination?[J].Nat Immunol,2003,4(7):650-652.
[8]Guilbert TW,Morgan WJ,Zeiger RS,et al.Long-term inhaled corticosteroids in preschool children at high risk for asthma[J].N Engl J Med,2006,354(19):1985-1997.
[9]Bousquet J,Lockey RF,Mailing H J.Allergen immunotherapy:therapeuticalvaccines for allergic diseases[J].Allergy.WHO Position Paper,1998,53:1-42.
[10]Mailing HJ,Abreu NJ,Alvarez CE,et al.Local Immunotherapy[J].Position paper by the working group on local Immunotherapy of the EAAClSubcommittee and the ESPACI Immunotherapy Subcommittee[J].Allergy,1998,53:933-944.
[11]Wynn TA.IL-13 effect function[J].Annu Rev Imnunol,2003,21:425-456.
[12]李付广,王芳,杜英,等.儿童过敏性哮喘尘螨特异性免疫治疗中干扰素-γ白介素4T-bet和GATA-3mRNA表达变化的研究[J].中国实用儿科杂志,2009,24(4):267-269.
Changes of serum IgE and skin prick tests after SLIT treatment in asthma children
WEI Huan OU Weilin▲ZHU ChunjiangMENG Wen ZHANG Ming
Department of Pediatrics,the Affiliated Hospital of Guilin Medical College,Guangxi Zhuang Autonomous Region,Guilin 541001,China
ObjectiveTo analyze the changes of the skin prick test and serum IgE in the asthma children after dust mite sublingual immunotherapy(SLIT),explore the value and the effective time of dust mite SLIT.MethodsThe children confirmed as asthma were recruited from October 2009 to December 2011 in our hospital.They were regular asthma treated.Children not involved SLIT were assigned to control group.Children with additional 6 monthes′SLIT were assigned to therapy group 1(6 months′therapy).Children with additional 12 monthes′SLIT were assigned to therapy group 2(12 months′therapy).All of them were taken both skin prick test and serum IgE test before and after the treatment.ResultsOf the 52 participants,18 were assigned to control group,18 to therapy group 1,16 to therapy group 2.Before treatment,all the individuals′reaction to skin prink test showed at least one mite ≥ (+++).43 of 52 children(82.58%)showed positive reaction in both dust mite and house dust mite.33 of 52 children(63.46%)showed positive reaction in both mite and some other antigens.Serum IgE levels were(5.12±1.06)times higher than the healthy children.After 6 or 12 months′treatment,the skin test′s diameters reduced significantly in mite,dog hair and cockroach (P < 0.01).After 12 months′treatment,the skin test′s diameters reduced significantly in all the antigens(for cat hair,dandelion and nettle,P < 0.05;for the rest antigens,P < 0.01).The serum IgE level reduced significantly(P<0.01).The skin test′s diameters and serum IgE level didn′t change significantly in the control group (P>0.05).ConclusionDust mite SLIT may inhibit the allergy reaction to dust mite and the other inhalation antigens effectively.12 months′therapy may better than 6 months′therapy.
SLIT;Asthma;Antigen;Serum IgE
R725.6
A
1673-7210(2012)08(c)-0008-03
广西自然科学基金(桂科字0728228);广西医疗卫生重点科研课题(重 2010048);广西卫生厅课题(z2011173)。
▲通讯作者
2012-07-05 本文编辑:郝明明)

