Ga和Cu/In衬底上电沉积金属Ga
张 超 敖建平 王 利 姜 韬 孙国忠 何 青 周志强 孙 云
(南开大学光电子薄膜器件与技术研究所,天津市光电子薄膜器件与技术重点实验室,光电信息技术科学教育部重点实验室,天津300071)
Ga和Cu/In衬底上电沉积金属Ga
张 超 敖建平*王 利 姜 韬 孙国忠 何 青 周志强 孙 云
(南开大学光电子薄膜器件与技术研究所,天津市光电子薄膜器件与技术重点实验室,光电信息技术科学教育部重点实验室,天津300071)
在酸性水溶液中,分别在金属Ga和Cu/In衬底上进行了Ga电沉积的研究.用循环伏安法研究了导电盐、pH值对电沉积Ga的影响.系统研究了Ga的沉积过程,发现Ga会逐渐向薄膜内部扩散,在Cu/In界面上与CuIn合金反应生成CuGa2合金.针对Cu/In薄膜和Ga薄膜是活泼金属的特点,在溶液中加入三乙醇胺有效地保护了Cu/In薄膜和Ga金属薄膜不被氧化,并且提高了Ga沉积的电流效率.在Cu/In薄膜上制备出了均匀光亮的金属Ga薄膜.对电沉积出Cu-In-Ga预置层进行了硒化处理,得到了质量较好的Cu(In1-xGax)Se2(CIGS)薄膜,并制备了太阳电池.电池效率达到了9.42%.
电化学沉积;Cu(In1-xGax)Se2;循环伏安法;金属预置层;太阳电池
1 引言
电化学沉积法是一种原材料利用率高、低成本的快速制备薄膜的方法,广泛应用于金属装饰与防护、电子产业和材料制备等领域.近些年,由于光伏产业的蓬勃发展,人们对低成本工艺日益关注,电化学沉积法应用于GaTe、CdTe和CIGS等化合物半导体材料,得到了大力发展.1-3其中,电沉积法应用于制备CIGS化合物半导体材料大体分为两种方法:一种是从含有Cu、In、Ga和Se四种元素的溶液中一步电沉积得到CIGS薄膜,4-7用此种方法制备的CIGS薄膜在经过物理气相沉积(PVD)处理后,最高效率达到了15.4%.8本课题组也对这种方法进行了大量的研究,9,10但是发现这种方法所用的溶液难以维护,稳定性差,不利于工业化生产.另一种是电沉积Cu、In、Ga金属预制层再硒化的方法,11,12所制备的CIGS薄膜电池转化效率已经达到了13.7%,13并且经历了产业化测试,有很好的应用前景.
Ga在CIGS电池中有着非常重要的作用,随着薄膜中Ga含量的不同,CIGS电池禁带宽度在1.04-1.68 eV之间可调,该带隙范围与地面太阳光谱最佳吸收范围(1.4-1.6 eV)匹配,从而获得更高的光电转化率.但是,在金属预置层的制备中,金属Ga由于其本身性质特殊(熔点低,不适合金属装饰和防护),很少有关于电沉积Ga薄膜质量的报道,人们研究Ga的电沉积原理,14,15主要目的是从处理Al过程中的杂质和二次电解Zn的碱性废液中提取Ga,因而不关心沉积Ga的质量.16,17
在制备Cu-In-Ga金属叠层时,不同于提取Ga,我们不仅考虑到Ga的含量,还同时关注Ga薄膜的质量和Ga在薄膜中存在的形式,这对后期硒化处理至关重要.在Cu/In衬底上电沉积Ga大致存在以下几个问题:首先,Ga是活泼金属(标准电极电位为-0.56 V),18电流效率不高;其次,在电沉积Ga的过程中,反应相当于先在Cu/In活泼电极生长Ga,后在Ga活泼电极上生长Ga的过程,由于电极不同,要分开考虑.并且沉积的Ga薄膜和所研究的Cu/In衬底中In同为活泼金属,在水溶液中会发生氧化、腐蚀等反应,损害薄膜质量;再次,由于电沉积Ga伴随H2的析出,电极表面附近溶液状态变化显著;最后, Ga在薄膜中存在的形式与溶液体系和电极反应息息相关.在电镀工业以及金属腐蚀和防护领域中,溶液的导电盐、pH值以及添加剂是影响电极表面状态以及镀层质量的主要因素.19
本文首先通过循环伏安法研究了导电盐和pH值分别对Cu/In电极和金属Ga电极以及Ga电沉积的影响,为电沉积Ga选取合适的溶液体系.然后,选取常用作缓蚀剂和表面活性剂的三乙醇胺作为添加剂,来解决溶液对Cu/In电极和Ga电极的氧化腐蚀问题,并研究其对Ga电沉积的影响.为了使电沉积Ga与前述电沉积Cu、In工艺相匹配,Ga溶液体系同样选择在酸性体系下进行研究.最后,将制备好的Cu-In-Ga金属预制层进行硒化处理,并对薄膜特征和电池效率进行了讨论.
2 实验
首先,分别以1 mol·L-1的氨基磺酸钾、1 mol· L-1氯化钾和0.5 mol·L-1硫酸钾作为导电盐配置pH值为1.40的水溶液,用循环伏安法对其进行研究分析.然后,在含有导电盐的溶液中加入0.01 mol·L-1的硫酸镓作为主盐,在酸性范围内,研究pH值对Ga沉积的影响.最后,研究三乙醇胺对Ga电沉积的影响.药品均由天津市风船化学试剂科技有限公司生产,纯度均为分析纯.
电解池为常规的三电极结构,Pt片作为辅助电极,饱和甘汞电极(SCE)为参比电极,研究电极为金属Ga电极和自制的Cu/In薄膜电极.Cu/In薄膜电极的制备首先在普通钠钙玻璃上用直流溅射法沉积约1 μm的金属Mo,用电沉积的方法分别在Cu和In的电解液里顺序沉积金属Cu和In,Cu/In薄膜一共大约0.7 μm.金属Ga电极为Ga的金属薄片.在实验过程中,使用由上海晨华仪器公司生产的CHI660C型电化学工作站来进行电位的精确控制和实验数据的采集.循环伏安曲线每次由开路电位起始扫描至-2 V,再回扫至0.2 V,扫描速率为10 mV·s-1.
对制备好的Cu-In-Ga金属叠层进行了硒化处理,为了增加薄膜的结合力,在硒化处理前,在250°C无Se环境下进行了20 min的合金化处理,再在550°C下进行硒化处理30 min.用X射线荧光光谱分析仪(XRF)对薄膜的化学组分进行了分析,用X射线衍射仪(XRD)对薄膜的晶体结构进行了测试,用扫描电子显微镜(SEM)对薄膜的表面和截面形貌进行了分析.
CIGS薄膜光伏电池是由在CIGS薄膜上用化学水浴法制备了80 nm厚的CdS层,用溅射方法制备了50 nm的本征氧化锌层和大约500 nm的掺Al氧化锌层所组成.CIGS薄膜太阳电池在25°C、标准光强为AM1.5、辐照强度为1000 W·m-2的条件下进行测试.
3 结果与分析
3.1 导电盐对溶液性质的影响
为了排除Ga电沉积对电极表面的影响,分别对1 mol·L-1氨基磺酸钾、1 mol·L-1氯化钾和0.5 mol· L-1硫酸钾作为导电盐的水溶液(pH=1.40)进行了循环伏安曲线和阳极极化曲线的测试,如图1所示.从图1(a)在Ga电极上不同导电盐溶液的循环伏安曲线中可以看出,不同导电盐溶液的析氢电位是不同的,以0.5 mA·cm-2的电流密度的电位来衡量,氨基磺酸钾溶液为-0.90 V(vs SCE,下同)、硫酸钾溶液为-0.87 V,而氯化钾溶液析氢电位较负,为-1.00 V,较负的析氢电位有利于活泼金属的沉积,获得更高的电流效率.对于氯化钾溶液和硫酸钾溶液,在-1.20 V附近电流密度变化趋于平缓,这是由于当电位较低时,溶液中主要发生的反应是H+得电子还原成H2的反应,方程可以写成:

随着电极电位逐渐变负,氢离子的反应逐渐变快,当溶液中氢离子向电极的扩散速度不能满足电极反应消耗的速度时,电化学反应由浓差极化控制,电流密度达到饱和.因此,在-1.20 V硫酸钾溶液和氯化钾溶液中扫描电流密度趋于饱和,是由于电极表面H+离子消耗殆尽,而H+离子的大量消耗会使得电极表面附近溶液pH值升高.当电极电位扫描至-1.60 V时,电流密度又开始逐渐增大,这是由于溶液中发生了水得电子还原成生H2的反应,方程可以写成:


对于氨基磺酸钾溶液,在扫描过程中始终以电化学极化为控制步骤,说明电极表面H+始终可以通过扩散得到补充,电极表面pH值变化比硫酸钾溶液和氯化钾溶液要小很多,溶液稳定性大大提高.在回扫曲线中,三种溶液体系都未出现Ga的氧化峰,这可能由于金属Ga电极在反应过程中发生了钝化,其方程可以表示为:

此外,在研究含Ga溶液循环伏安曲线时, Ribeaucourt等21认为在曲线回扫过程中,金属Ga氧化反应优先于Ga的电化学反应,因此,在金属Ga电极上的曲线回扫过程中,也可能存在相同的反应,其方程可以表示为:

图1 在Ga电极和Cu/In电极上不同导电盐溶液的循环伏安曲线和阳极极化曲线Fig.1 Cyclic voltammograms and anodic polarization curves obtained in the solutions withdifferent supporting electrolytes on Ga and Cu/In substratesA:in oxidation zone;B:Cu-In oxidation zone.(a)cyclic voltammograms on Ga substrate;(b)cyclic voltammograms on Cu/In substrate; (c)anodic polarization curves on Ga substrate;(d)anodic polarization curves on Cu/In substrate

图1(b)为在Cu/In电极上不同导电盐溶液的循环伏安曲线,与图1(a)相比,相同电位下的电流密度要低很多.对于析氢电位,同样以0.5 mA·cm-2的电流密度的电位来衡量,氨基磺酸钾溶液、硫酸钾溶液和氯化钾溶液的很相近,分别为-1.03、-1.11和-1.14 V.在Cu/In电极上仅有氯化钾溶液扫描曲线呈现了电极反应由浓差极化控制,H+最大还原电流密度的电位为-1.35 V,水还原生成氢气的电位负移至-1.80 V.在回扫曲线中,曲线均出现多个氧化峰,A区域的氧化峰为金属In的氧化峰,B区域为Cu-In合金的氧化峰.对于氨基酸盐体系,没有出现Cu-In合金的氧化峰,但是有一定的阳极氧化电流;而对于氯化物盐体系,不仅出现了Cu-In合金的氧化峰,在0.14 V还出现了金属Cu的氧化峰.氧化峰出现的越早,半高宽越小,说明体系的氧化性越强,因此,氯化物盐体系的水溶液氧化性最强,硫酸盐体系的次之,氨基磺酸盐体系最弱.为了排除阴极扫描时带来的电极表面附近溶液pH值变化的影响,分别在Ga电极和Cu/In电极上进行了阳极极化曲线的测试,如图1(c,d).对于Ga电极,阳极极化曲线在-0.80-0.20 V范围内仍没有观察到Ga的氧化峰,但是根据不同导电盐体系的阳极氧化电流斜率可以判断,氯化物盐体系对金属Ga腐蚀性最大,硫酸盐体系的次之,氨基磺酸盐体系最小.对于Cu/In电极,在氯化物盐体系中,-0.44 V出现金属In的氧化峰,-0.13 V出现Cu-In合金的氧化峰,0.07 V出现金属Cu的氧化峰;硫酸盐体系中,金属In的氧化峰出现在-0.40 V,Cu-In合金氧化峰在0.02 V,金属Cu的氧化峰大于0.20 V;氨基磺酸盐体系中,仅在-0.29 V出现了金属In的氧化峰,也说明了氯化物盐体系的水溶液氧化性最强,硫酸盐体系的次之,氨基磺酸盐体系最弱.
实验中,三种导电盐溶液中的离子浓度是相同的,但是扫描曲线的斜率却相差很大,这是由于在硫酸盐体系中存在HSO4-与SO42-的平衡,在相同pH值下,硫酸盐完全水解后的H+浓度要大于其他两种导电盐,因此,硫酸盐体系的扫描曲线斜率最大;而对于氯化物盐体系,由于Cl-离子在电极表面特性吸附作用,使得电极的析氢过电位变得更负,如图1(a, b)所示,双电层结构变成由电极表面与吸附的Cl-离子和吸附的Cl-离子与溶液中阳离子所组成的三电层结构,阻碍了H+离子的析氢反应,使得曲线斜率变小.22
Cu/In电极的扫描试样外观同样反应出导电盐对电极的影响,氨基磺酸盐体系中的试样上还能观察到In的银白色痕迹,硫酸盐体系中的试样上露出光亮的Cu膜,而氯化物盐体系中的试样Cu部分被腐蚀掉了.这与图1(b)上的曲线所反应的一致.
通过三种导电盐体系的对比,可以得出以下结论,(1)在金属Ga电极实验中,硫酸盐和氯化物盐体系中H+反应均由浓差极化控制,说明电极附近pH值变化很大,不利于金属Ga的沉积;(2)氯化物盐和硫酸盐对金属薄膜的腐蚀性较强,影响沉积薄膜的质量;(3)氯化物盐容易使Ga、In钝化,阻碍反应进行.
因此,氨基磺酸盐作为沉积Ga薄膜溶液的导电盐,更为合适.在电镀工业和金属防护与腐蚀领域中,氨基磺酸盐常常用于光亮金属的电镀和对钢件的洗涤,有很好的导电性和缓冲作用.23
3.2 pH值变化对Ga沉积的影响
图2为不同pH值的氨基磺酸钾空白溶液在Ga电极和Cu/In电极上的循环伏安扫描曲线,从图中可以看出,pH值为1.40、2.75、5.00时(以0.5 mA· cm-2电流密度的电位衡量),Ga电极上的析氢电位分别为-0.90、-0.87、-1.22 V;Cu/In电极上的析氢电位分别为-1.03、-1.09、-1.49 V.pH值从1.40增加到2.75,析氢电位变化不大,而当pH值增加到5.00时,析氢电位负移.这是由于当pH值从1.40增加到2.75时,溶液中有相当含量的H+离子,析氢反应主要为(1)式的H+还原反应,但是随着pH值增大,H+浓度逐渐降低,析氢电流密度迅速减小.当pH值增加到2.75时,在Ga电极(-0.93 V)上和Cu/In电极(-1.14 V)上都出现了H+的还原峰,这正是由于H+的浓度很低,由浓差极化引起的电流密度极大值.而当pH值增大到5.00时,H+浓度很低,析氢反应主要由(2)式的水分子还原为主,析氢电位负移,反应基本不受pH值影响.从图2(b)的回扫曲线可以看到,在pH为1.40时,在-0.30 V出现In了的氧化峰,同时能观察到-0.10 V-0.20 V之间CuIn合金和Cu的氧化电流;当pH值为2.75时,仅仅能观察到In的氧化峰并且较pH为1.40所覆盖的面积明显减小,这说明Cu/In电极金属In的含量明显减少.没有CuIn合金和Cu的氧化电流,说明在电极表面形成了一层氧化膜,阻止了反应的发生;当pH值为5.00时,曲线上无In和Cu的氧化峰,说明电极在回扫过程中完全被钝化.结果表明,随着pH值的增大,在回扫过程(即阳极氧化过程)中电极表面的氧化和钝化作用明显增强.

图2 不同pH值的衬底1 mol·L-1氨基磺酸钾空白溶液在Ga电极(a)和Cu/In(b)上的循环伏安扫描曲线Fig.2 Cyclic voltammograms obtained in 1 mol·L-1KSO3NH2bath with different pH values onGa(a)and Cu/In(b)substrates
在空白溶液中加入0.01mol·L-1Ga2(SO4)3后, Ga在溶液中以多种形式存在,根据Medusa软件对溶液中各物质的平衡常数的计算结果,24在酸性溶液中的Ga主要以Ga3+、Ga(OH)2+和GaOOH多种形式存在,如图3所示.计算表明,当pH值大于1.55时,溶液变得不稳定,随着pH值的增高,逐渐出现GaOOH沉淀.但是实验中发现,新配置的Ga溶液的pH值最高为2.75时不出现沉淀,而当溶液静置一周后容器壁会有少量的白色沉淀生成.由于H+浓度降低有利于活泼金属沉积时电流密度的提高,因此实验中,对比了1.40和2.75两个pH值下的溶液对Ga沉积的影响.

图3 含Ga物质种类摩尔分数(x)随pH值变化模拟计算图Fig.3 Calculated Ga molar fraction(x) diagrams for change of pH value[Ga3+]tot=20.00 mol·L-1
图4是1 mol·L-1的氨基磺酸钾溶液中加入0.01 mol·L-1Ga2(SO4)3分别制成pH值为1.40和2.75溶液在Ga电极和Cu/In电极上进行循环伏安扫描.对于Ga电极,如图4(a)所示,与图2(a)相比较由于Ga的沉积,相同电位下的电流密度均有明显增加.在pH值为1.40时,循环曲线在-1.54 V出现了交叉,在pH值为2.75时,曲线在-1.60 V出现了还原峰,Flamini等15实验证明了在玻碳电极上,当pH值为2.5时,Ga的还原峰在-1.56 V,因此,曲线反映的正是金属Ga在两pH值下的还原峰位.Ga电沉积的反应方程如下:

图4 不同pH值在KSO3NH2,0.01 mol·L-1Ga2(SO4)3浴中Ga衬底(a)和Cu/In衬底(b)上的循环伏安扫描曲线Fig.4 Cyclic voltammograms obtained in 1mol·L-1 KSO3NH2,0.01 mol·L-1Ga2(SO4)3bath with different pH values on Ga(a)and Cu/In(b)substrates

对于Cu/In电极,如图4(b)所示,在pH值为1.40时,循环曲线在-1.44 V出现了交叉,说明Ga在此pH值下在Cu/In电极上有成核的异相生成.但是在pH值为2.75时,由于析氢反应,Ga的反应不很明显.在回扫曲线中,当pH值为2.75时,与图2(b)相比,-0.64 V即出现In的氧化电流,In的氧化峰提前至-0.43 V,这是由于Ga在Cu/In电极上沉积,防止了部分电极表面氧化,因此,在较正电位同样出现了Cu-In合金以及Cu的氧化电流.
恒电位沉积实验表明,在Cu/In电极上,从-1.00 V开始就可以电沉积得到Ga,如表1所示.当pH值较小为1.40时,随着沉积电位的变负,Ga的沉积量逐渐增加,但是由于H+的浓度很大,Ga的沉积效率很低,当电位变负至-3.00 V时,Ga的沉积量大大增加.当pH值较大为2.75时,由于H+的浓度很小,Ga的沉积效率提高.随着电位逐渐变负,如图4 (b)所示,以(1)式为主的析氢反应电流密度迅速达到饱和,电流密度的增加,仅是电沉积Ga部分的电流密度的增加,Ga的沉积效率大大提高,因此,电位为-1.40 V时,薄膜中Ga的摩尔分数(x)达到了14.88%.当电位变负至-2.00 V时,Ga的沉积量减小,这是由于-1.60 V后,开始发生(2)式水还原生成氢气的反应,Ga的电流密度比例下降.当电位负至-3.00 V时,Ga的沉积量与pH值为1.40的Ga溶液沉积出的Ga量相当,说明当电位较负时(<-2.00 V),还原反应主要由(2)式的水还原反应和(6)式的Ga还原反应竞争,与pH值无关.
图5是不同电位下Cu-In-Ga薄膜的XRD图,从图中可以看出,无论pH值大小,当沉积电位正于-2.00 V时,薄膜主要存在CuIn、Cu、In和Ga2O3相,观察不到Ga的单质峰,可能Ga以非晶的形式存在.当电位为-3.00 V时,薄膜中出现大量CuGa2相, CuIn相和CuxIny相消失,In的单相峰有明显增强.这可能是Ga在电沉积过程中,逐渐向薄膜内部扩散,穿过In层,在Cu/In界面与CuIn相和CuxIny相反应生成CuGa2相和In相.根据金属的固态扩散理论, Ga向薄膜内部扩散,主要是由于In层晶粒很小,通过谢乐公式可以算出In的晶粒大约为44 nm,因此, In薄膜存在大量的晶界,Ga以晶界扩散为主快速穿过In层到达Cu/In界面,而CuIn晶粒尺寸较大(大约91 nm)晶界较少,晶界扩散速率大大减弱.由于CuGa2相与单质In和Ga相同为体心四方结构,而CuIn相为简单单斜结构,因此,容易发生相的转变,反应方程可能如下:

表1 在Cu/In衬底上电沉积600 s Ga得到的薄膜成分Table 1 Compositions of the films electrodeposited Ga on Cu/In substrate for 600 s

在-1.40和-1.60 V沉积时,薄膜成分中Ga的含量较高,相应的XRD图中虽然没有CuGa2相,但是In的单相峰有明显增强,如图5(b)所示.这也说明了Ga在电沉积过程中,逐渐向薄膜内部扩散,并发生了(7)式的反应.

图5 不同电位下制备的Cu-In-Ga薄膜的XRD图Fig.5 XRD patterns of Cu-In-Ga film prepared at different potentials(a)pH=1.40;(b)pH=2.75
为了证明上述反应和过程,在pH值为1.40的Ga溶液中,重新做循环伏安扫描实验,将扫描的电位范围扩展到-3.00 V,对扫描试样进行了XRD和XRF测试.扫描后试样成银灰色,说明试样残留有In或Ga及其化合物.通过XRF测试发现,试样经过扫描后各元素摩尔比从原先的n(Cu)/n(In)/n(Ga)= 55/45/0变为n(Cu)/n(In)/n(Ga)=75/3/22,损失了大量的In的同时沉积了大量的Ga,这说明Ga在回扫过程中没有发生阳极氧化反应,并且没有因为In的反应而损失,同样说明了由于Ga在沉积过程中扩散穿过了In层,所以不会被In的反应所影响.从图6(a)扫描曲线可以看出,In的损失主要是由于在回扫过程中In阳极氧化.曲线中,In的氧化峰并没有因为扫描电位变负而减小,说明试样没有因为Ga的沉积或是形成In和Ga氧化膜,而阻碍In阳极反应;曲线仍存在CuIn合金的氧化电流,是因为沉积的Ga时间较短,(7)式的反应不完全所致,这同样说明Ga在沉积过程中扩散穿过了In层.从图6(b)的XRD图可以看出,试样经过完整的扫描后,残留物质主要是Cu和CuGa2合金,还有少量没有反应完全的In.这进一步证明了在Ga沉积过程中,Ga逐渐向薄膜内部扩散,穿过了In层,在Cu/In界面发生(7)式的反应.
从溶液pH值比较实验结果来看,对较小的pH值,溶液有很高的稳定性,而对较高的pH值,溶液的电沉积Ga的电流效率较高,但是当电位较负时(<-2 V),电流效率主要由(2)式水还原反应和(6)式进行Ga还原反应,与pH值无关,因此,较小pH值的溶液更加适合Ga电沉积.在沉积实验中,还发现Ga在电沉积过程中,逐渐向薄膜内部扩散,在Cu/In界面与Cu-In合金反应生成CuGa2.
3.3 三乙醇胺对Ga沉积的影响

图6 (a)Ga溶液循环伏安扫描曲线,(b)试样的XRD图Fig.6 (a)Cyclic voltammograms of Ga solution,(b)XRD pattern of the sample
通过pH值的讨论,我们选定pH值为1.40的溶液进行研究,沉积Ga的电位在-2.00--3.00 V之间,这样电流效率与pH值无关,因此在研究三乙醇胺对Ga溶液影响时,将循环伏安扫描曲线的电位范围扩展到-3 V.图7为含有0.015 mol·L-1三乙醇胺的Ga溶液在Ga和Cu/In电极上的扫描曲线图,从图7(a)中可以看出,对于Ga电极,加入三乙醇胺前后析氢电位(以0.5 mA·cm-2电流密度的电位衡量)分别为-0.85和-0.90 V.当溶液中不含有三乙醇胺时,电位扫描至-2.50 V时,电流密度达到极值,而加入三乙醇胺时,电流密度极值提前到-2.00 V;同样,曲线回扫时,出现电流密度极值的电位,未加入三乙醇胺的溶液(-1.75 V)比加入三乙醇胺的溶液(-1.60 V)更负.扫描曲线出现电流密度的极值,主要是由于(2)式水还原反应,当电位很负,消耗水的反应速度大于水扩散至电极表面的速度时,由于浓差极化的影响,电流密度达到饱和,出现极值.加入三乙醇胺后,电流密度极值提前,说明三乙醇胺吸附在Ga电极表面,阻碍了水向电极表面扩散.3.2节提到当电位较负时(<-2.00 V),电流密度主要是由(2)式水还原反应与(6)式Ga3+还原反应提供,水还原反应的电流密度提前达到饱和,有利于Ga电沉积电流效率的提高.在Cu/In电极上,三乙醇胺的作用与在Ga电极上一致,如图7(b)所示.
在Cu/In衬底上,恒电流密度100 mA·cm-2沉积100 s,XRF测试成分结果如表2所示,从表中可以看出,当溶液中加入三乙醇胺后,Ga含量有明显上升.从图7分析可知,加入三乙醇胺后,相同电流密度下的沉积电位大于无三乙醇胺的溶液.由于水还原反应趋于饱和,而Ga3+还原反应由于反应速度较慢,反应过程仍有电化学极化控制,使得在更高的电位下,Ga3+还原反应产生的电流占总电流比例增大,因此,恒电流沉积时,溶液中加入三乙醇胺后Ga含量有明显上升.图8为有无三乙醇胺溶液Ga恒电流密度100 mA·cm-2的沉积曲线,证实了当溶液加入三乙醇胺后,相同电流密度下的沉积电位大于无三乙醇胺的溶液.

图7 有无0.015 mol·L-1三乙醇胺的Ga溶液(pH=1.40)在Ga(a)和Cu/In(b)衬底上的扫描曲线Fig7 Cyclic voltammograms obtained in the Ga solution(pH=1.40)with or without 0.015 mol·L-1triethanolamine (TEA)on Ga(a)and Cu/In(b)substrates
图9是有无三乙醇胺溶液Ga电沉积的XRD图,从图中可以看出,当溶液中无三乙醇胺时,薄膜存在In、Cu、CuIn和Ga2O3相,而加入三乙醇胺后,薄膜中CuIn相和Ga2O3相消失,CuGa2相出现.这说明三乙醇胺除了有提高Ga电沉积电流效率的作用,还有对电极保护的作用.薄膜中可能有非晶的单质Ga存在,因为在Ga电沉积后,薄膜颜色和状态有明显变化,如图10所示.

表2 在Cu/In衬底上100 mA·cm-2的电流密度下沉积100 s时Ga的薄膜成分Table 2 Compositions of the films electrodeposited Ga on Cu/In substrate at 100 mA·cm-2for 100 s

图8 有无三乙醇胺溶液Ga在恒电流密度100 mA·cm-2下的沉积曲线Fig.8 Galvanostatic Ga-deposition curves at a constant current density of 100 mA·cm-2from the solutions with or without TEA
3.4 电沉积CIG金属预置层的硒化与电池制备
在Cu/In金属薄膜上,以100 mA·cm-2的电流密度恒电流沉积Ga膜,使得薄膜各元素摩尔比接近n(Cu)/n(In)/n(Ga)=46/40/14.所制备的Cu-In-Ga金属预置层,先在250°C无硒真空环境下热处理20 min,然后在550°C衬底温度下硒化30 min.
图11为合金化和硒化处理后的薄膜XRD图. Cu-In-Ga金属预置层,经过合金化处理后,薄膜主要形成Cu9Ga4和In的相,如图11(a),这样使薄膜形成合金降低熔点,在硒化过程中提高薄膜的附着力,这与溅射Cu-In-Ga金属预置层合金化结果基本一致.25经过硒化处理,CIGS薄膜出现了CIS-CGS两相分离,如图11(b).这是由于CIS比CGS更容易形成,导致薄膜纵向形成In和Ga的分布不均匀,使得薄膜出现CIS-CGS两相分离.从硒化处理后CIGS的断面SEM图也可以看出,薄膜表面形成CIS的大晶粒,而薄膜背电极附近晶粒细碎,这正是Ga富集的现象,见图12(b).
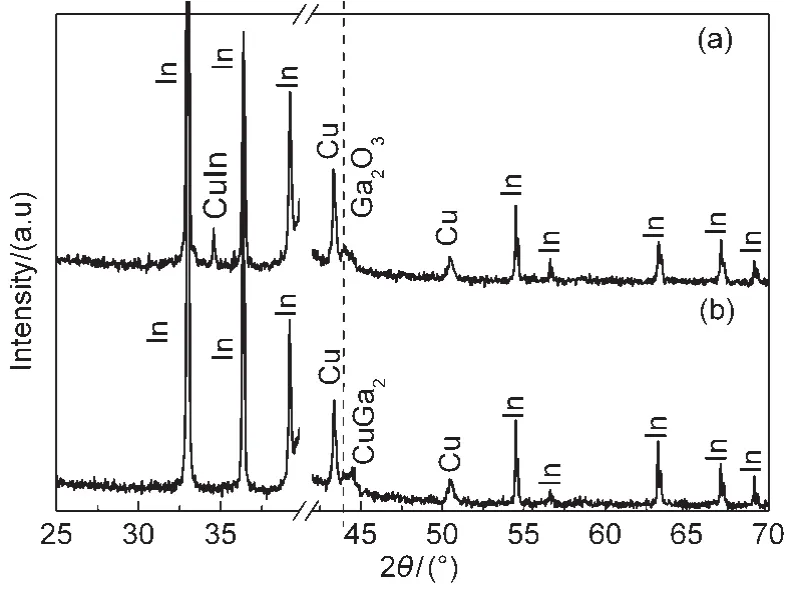
图9 有无三乙醇胺溶液Ga薄膜的XRD图Fig.9 XRD patterns of the film prepared from the solutions with or without TEA(a)without TEA;(b)with 0.015 mol·L-1TEA

图10 (a)制备的Cu、Cu-In和Cu-In-Ga金属预置层薄膜;(b)制备的Cu-In-Ga薄膜的表面SEM图Fig.10 (a)Cu,Cu-In and Cu-In-Ga films;(b)surface SEM image of Cu-In-Ga film

图11 (a)250°C合金化后Cu-In-Ga金属预置层XRD图;(b)硒化后的CIGS薄膜XRD图Fig.11 (a)XRD patterns of Cu-In-Ga metallic precursor annealed at 250°C;(b)XRD patterns of the CIGS film after selenizingGIS:CuInSe2;CGS:CuGaSe2

图12 550°C硒化后CIGS薄膜的SEM图Fig.12 SEM images of CIGS film after selenizing at 550°C
对CIGS薄膜进行电池的后续制备,得到了9.42%转化效率的电池.图13是测得电池的J-V曲线和电池参数,从电池测得的结果来看,由于Ga在背电极处富集,没有起到增大开路电压的作用,并且由于所制备CIGS表面粗糙,CIGS与CdS界面符合严重,同样影响了填充因子和开路电压.
4 结论

图13 CIGS太阳电池J-V曲线Fig.13 J-V curve for CIGS solar cell Voc:open circuit voltage;JSC:short circuit current density; FF:fill factor;η:efficiency
针对所沉积Ga金属和前置薄膜Cu/In为活泼金属的特点,详细研究了导电盐对Cu/In以及金属Ga的影响,发现氨基磺酸盐溶液最适合在Cu/In电极上电沉积Ga金属薄膜.研究了pH值对Ga沉积的影响,发现在较正的电位下,较高的pH值Ga溶液具有较高的电流效率,而在较负的电位下,Ga沉积的电流效率与pH值无关.在研究Ga的沉积过程中发现, Ga在沉积过程中逐渐向薄膜内部扩散,在Cu/In界面与CuIn合金反应生成CuGa2合金与In.在溶液中加入了常用缓蚀剂三乙醇胺,并研究了其对Ga电沉积的影响,发现三乙醇胺由于其吸附性,阻碍了水向电极表面扩散,使水还原反应的电流密度迅速达到饱和,有效地提高了Ga的沉积效率.用XRD、XRF和SEM对所制备的金属Ga薄膜进行了表征,并在Cu/In薄膜上制备出覆盖度好、均匀光亮的金属Ga薄膜.对符合化学计量比的Cu-In-Ga金属预置层进行了硒化处理和电池制备,电池转化效率达到了9.42%.
(1) Savadogo,O.Solar Energy Materials and Solar Cells 1998,52, 361.doi:10.1016/S0927-0248(97)00247-X
(2) Viswanathan,S.S.;Choi,I.H.;Lee,C.W.Solar Energy 2011, 85,2666.doi:10.1016/j.solener.2011.08.003
(3) Pandey,R.K.;Sahu,S.N.;Chandra,S.Handbook of Semiconductor Electrodeposition;Marcel Dekker Inc.:New York,1996.
(4) Gutay,L.;Bauer,G.Thin Solid Films 2007,515,6212.doi: 10.1016/j.tsf.2006.12.164
(5)Han,S.H.;Hermann,A.M.;Hasoon,F.S.;Al-Thani,H.A.; Levi,D.H.Appl.Phys.Lett.2004,85,576.doi:10.1063/ 1.1776616
(6) Hermann,A.M.;Gonzalez,C.;Ramakrishnan,P.A.;Balzar,D.; Popa,N.;Rice,P.;Marshall,C.H.;Hilfiker,J.N.;Tiwald,T.; Sebastian,P.J.;Calixto,M.E.;Bhattacharya,R.N.Sol.Energy Mater.Sol.Cells 2001,70,345.doi:10.1016/S0927-0248(01) 00076-9
(7) Hibberd,C.J.;Chassaing,E.;Liu,W.;Mitzi,D.B.;Lincot,D.; Tiwari,A.N.Prog.Photovolt.Res.Appl.2010,18,434.doi: 10.1002/pip.914
(8) Bhattacharya,R.N.;Hiltnerb,J.F.;Batchelora,W.Thin Solid Films 2000,361,396.
(9)Ao,J.P.;Yang,L.;Yan,L.;Sun,G.Z.;He,Q.;Zhou,Z.Q.; Sun,Y.Chin.Phys.Soc.2009,58(3)1870.[敖建平,杨 亮,闫 礼,孙国忠,何 青,周志强,孙 云.物理学报,2009,58 (3)1870]
(10)Ao,J.P.;Sun,G.Z.;Yan,L.;Kang,F.;Yang,L.;He,Q.;Zhou, Z.Q.;Li,F.Y.;Sun,Y.Acta Phys.-Chim.Sin.2008,24(6), 1073.[敖建平,孙国忠,闫 礼,康 峰,杨 亮,何 青,周志强;李凤岩,孙 云,物理化学学报,2008,24(6),1073]
(11) Ganchev,M.;Kois,J.;Bereznev,S.;Tzvetkova,E.Thin Solid Films 2006,511,325.doi:10.1016/j.tsf.2005.11.076
(12) Basol,B.M.Roll-to-roll Electroplating for Photovoltaic Film Manufacturing.US20080093221,2008-04-24.
(13) Basol,B.M.;Pinarbasi,M.;Aksu,S.;Wang,J.;Matus,Y.; Johnson,T.;Han,Y.;Narasinham,M.;Metin,B.Proc.23rd European Photovoltaic Solar Energy Conference,Valencia, Spain,2008.
(14) Bockris,J.OʹM.;Enyo,E.Journal of the Electrochemical Society 1964,109(1),48.
(15) Flamini,D.O.;Saidman,S.B.;Bessone,J.B.J.Appl. Electrochem.2007,37,467.doi:10.1007/s10800-006-9277-x
(16)Aragon,E.;Cazenave-Vergez,L.;Lanza,E.;Giroud,A.; Sebaoun,A.Brit.Corros.J.1997,32,263.
(17) Muller,S.;Holzer,F.;Desilvestro,J.;Haas,O.J.Appl. Electrochem.1996,26,1217.
(18) Standard Electrode Potential.http://wenku.baidu.com/view/ 89fe2f707fd5360cba1adb64.html
(19) Fang J.L.Theory&Application of Coordination Compounds in Electroplating;Chemical Industry Press,2007;pp 1-7. [方景礼,电镀配合物——理论与应用.化学工业出版社,2007:1-7.]
(20) Ribeaucourt,L.;Chassaing,E.;Savidand,G.;Lincot,D.Thin Solid Films 2011,519,7241.
(21) Ribeaucourt,L.;Savidand,G.;Lincot,D.;Chassaing,E. Electrochimica Acta 2011,56,6628.doi:10.1016/j. electacta.2011.05.033
(22) Li,D.Principles of Electrochemistry;Beihang University Press: Beijing,1999;pp 162-167.[李 荻.电化学原理.北京:北京航空航天大学出版社,1999:162-167].
(23) Zhang,L.M.;Fang,J.L.;Yuan,G.W.;Shen,P.H.Practical Electroplating Additive;Chemical Industry Press:Beijing, 2007;pp 418-419.[张立茗,方景礼,袁国伟,沈品华.实用电镀添加剂.北京:化学工业出版社,2007:418-419]
(24) Puigdomenech,Hydra/Medusa Chemical Equilibrium Database and Plotting Software.KTH Royal Institute of Technology, 2004.http://www.kemi.kth.se/medusa/.
(25) Marudachalam,M.;Birkmire,R.W.;Hichri,H.J.Appl.Phys. 1997,82(6),2896.
March 29,2012;Revised May 14,2012;Published on Web:May 15,2012.
Electrodepositied Gallium on Gallium and Copper/Indium Substrates
ZHANG Chao AO Jian-Ping*WANG Li JIANG Tao SUN Guo-Zhong HE Qing ZHOU Zhi-Qiang SUN Yun
(Key Laboratory of Optoelectronic Information Technology,Ministry of Education,Tianjin Key Laboratory of Photo-Electronic Thin Film Devices and Technology,Institute of Photo-Electronic Thin FilmDevices and Technique,Nankai University, Tianjin 300071,P.R.China)
We investigate the electrodeposition of gallium metallic precursor on gallium and Cu/In substrates from acidic aqueous solutions.The effect of the supporting electrolyte and the solution pH value for the electrodeposition of Ga is investigated by cyclic voltammetry.During Ga electrodeposition,gallium gradually diffuses into the film,and reacts with CuIn alloy to produce CuGa2at the Cu/In interface.We use triethanolamine to protect the Cu/In and Ga films from being oxidized,and thus this improves the current efficiency of Ga-electrodeposition.The Cu-In-Ga films are annealed in an Se atmosphere to produce Cu(In1-xGax)Se2(CIGS)thin films with high quality,and the efficiency of the solar cell prepared using these films is 9.42%.
Electrodeposition;Cu(In1-xGax)Se2;Cyclic voltammetry;Metallic precursor;Solar cell
10.3866/PKU.WHXB201205153
O646
∗Corresponding author.Email:aojp@nankai.edu.cn;Tel:+86-22-23508572.
The project was supported by Ph.D Programs Foundation of Ministry of Education of China(20090031110031).
教育部博士点基金(20090031110031)资助项目