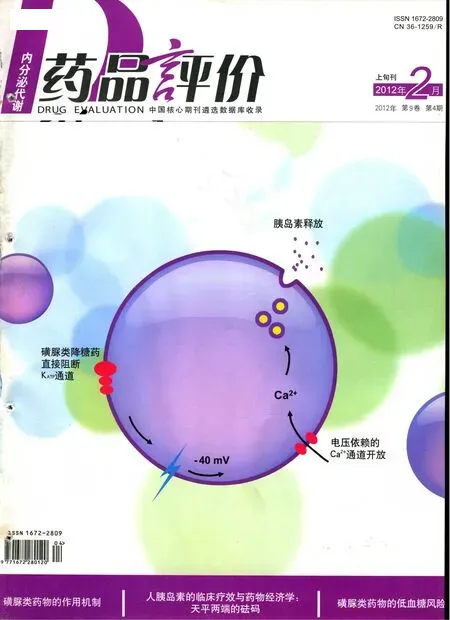
磺脲类药物的作用机制
中国人民解放军第305医院内分泌科 王彤 祝开思
作为一类重要的口服降糖药物,磺脲类药物从开始被发现并应用于临床到现在已有50多年的历史,并以其确切的降糖效果在临床工作中得以广泛应用。目前磺脲类药物共分为3代,第一代包括甲苯磺丁脲、氯磺丙脲、醋磺己脲和妥拉磺脲;第二代包括格列本脲、格列齐特、格列吡嗪、格列喹酮、格列波脲(克糖利)等;格列美脲为第三代。本文拟就磺脲类药物的具体作用机制进行深入探讨。
胰内降糖机制
磺脲类药物主要作用于胰岛B细胞膜上的ATP敏感性钾通道(KATP),该通道是由调节亚基磺脲类受体(SUR)和通道形成亚基内向整流钾通道(Kir)按1:1比例组成的异源性八聚体(SUR/Kir6.x),通过促使该通道关闭促进胰岛素释放是磺脲类药物的主要作用机制。磺脲类药物以及葡萄糖(通过转运、磷酸化、氧化代谢产生ATP)均可通过此机制刺激胰腺B细胞释放胰岛素[1,2]。因不同的磺脲类药物与SUR受体结合的部位和亲和力有所不同,其作用强度和作用时间也不同。现有研究表明,磺脲类药物刺激胰岛B细胞分泌胰岛素的分子机制包括以下两条途径:①依赖KATP途径:磺脲类药物通过特异性结合于B细胞膜上的SUR受体,使K+通道关闭,细胞内K+外流受阻,细胞内K+升高,使细胞膜去极化,从而触发L-型电压依赖性Ca2+通道开放,细胞外Ca2+内流增加,胞浆内Ca2+浓度升高,促进内含胰岛素原的囊泡和细胞膜结合及囊泡内容物外吐,从而完成了刺激胰岛B细胞向外分泌胰岛素的过程。这一过程可能由Ca2+/钙调蛋白依赖的蛋白激酶(CaMK)介导。②不依赖KATP通道的途径:近年来发现磺脲类药物对胰岛B细胞分泌作用并不仅仅局限于与B细胞膜上SUR结合的KATP途径。有研究表明,用[3H]标记的格列美脲和用[3H]标记的格列本脲可与B细胞内胰岛素分泌颗粒膜上的一种相对分子质量为65000的蛋白(gSUR)结合,使分泌颗粒内的pH值明显降低,引起分泌颗粒的胞吐分泌,从而增加胰岛B细胞的胰岛素释放量。通过对B细胞的电压钳研究还证实,磺脲类药物可不通过关闭KATP而直接加强Ca2+依赖的胰岛素分泌作用。这些均提示磺脲类药物具有不依赖KATP通道的促胰岛素分泌作用。Renstrom等[2]认为其分子机制如下:胰岛素分泌颗粒膜上的V-型质子泵(V-H+-ATPase)负责将H+泵入分泌颗粒内使颗粒内环境酸化,同时颗粒膜上的ClC-3氯离子通道将Cl-转运进入颗粒内以保持电中性,磺脲类药物与胰岛素分泌颗粒膜上的gSUR结合后,引起与之偶联的ClC-3氯离子通道活性增加,后者与分泌颗粒膜上的V-H+-ATPase协同作用,分别将细胞浆中的Cl-和H+转运入分泌颗粒内,使颗粒内的微环境极度酸化,从而引起胰岛素储存颗粒的胞吐作用增强,增加胰岛素分泌。分泌颗粒内pH值降低是胰岛素分泌颗粒释放的必要条件。
胰外降糖机制
磺脲类药物除对B细胞具有直接刺激作用外,还具有很多胰腺外作用。它可以增加脂肪细胞和胰岛素的结合,放大胰岛素的外周作用,同时可以减少肝糖输出[3]。近年采用葡萄糖钳夹技术研究发现,磺脲类药物可使人体外周葡萄糖利用增加10%~52%(平均29%),但也有研究者认为,此作用可能继发于葡萄糖毒性作用的改善。临床试验也发现,不同磺脲类药物具有各自独特的胰外作用途径。
大量研究表明,格列美脲在离体培养的脂肪细胞和肌肉中具有直接的拟胰岛素和胰岛素增敏作用[4]。其拟胰岛素信号是通过依赖吞饮小泡(Caveolae)/不溶于去污剂的富含糖脂筏(Detergent-insoluble glycolipidenriched rafts,DIGs)介导的。其可能的分子模式[4-6]为:格列美脲以一种不可饱和的和时间依赖的方式直接插入脂肪细胞/肌细胞细胞膜上的Caveolae/DIGs区紧靠糖基磷脂酰肌醇(GPI)-脂质的部位,通过直接影响DIGs的结构/组成和(或)通过诱导糖基磷脂酰肌醇(GPI)-磷脂酶C(PLC)的激活,使GPI-脂质/蛋白从DIGs释放,进而引起特异性的DIG/Caveolae成分的重新分布。结果,酰化的非受体酪氨酸激酶(non-RTK),如pp59Lyn(一种非受体酪氨酸激酶),从Caveolin分离并迁移至细胞膜的非DIG区而被解除抑制。这些过程伴随着Caveolin的酪氨酸磷酸化,进一步使pp59Lyn和Caveolin间的相互作用失去稳定或抑制它们重新结合。被活化non-RTK使胰岛素受体底物(IRS)蛋白在特定的酪氨酸残基磷酸化,进而发动代谢性的拟胰岛素信号,通过磷脂酰肌醇3激酶(PI-3K)通路沿着IRS下游的胰岛素信号级联传向脂质和糖原合成途径及葡萄糖转运(GLUT)4转位装置。格列美脲还可激活细胞内特异的蛋白磷酸化酶而促进葡萄糖转运子(GLUT)4/1的转位,激活糖原合成酶,降低糖原合成酶激酶3的活性,从而促进外周组织的葡萄糖利用[6]。
格列喹酮和格列吡嗪可与过氧化物酶体增殖物激活受体(PPAR-ɣ)紧密结合,并部分激活PPAR-ɣ受体,通过改变外周组织的胰岛素抵抗来发挥降糖作用[7]。
磺脲类药物与非磺脲类促泌剂降糖机制的区别
氯茴苯酸类(即格列奈类)为非磺脲类促泌剂,主要包括瑞格列奈、那格列奈和米格列奈,其与磺脲类药物一样均通过与胰岛B细胞膜上的SUR受体结合发挥促进胰岛素分泌作用,但格列奈类与磺脲类药物与受体的结合位点不同,且格列奈类不进入胰岛B细胞内,不抑制细胞内蛋白质(如前胰岛素原)合成,且不引起胰岛素的直接胞泌作用。与磺脲类相比,格列奈类具有“快开-速闭”的作用特点,与SUR结合、解离的速度均较迅速,因此起效迅速,持续作用时间短,又称为“餐时血糖调节剂”。此外,格列奈类对胰岛B细胞膜上的SUR选择性较高,而对心血管平滑肌上的SUR亲和性相对较低。
磺脲类药物的其他胰外作用机制
不同组织的KATP具有不同的SUR亚单位。胰岛B细胞的KATP由Kir6.2与SUR1组成,心肌的KATP由Kir6.2与SUR2A组成,血管平滑肌的KATP由Kir6.2与SUR2B组成。磺脲类药物不仅作用于胰腺KATP,也可同时作用于心肌KATP。当磺脲类药物与心肌Kir6.2/SUR2A受体结合时,使KATP通道关闭,影响了心肌的缺血预适应机制,不利于缺血时心脏的自我保护[8]。在生理情况下,由于心肌细胞内ATP水平很高,KATP通道保持关闭。当心肌缺血时,细胞内的ATP水平下降,导致KATP通道开放,加快心肌细胞的复极化,减少Ca2+内流,也可以增加Na+与Ca2+交换而增加Ca2+的排出,从而减轻Ca2+超负荷对心肌造成的损害,保护心肌细胞,这个过程称为心肌的缺血预适应机制。不同的磺脲类药物对SUR的亲和力各不相同。格列本脲与胰岛B细胞和心肌的KATP通道都有很高的亲和力,且不易与受体解离;甲苯磺丁脲和格列齐特对胰腺的Kir6.2/SUR1受体亲和力高,而对心肌的Kir6.2/SUR2A受体亲和力低,并且此类药物与受体的结合快速可逆;格列美脲对SUR受体的选择性也很高[9]。对于有缺血性心脏病的2型糖尿病患者,应尽量选用对胰岛B细胞的KATP通道有高度选择性的磺脲类药物。
磺脲类药物中的格列齐特,由于具有独特的氨基氮杂双环辛烷结构,具有清除自由基的能力,从而减少了氧化应激反应,因此除降糖作用外,还可以减少血小板的反应,刺激血管内皮前列环素的合成,增加纤溶作用,改善血管内皮功能[10,11]。
磺脲类药物对胰岛B细胞凋亡的影响
多项基础和临床研究认为,第一代和第二代磺脲类药物对胰岛B细胞有诱导凋亡增加的作用,其主要机制是K+通道关闭后Ca2+内流的超负荷和胰岛B细胞活化后产生的大量自由基损伤,但目前仍存争议[12,13]。部分基础和临床实验显示,新型磺脲类药物格列美脲具有较为独特的一面,它与胰岛B细胞结合力较弱,解离较快,能够在脂肪细胞中激活PPAR-ɣ,改善胰岛素抵抗。但是格列美脲对胰岛B细胞凋亡是否确实有保护作用还缺乏直接的实验证据[14,15]。
[1] Peter P, Frank R, Nick G, et al. Sulfonylurea stimulation of insulin secretion[J]. Diabetes, 2002, 51( Suppl 3): S368-376.
[2] Renstrom E, Barg S, Thevenod F, et al. Sulfonylurea-mediated stimulation of insulin exocytosis via an ATP-sensitive K+channelindependent action[J]. Diabetes, 2002, 51 (suppl 1): S332-336.
[3] Kolterman OG.Longitudinal evaluation of the effects of sulfonylurea therapy in subjects with type 2 diabetes mellitus[J]. Am J Med, 1985,79: 23-33.
[4] Dills DG, Schneider J, Glimepiride/Glyburide Research Group.Clinical evaluation of glimepiride versus glyburide in NIDDM in a double-blind comparative study[J]. Horm Metab Res, 1996, 28(9):426-429.
[5] Muller G. The molecularmechanism of the insulin-mimetic/sensitizing activity of the antidiabetic sulfonylurea drug[J]. Amaryl Mol Med,2000, 6: 907-933.
[6] Muller G. Dynamics of plasma membrane microdomains and cross–talk to the insulin signalling cascade[J]. FEB S Lett, 2002, 531: 81-87.
[7] ScarsiM, Podvinec M, Roth A, et al. Sulfonylureas and glinides exhibit peroxisome proliferator-activated receptor gamma activity:a combined virtual screening and biological assay approach[J]. Mol Pharmacol, 2007, 71(2): 398-406.
[8] Brady PA, Terzic A.The sulfonylurea controversy: more questions from the heart[J]. J Am Coll Cardiol, 1998, 31: 950-956.
[9] Ashcroft FM, Gribble FM.Tissue-specific effects of sulfonylureas:lessons from studies of cloned K(ATP) channels[J]. J Diabetes Complications, 2000, 14: 192-196.
[10] Renier G, Mamputu JC, Serri O.Benefits of gliclazide in the atherosclerotic process: decrease in monocyte adhesion to endothelial cells[J]. Metabolism, 2003, 8: S13-S18.
[11] Jennings PE.Vascular benefits of gliclazide beyond glycemic control[J]. Metabolism, 2000, 10: S17-S20.
[12] Kamp F, Kizilbash N, Corkey BE, et al. Sulfonylureas rapidly cross phospholipid bilayer membranes by a free-diffusion mechanism[J].Diabetes, 2003, 52(10): 2526-2531.
[13] Ling Z, Wang Q, Stange G, et al. Glibenclamide treatment recruits beta-cell subpopulation into elevated and sustained basal insulin synthetic activity[J]. Diabetes, 2006, 55(1): 78-85.
[14] ZabelBA, Ohyama T, Zuniga L, et al. Chemokine-like receptor expression bymacrophages in vivo: regulation by TGF2 beta and TLR ligands[J]. Exp Hematol, 2006, 34(8): 1106-1114.
[15] Roh SG, Song SH, Choi KC, et al. Chemerina new adipokine that modulates adipogenesis via its own receptor[J]. Biochem Biophys Res Commun, 2007, 362(4): 1013-1018.
- 药品评价的其它文章
- 降糖药物安全性评价
- 中国糖尿病患者餐后高血糖的药物治疗