降糖药物安全性评价
熊娜 王波 母义明 窦京涛 吕朝晖 巴建明 杨国庆 欧阳金枝
1解放军第261医院;
2解放军总医院药品保障中心;
3解放军总医院内分泌科
随着我国经济的迅猛发展,糖尿病的发生率迅速升高。中华医学会内分泌学会最新的流行病学调查资料显示,中国成人2型糖尿病的发生率已高达9.7%,全国患病人数达到9240万人,中国可能已经成为世界糖尿病患病人数第一大国[1]。上世纪90年代以来,糖尿病防治领域是医学界最活跃的治疗研究领域之一,很多新作用机制的口服药物和胰岛素纷纷上市,给糖尿病患者和医生带来了多种治疗选择,但降糖药物的安全性始终是临床医生为患者制订治疗方案的重要参考因素。本文就目前常用的非胰岛素类降糖药物安全性研究进展进行综述,希望对广大医生提供帮助。
1.双胍类
主要包括苯乙双胍和二甲双胍。其作用机制是通过改善胰岛素抵抗发挥降糖作用,具体包括抑制肝糖原输出、增加外周组织对葡萄糖的摄取、增加肠道葡萄糖的利用、减少脂肪细胞中脂肪的分解并降低游离脂肪酸水平。双胍类降糖药物并不通过刺激胰岛素分泌。苯乙双胍和二甲双胍相比,显著增加乳酸酸中毒的风险,目前已经基本被淘汰。
1.1 二甲双胍在糖尿病治疗指南中的地位
在当今循证医学时代,推荐
经验交流Experience和选择治疗方案时必须根据循证医学研究成果,以便使医师们能够有章可循地使用治疗药物。二甲双胍作为各国2型糖尿病治疗指南中的首选治疗药物正是基于循证医学研究的成果,尤其是英国糖尿病前瞻性研究(UKPDS)。综合起来,二甲双胍作为2型糖尿病一线用药的原因主要有:不增加糖尿病患者体重[2];是降糖作用最强的口服药物之一;不通过增加胰岛细胞负担发挥降糖作用[3];相比其他药物具有心血管保护作用[2];应用安全,单用较少引起低血糖[4];价格便宜。各国指南中均提出,2型糖尿病一经诊断,即可开始使用二甲双胍联合生活方式干预治疗,再根据患者血糖变化情况适当加用其他治疗药物或胰岛素。早期一些指南仅推荐首选二甲双胍作为肥胖的2型糖尿病患者的治疗,到2007年,全球的各种指南中,已经无需考虑患者体重,可用于所有2型糖尿病患者的治疗,除非有明确的使用二甲双胍的禁忌证。
1.2 胃肠道反应是二甲双胍最常见的不良反应
影响二甲双胍耐受性的主要不良反应是胃肠道反应,以腹泻和恶心多见。发生率相对较高(6%~43%)[5-13]。二甲双胍引起胃肠道不耐受的原因尚不明确,但该药物在胃肠道的浓度远远高于其他组织[14]。二甲双胍还能够延缓胆盐在空肠中的重吸收,进而改变了结肠中的渗透压和细菌活性[15,16]。二甲双胍引起胃肠道反应往往呈剂量依赖性[7,11],且多发生在用药的早期,多数患者可以随着用药时间的延长而逐渐耐受。临床观察发现,二甲双胍的服药时间和不良反应发生率呈一定相关关系,盐酸二甲双胍片饭后服用可有效降低胃肠道不良反应发生率。预防和避免二甲双胍引起的胃肠道不良反应的措施是“低剂量起始,缓慢加量”。目前市场上二甲双胍的生产厂家和制剂类型较多,实践证明,盐酸二甲双胍片较肠溶片和缓释片发生胃肠道不适比例高。因此,初次使用二甲双胍片不耐受的患者切不可轻易终止双胍类药物的治疗,可通过换用不同剂型、调整剂量和给药时间等方法使患者耐受并从双胍类药物治疗中获益。
1.3 双胍类药物与乳酸酸中毒
双胍类药物在1957年问世,1959年即有乳酸酸中毒的病例报道。乳酸酸中毒虽然发生率极低,但死亡率很高,过去一直备受争议,目前已经形成共识,认为苯乙双胍引起乳酸酸中毒的危险性是二甲双胍的10~20倍[17,18]。正因如此,苯乙双胍已经在大多数国家撤市。与苯乙双胍不同,二甲双胍不代谢、不抑制外周葡萄糖氧化,并且不促进外周乳酸生成。然而,它可能会减少从乳酸到葡萄糖的氧化(减少糖异生)并增加肠内和肝脏的乳酸生成。有一篇Corchrane荟萃分析比较了服用二甲双胍的患者和接受其他药物治疗的患者乳酸酸中毒的发生率[19]。总的来说,在206项研究中,总共有47096名患者,共随访了86067患者年。两组均无乳酸酸中毒发生。二甲双胍组和非二甲双胍组相比,乳酸酸中毒的危险在两组间无显著差异。研究结果显示,二甲双胍发生乳酸酸中毒的发生率为95%置信区间的上限是6.3例/100000人年,非双胍组是7.8例/100000患者年。使用双胍类药物发生乳酸酸中毒的多数患者均具有高龄、肝脏疾病、酗酒、急性或慢性肾衰、伴发低氧血症的慢性肺疾病等[20]。
1.4 二甲双胍禁忌证和应用注意事项
有肾损害、肝病、需药物治疗的充血性心衰、急慢性代谢性酸中毒或有乳酸酸中毒病史者不能应用二甲双胍治疗。二甲双胍会在肾功能受损的患者体内蓄积,导致乳酸酸中毒风险增加,因此,肌酐清除率<60ml/min或血肌酐水平>1.5mg/dl的患者不建议使用。患者由于合用其他药物导致的肾功能损伤也会导致乳酸酸中毒风险增加,因此,应用造影剂进行影像学检查前后48h应该临时停用二甲双胍。其他常见的易引起肾功能损伤的药物还有非甾体类消炎药、抗生素和ACEI或ARB类降压药。因此,糖尿病患者加用上述药品后应严密监测肾功能,必要时调整药物治疗。年龄大于70岁的老年人应该慎用二甲双胍,除非证明其肌酐清除率>60ml/min时可继续使用此药物。
1.5 二甲双胍的药物相互作用
酒精会减慢二甲双胍的排泄,并增加乳酸代谢。因此,服用二甲双胍的患者应该避免过量饮酒。西咪替丁增高二甲双胍的血浆浓度峰值60%,推荐选择其他H2受体拮抗剂或质子泵抑制剂或减少二甲双胍的剂量。
2.磺脲类药物
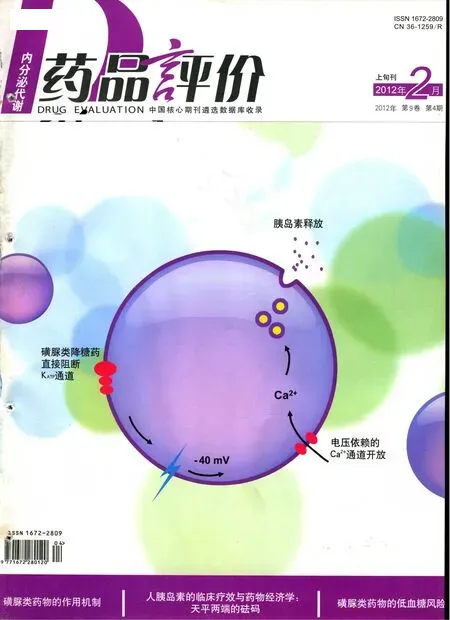
磺脲类药物是目前市场上价格最便宜、品种最多的一类口服降糖药物,是非肥胖的2型糖尿病患者首选治疗药物。此类药物主要通过与胰岛B细胞膜上的特异性磺脲类药物受体结合,导致ATP敏感的K+通道关闭,诱发细胞膜的去极化,引起细胞外钙离子内流,最终达到促进胰岛素分泌的作用。最早应用的磺脲类降糖药物,例如氯磺丙脲和甲苯磺丁脲,由于长半衰期和极易发生低血糖、抗利尿激素不适当分泌综合征等不良反应而逐渐被临床所淘汰。目前常用的品种有格列本脲、格列齐特、格列喹酮、格列吡嗪、格列美脲等。
2.1 磺脲类药物与低血糖
严格的血糖控制能够明显降低糖尿病微血管并发症的发生[21],然而导致糖尿病患者血糖达标率低的主要原因之一是低血糖风险[22]。此类药物主要通过直接刺激胰岛B细胞分泌胰岛素发挥降糖作用,因此,此类药物是所有口服药物中最易引起低血糖的药物。磺脲类药物发生低血糖的发生率约为2.4次/患者年,其发生率和严重性随着药物作用持续时间和药物效力的增加而增加[23]。氯磺丙脲和格列本脲引起的严重、持续低血糖的发生率大约是格列吡嗪的2倍。几乎所有发生于60岁以上老年人的口服药物性低血糖病例都与磺脲类药物有关。目前常用的格列本脲相比其他磺脲类药物,其半衰期最长、代谢产物仍具有降糖活性,是最易发生严重低血糖的磺脲类药物。因此,老年患者不宜使用格列本脲,使用其他磺脲类药物时同样需要注意预防低血糖发生。
2.2 磺脲类药物与体重增加
糖尿病患者的综合控制目标包括血糖、血压、血脂等代谢指标,还包括控制适当的体重。长期应用磺脲类药物均可以导致体重增加[2],但磺脲类药物通过降低血糖带来的心血管获益远大于体重增加造成的心血管风险的增加。此外,糖尿病患者还可以通过联合二甲双胍、GLP-1受体激动剂等药物最大限度地减少体重增加的风险。
2.3 磺脲类药物与肝肾功能
所有的磺脲类药物均通过肝脏代谢,理论上磺脲类药物有导致肝功能异常的风险,但是临床上因使用磺脲类药物导致的肝功能异常的报道非常罕见,且多为一过性的。由于磺脲类引起肝功能异常的发生率极低,因此,首次使用磺脲类药物的2型糖尿病患者无需增加监测肝功能的频次。肝脏疾病可作为引起严重、持续低血糖的一种独立危险因素,因为它减少糖原分解和糖原合成,此外,肝脏疾病者可能导致磺脲类药物代谢减慢。因此,肝硬化是磺脲类药物的相对禁忌证。此类患者应该首选胰岛素治疗,如果需要应用磺脲类药物,也需要短效磺脲类药物并从小剂量开始。
目前,尚未见应用磺脲类药物引起肾功能异常的报道,故无需担心磺脲类药物导致肾功能下降。磺脲类药物经肝脏代谢后,完全或部分需要经过肾脏排泄。因此,慢性肾功能不全的患者,应用磺脲类药物由于清除减慢,可能导致药物在体内的蓄积并引发低血糖。磺脲类药物中仅有格列喹酮被批准用于慢性肾功能不全的糖尿病患者,这是因为,仅有5%的药物经过肾脏排泄,其他绝大多数经过粪-胆途径排出体外。对于严重肝肾功能不全的患者,一切口服降糖药物均是禁用的,应尽早开始胰岛素治疗。
2.4 磺脲类药物应用注意事项
服用磺脲类药物的糖尿病患者如果不及时进食和运动量增加,则可能导致低血糖,因此,服用此类药物的患者均应该认识到规律进食和合理运动的重要性。1型糖尿病患者由于胰岛B细胞功能的绝对缺乏,不能使用磺脲类药物。目前尚无资料表明磺脲类药物对胎儿无害,因此妊娠妇女禁用。磺脲类药物可以经乳汁排泄,哺乳期妇女也禁用。磺胺类药物过敏者可试用小剂量该类药物,如无过敏反应则可根据血糖水平增加至适当剂量。伴有急性合并症如感染、手术等的糖尿病患者,此时由于应激因素导致血糖较前明显升高,应短期使用胰岛素治疗,待应激情况结束后根据血糖水平再调整为口服药物治疗。如前所述,严重肝肾功能不全时也应禁用磺脲类药物。
2.5 磺脲类药物相互作用
已报道的磺脲类药物相互作用多涉及第一代药物氯磺丙脲和甲苯磺丁脲。目前应用的磺脲类药物由于服用剂量小,似乎发生相互作用的可能性较小,但应用时仍应警惕与第一代磺脲类药物发生相互作用而产生具有临床意义事件的可能性。患者同时合并使用抗酸药、氯霉素、氯贝丁酯、多塞平、氟康唑、非诺贝特、肝素、甲基多巴、非甾体消炎药、华法林、磺胺类抗生素等药物时,在原有磺脲类药物剂量下需警惕发生低血糖风险。长期饮酒会增加甲苯磺丁脲肝脏代谢速度2倍,而短期摄入酒精会减慢其代谢50%。利福平会加快甲苯磺丁脲和格列本脲代谢,会减弱原有磺脲类药物剂量下的降糖作用。
3.糖苷酶抑制剂
本类药物主要包括阿卡波糖片和伏格列波糖片,此外还有米格列醇,主要通过抑制小肠刷状缘的双糖酶和淀粉酶,从而减慢碳水化合物的吸收发挥降糖作用。
3.1 胃肠道不良反应
阿卡波糖很少吸收入血,口服生物利用度仅有0.5%~1.7%。胃肠胀气、腹泻、腹痛是糖苷酶抑制剂最常报道的不良反应,主要是由于未吸收的碳水化合物在小肠中发酵引起的,可以通过缓慢增加药物剂量使之控制在最小限度。由于在远端空肠和终末回肠会发生α-糖苷酶诱导现象,所以胃肠道不适往往随时间的延长而改善。
3.2 阿卡波糖与肝功能异常
阿卡波糖由于极少吸收入血,一般认为该药物不会导致肝肾功能异常,但在阿卡波糖剂量≥300mg/d的研究中发现患者可能会出现转氨酶一过性升高[24]。因此,如患者使用较大剂量时仍应警惕肝功能损伤的可能。
3.3 阿卡波糖的禁忌证
尚没有对严重肾功能不全患者(血肌酐>2mg/dl)使用阿卡波糖的研究,因此,目前不建议在这类患者中使用。由于糖苷酶抑制剂的胃肠道反应,对于患有消化不良、肠道感染性疾病、胃肠道肿瘤、胃肠道手术或小肠梗阻者不推荐使用此类药物。
3.4 阿卡波糖应用注意事项
阿卡波糖单独应用不宜发生低血糖,但合用其他降糖药物或胰岛素后低血糖的发生风险增加。由于该药物抑制了淀粉酶和双糖酶,延缓了碳水化合物的吸收,因此,低血糖的救治应该以进食糖水或含糖饮料最为有效。
4.噻唑烷二酮类药物
噻唑烷二酮类药物常又被称为胰岛素增敏剂,其作用机制尚不完全清楚,已知的是它们结合胰岛B细胞核过氧化物酶增值激活受体ɣ(PPAR-ɣ),该受体存在于许多对胰岛素敏感的组织中(主要为脂肪组织,骨骼肌和肝组织中也有)。研究表明,此类药物可以降低肌肉和肝脏的胰岛素抵抗,由此促进葡萄糖利用和降低肝脏葡萄糖合成。胰岛素抵抗的改善降低了胰岛素、葡萄糖、游离脂肪酸和甘油三酯的水平[25]。目前应用的药物主要有罗格列酮和吡格列酮。此类药物上市之初,由于其不增加胰岛B细胞负荷,保护B细胞功能,给内分泌科医生和糖尿病患者带来了很大的希望,然而,由于其心血管系统的不良反应,导致此类药物尤其是罗格列酮应用前景不容乐观,欧盟在2010年已经宣布将罗格列酮撤市,中国和美国也相继发表声明宣称,除非证明其他药物无效的情况下才考虑选择罗格列酮。
4.1 水肿、体重增加和心血管风险
已报道噻唑烷二酮类药物可引起内皮细胞通透性增加而导致血容量增加(6%~7%)及周围水肿(5%~7%)[26,27]。当噻唑烷二酮类药物与胰岛素合用时,周围水肿的风险显著增加约15%[28]。应用罗格列酮和吡格列酮可出现剂量相关性的体重增加,原因可能为水钠潴留和脂肪堆积。体重增加的出现与皮下脂肪增加、内脏脂肪减少相关[29]。
对罗格列酮最重要影响的文献来源于Nissen教授的荟萃分析,该文指出:与使用其他治疗的对照组相比,在使用罗格列酮的患者中心血管不良终点事件的危险性增加[30]。文中还提示,使用罗格列酮会使心肌梗死的危险性增加43%(P=0.03);尽管心血管死亡的危险性也增加了64%,但未达到统计学显著性差异(P=0.06)。随后,经过了历时不长的争论与分析后,欧盟终于做出了将其撤市的决定。尽管如此,对于那些没有心功能不全病史、胰岛素抵抗严重的糖尿病患者使用此药物仍会获得比较好的疗效。
4.2 噻唑烷二酮类药物与骨质疏松风险
与正常人相比,1型糖尿病患者骨折风险增加7倍,而2型糖尿病同样会增加骨折发生风险。在降糖药物中,噻唑烷二酮类药物较双胍类和磺脲类,能够降低患者骨密度和增加骨折风险[31]。临床前研究证实了激活PPAR-ɣ系统能通过将间质干细胞转化成脂肪细胞而不是成骨细胞,从而抑制骨形成,格列酮类药物还可以增加破骨细胞活性而加速骨吸收。大量人类试验也已经证实格列酮类药物对健康受试者或2型糖尿病患者可以减少骨循环,加速骨丢失,破坏骨密度。此外,大样本、随机对照试验也观察到格列酮类药物具有增加患者骨折的风险,尤其是女性患者,对男性患者也可能有影响[32]。
4.3 噻唑烷二酮类药物与感染风险
美国和英国的一项联合研究表明,长期接受胰岛素增敏剂的糖尿病患者,罹患肺炎或下呼吸道感染的风险升高[33]。这项回顾性分析中,共纳入了13项研究中的17627例患者,与使用二甲双胍或磺脲类的对照组相比,噻唑烷二酮类药物显著增加各类肺炎或下呼吸道感染风险,相对风险1.40,严重肺部感染或下呼吸道感染风险比为1.39。
4.4 噻唑烷二酮类药物应用注意事项
此类药物起效较慢,往往需要2周起效,4周达到最大疗效,因此,医生有必要交代患者不能期望应用此类药物后在较短时间内控制血糖达标。基于上述此类药物的各种风险,在应用过程中应该严格限制适应证,例如有充血性心衰病史者应严禁使用此类药物,对于绝经期女性且具有骨质疏松风险者,应用此类药物前还要严格评估骨折发生风险,并在应用过程中做好适当的预防措施。最早上市的曲格列酮由于其肝毒性已经撤出了市场,罗格列酮和吡格列酮肝功能损伤的发生率虽然不祥,但应用此类药物后仍应注意监测肝功能。当ALT大于正常值3倍,或血清胆红素水平开始升高,或患者出现与肝炎相关的任何症状时,停用此类药物。1型糖尿病患者病理生理机制是以胰岛素绝对缺乏为主,较少伴有胰岛素抵抗,因此,噻唑烷二酮类药物禁用于1型糖尿病患者。
4.5 噻唑烷二酮类药物与其他药物的相互作用
吡格列酮诱导肝微粒体酶CYP3A4,因此,应用被此酶代谢的其他药物(如环孢霉素、他克莫司、他汀类、雌激素等)时,要警惕其药效降低的可能性。罗格列酮可能不抑制任何主要的CYP酶。
5.非磺脲类胰岛素促泌剂
此类药物作用机制类似于磺脲类降糖药物,但由于结合的磺脲类药物受体不同而发挥独特的药代动力学特点。具体表现为起效快,作用维持时间短,仅能降低餐后的血糖,故又称“餐时血糖调节剂”。
5.1 不良反应和应用注意事项
此类药物主要包括两种,即瑞格列奈和那格列奈。同样是通过刺激胰岛B细胞分泌胰岛素发挥降糖作用,因此,最常见的不良反应也是低血糖,发生低血糖的时间往往在下一餐前,因此,通过减少药物剂量和加餐可以很好地避免低血糖风险。瑞格列奈仅8%经过肾脏排泄,而那格列奈是75%,因此,轻度肾功能不全患者可以选择使用瑞格列奈,而不能应用那格列奈。其他注意事项类似于磺脲类降糖药物。
5.2 药物相互作用
在临床研究评估中,瑞格列奈不与地高辛、茶碱和华法林相互作用。此外,西咪替丁不影响其代谢。理论上,P450酶诱导剂(如利福平)可降低瑞格列奈疗效,而P450酶抑制剂(如抗真菌药物或大环内酯类抗生素)可增加其疗效。有研究表明,当吉非贝齐和伊曲康唑应用3天后可使瑞格列奈血药浓度-时间曲线下面积(AUC)分别增加28.6倍和8.1倍,联合应用则可使AUC增加70.4倍[34]。
6.GLP-1受体激动剂
人胰岛素的分泌受多种因素的调节,最重要的取决于胰岛B细胞分泌胰岛素的能力强弱,此外还与肠促胰素有关,即葡萄糖依赖的胰岛素释放肽(GIP)和胰高糖素样肽1(GLP-1)。进餐刺激后,GIP和GLP-1由肠道内分泌细胞分泌,继而发挥一定的降糖作用。有研究表明,2型糖尿病患者GLP-1分泌功能受损,提示肠促胰岛素分泌系统损伤也许是2型糖尿病病理生理基础之一[35]。外源性GLP-1能够降低2型糖尿病患者血糖水平[36]。GLP-1通过G蛋白偶联受体介导发挥生理作用,由于G蛋白偶联受体分布广泛,GLP-1可以作用于心脏、胃、肺、肠道、垂体、内皮、肾脏、胰腺和外周及中枢神经系统。因此,GLP-1显示出多种药理作用,例如:葡萄糖依赖的促进胰岛素分泌降低血糖、抑制胰高糖素的分泌、延缓胃排空以及抑制下丘脑摄食中枢增加饱腹感等[37]。后两种作用可以减少能量摄入。
2009年在我国上市的艾塞那肽注射液是GLP-1受体激动剂,上市以来,由于其降糖作用强、低血糖发生率低、能够明显减轻患者体重[38]等优势而备受关注,而其不良反应也一直是学者们关注的焦点之一。
6.1 胃肠道反应发生率高
在一项肠促胰素药物的荟萃分析研究中,与安慰剂组相比,以艾塞那肽为代表的GLP-1类似物发生恶心的风险比为2.9,发生呕吐的风险比为3.2[38]。上市前3期临床研究发现艾塞那肽发生胃肠道不良反应的概率约为40%,且呈剂量依赖性。实际上,研究过程中部分患者就因为不耐受胃肠道反应而停药。估计艾塞那肽相关的胃肠道不良反应发生率可能超过50%。除了常见恶心、呕吐、腹泻等消化道症状外,艾塞那肽引起的不适症状还有头晕、多汗等。
6.2 是否增加胰腺炎风险有待观察
自肠促胰素类药物上市以来,有关其是否会增加胰腺炎发生风险的争论和研究就未停止过。有研究发现,GLP-1受体激动剂能够调节胰腺炎相关的基因表达,但未增加试验小鼠的胰腺炎的易感性[39]。2010年发表了一篇回顾性的分析艾塞那肽、西格列汀与急性胰腺炎发生关系的研究,共有786656名患者纳入研究对象,其中分为糖尿病其他药物治疗组,艾塞那肽治疗组、西格列汀治疗组,非糖尿病组。以上各组发生急性胰腺炎的风险分别是5.6、5.7、5.6、1.9次/1000人年。糖尿病是非糖尿病患者发生急性胰腺炎风险的2.1倍,而使用艾塞那肽和西格列汀的患者发生胰腺炎风险与使用治疗糖尿病的其他药物治疗组无显著性差异。
6.3 是否存在肾功能损伤有待关注
从2005年4月28日到2008年10月29日,FDA不良事件报告系统共收到78例有关患者使用艾塞那肽出现肾功能改变的报告。其中包括62例急性肾功能衰竭病例和16例肾功能不全病例。急性肾功能衰竭或肾功能不全的发生时间范围从用药后3天到用药后2年。大多数患者(74/78,95%)至少具备一种肾功能改变的风险因素,如心功能不全、高血压、胰腺炎、横纹肌溶解、尿路感染或同时合并使用了其他药物。这些因素均可增加肾功能改变的风险。其中有42名患者(54%)出现了脱水的症状,例如腹泻或呕吐,这些是肾功能改变的已知风险因素,也是报告中使用艾塞那肽后发生的最常见不良反应。
在78名患者中有71名需要接受住院治疗,18名患者接受了透析治疗,并有2名患者需要进行肾脏移植。在78例报告中,有63名患者停用了艾塞那肽,其中39名在停药后症状有所好转。1名患者在重新使用艾塞那肽后再次出现了肾功能改变症状。自2005年4月至2008年9月,美国共开出660多万份艾塞那肽处方,因此,FDA认为收到的78例病例报告在所有使用该药物的患者中所占的比例很小。FDA仍要求对艾塞那肽说明书进行修订,内容包括:增加关于药品上市后引起急性肾衰竭和肾功能不全的病例报告,强调艾塞那肽不应用于严重肾损伤(肌酐清除率<30ml/min)或终末期肾病患者;建议医护人员给中度肾损伤患者(肌酐清除率为30~50ml/min)起始用药时或剂量从5μg增至10μg时应谨慎;建议医护人员仔细观察患者是否出现肾功能障碍症状,若怀疑肾功能障碍可能是由艾塞那肽引起时,应评估是否需要继续用药。
6.4 应用注意事项
艾塞那肽由于发生胃肠道不良反应比例较高,临床应用时应从小剂量(5μg,皮下注射,每日2次)起始,一个月后再调整为10μg 每日2次。无需根据血糖水平调整艾塞那肽剂量。虽然艾塞那肽与胰腺炎的关系尚未明确,但对于有胰腺炎病史或有胰腺炎多种危险因素的患者应该慎用艾塞那肽注射液。患者应用艾塞纳肽如果出现了严重的恶心、呕吐等不良反应,建议应该监测患者肾功能,防止出现肾前性肾功能损伤。
7.DPP-4抑制剂
生理性的GLP-1在体内会被二肽基肽酶-4(DPP-4)迅速灭活,使GLP-1的生理半衰期仅为1~2分钟[40]。DPP-4抑制剂可以通过增强内源性GLP-1的活性发挥降糖作用。目前已经上市的DPP-4抑制剂有西格列汀[41]。
7.1 西格列汀与感染风险
西格列汀虽然胃肠道不良反应发生率与安慰剂组类似,但大规模临床研究显示该药能够增加各种感染风险34%[42],还有文献报道西格列汀增加鼻咽炎风险20%,增加泌尿系感染风险50%[38]。
7.2 西格列汀应用注意事项
西格列汀由于作用相对比较温和,患者耐受性良好,可应用于轻中度肾功能不全的患者,对于重度肾功能不全患者,可以采用剂量减半(50mg/d)的用法。对发生胰腺炎和肾功能损伤风险方面的注意事项同艾塞那肽注射液。
7.3 需严密关注肠促胰素类药物安全性问题
DPP-4、腺苷脱氨酶复合蛋白及T细胞激活抗原CD26均为S9B蛋白家族的成员,该酶是2型跨膜转运糖蛋白,并在许多细胞表面均有表达,其生理功能绝大多数尚未被人类认知,该酶的催化活性和糖基化需要进行蛋白质的二聚化,而此过程可能改变该酶的生理功能且与淋巴细胞的成熟分化相关,进而影响到胰高糖素样肽1(GLP-1)和葡萄糖以来的肠促胰素(GIP)。西格列汀虽是高选择性的DPP-4抑制剂,但仍会对DPP-8和DPP-9产生影响。CD26在免疫系统激活和免疫功能紊乱发挥重要作用,临床前研究显示各种原因的感染发生风险增加似乎已经预示了这一点,但对人体是否产生更长远具有临床意义的影响,仍需长时间的临床观察和研究[43]。
[1] Wenying Yang, Juming Lu, Jianping Weng, et al. Prevalence of diabetes among men and women in China[J]. New England Journal of Medicine,2010, 362: 1090-1101.
[2] UK Prospective Diabetes Study Group. Effect of intensive blood glucose control with metformin on complications in overweight patients with type 2 diabetes[J]. Lancet, 1998, 352: 854-865.
[3] Saenz A, Fernandez-Esteban I, Matiax A, et al. Metformin monotherapy for type 2 diabetes mellitus[J]. Cochrane database of systematic reviews,2005, (3): CD002966.
[4] Goodarzi MO, Bryer-Ash M. Metformin revisited: re-evaluation of its properties and role in the pharmacopoeia of modern antidiabetic agents[J]. Diabetes, Obesity and Metabolism, 2005, 7: 654-665.
[5] Del Prato S, Erkelens D, Leutenegger M, et al. Simonth efficacy of benfluorex vs. placebo or metformin in diet-failed type 2 diabetic patients[J]. Acta diabetologia, 2003, 40: 20-27.
[6] DeFronzo RA, Goodman AM. Efficacy of metformin in patients with non-insulin- dependent diabetes mellitus[J]. N Eng J Med, 1995, 333:541-549.
[7] Garber AJ, Larsen J, Schneider SH, et al. Simultaneous glyburide/metformin therapy is superior to component monotherapy as an initial pharmacological treatment for type 2 diabetes[J]. Diabetes, Obesity and Metabolism, 2002, 4: 201-208.
[8] Jones KL, Arslanian S, Peterokova VA, et al. Effect of metformin in pediatric patients with type 2 diabetes: A randomized controlled trial[J].Diabetes Care, 2002, 25: 89-94.
[9] Hoffmann J, Spengler M. Efficacy of 24-week monotherapy with acarbose,metformin, or placebo in dietary-treated NIDDM patients: the Essen-Ⅱstudy[J]. The American Journal of Medicine, 1997, 103: 483-490.
[10] Garber AJ, Duncan TG, Goodman AM, et al. Efficacy of metformin in type 2 diabetes: results of a double-blind, placebo-controlled, doseresponse trial[J]. The American Journal of Medicine, 1997, 103: 491-497.
[11] Grant PJ. The effects of high- and medium-dose metformin therapy on cardiovascular risk factors in patients with type 2 diabetes[J]. Diabetes Care, 1996, 19: 64-66.
[12] Wulffele MG, Kooy A, Lehert P, et al. Effects of short-term treatment with metformin on serum concentrations of homocysteine, flote and vitamin B12 in type 2 diabetes mellitus: a randomized, placebocontrolled trial[J]. Journal of Internet Medicine, 2003, 254: 455-463.
[13] Giugliano D, Quatraro A, Consoli G, et al. Metformin for obese,insulin-treated diabetic patients:improvement in glycaemic control and reduction of metabolic risk factors[J]. European Journal of Clinical Pharmacology, 1993, 44: 107-112.
[14] Wilcock C, Bailey CJ. Accumulation of metformin by tissues of the normal and diabetic mouse[J]. Xenobiotica, 1994, 24: 49-57.
[15] Carter D, Howlett HC, Wiernsperger NF, et al. Differential effects of metformin on bile salt absorption from the jejunum and ileum[J].Diabetes, Obesity and Metabolism, 2003, 5: 120-125.
[16] Scarpello JH, Hodgson E, Howlett HC, et al. Effect of metformin on bile salt circulation and intestinal motility in type 2 diabetes mellitus[J].Diabetic Medicine, 1998, 15: 651-656.
[17] Bailey CJ, Turner RC. Metformin[J]. N Eng J Med, 1996, 334: 574.
[18] Gan SC, Barr J, Arieff AI, et al. Biguanide-associated lactic acidosis. Case report and review of the literature[J]. Arch Internet Med, 1992, 152: 2333.
[19] Salpeter S, Greyber E, Pasternak G, et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus[J].Cochrane Database Syst Rev, 2006, CD002967.
[20] Bruijstens LA, Van LM, Buscher-JPM, et al. Reality of severe metformin-induced lactic acidosis in the absence of chronic renal impairment[J]. Neth J Med, 2008, 66(5): 185-190.
[21] Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): Prospective observational study[J]. BMJ, 2000, 321: 405-412.
[22] The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J]. N Eng J Med, 1993, 329: 977.
[23] Groop LC. Sulfonylureas in NIDDM[J]. Diabetes Care, 1992, 15: 737.
[24] Coniff RF, Shapiro JA, Robbins D, et al. Reduction of glycosylated hemoglobin and postprandial hyperglycemia by acarbose in patients with NIDDM. A placebo-controlled dose-comparison study[J]. Diabetes Care, 1995, 18: 817.
[25] Spiegelman BM. PPAR-gammar: adipogenic regulator and thiazolidinedione receptor[J]. Diabetes, 1998, 47: 507.
[26] Mudaliar S, Henry RR. New oral therapies for type 2 diabetes mellitus:The glitazones or insulin sensitizers[J]. Ann Rev Med, 2001, 52: 239.
[27] Niemeyer NV, Janney LM. Thiazolidinedione-induced edema[J].Pharmacotherapy, 2002, 22: 924.
[28] Takeda Pharmaceuticals America, Inc. and Eli Lilly and Company[J].Actos Package Insert, July,2002.
[29] Kelly IE, Han TS, Walsh K, et al. Effects of a thiazolidinedione compound on body fat and fat distribution of patients with type 2 diabetes[J]. Diabetes Care, 1999, 22: 288.
[30] Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes[J]. N Eng J Med, 2007,356: 2457-2471.
[31] Rejnmark L. Bone effects of glitazones and other anti-diabetic drugs[J].Curr Drug Saf, 2008, 3(3): 194-198.
[32] Bodmer M, Meier C, Kraenzlin ME, et al. Risk of fractures with glitazones: a critical review of the evidence to date[J]. Drug Saf, 2009,32(7): 539-547.
[33] Singh S, Loke YK, Furberg CD. Long-term use of thiazolidinediones and the associated risk of pneumonia or lower respiratory tract infection:systematic review and meta-analysis[J]. Thorax, 2011, 66(5): 383-388.
[34] Niemi M, Backman JT, Neuvonen M, et al. Effects of gemfibrozil,itraconazole and their combination on the pharmacokinetics and pharmacodynamics of repaglinide: potentially hazardous interaction between gemfibrozil and repaglinide[J]. Diabetologia, 2003, 46: 347.
[35] Vilsboll T, Holst J. Incretins, insulin secretion and type 2 diabetes mellitus[J]. Diabetologia, 2004, 47(3) : 357-366.
[36] Zander M, Madsbad S, Madsen J, et al. Effect of 6-week course of glucagon-like peptide 1 on glucaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: A parallel-group study[J]. Lancet,2002, 359(9309): 824-830.
[37] Ban K, Noyan A, Hoefer J, et al. Cardioprotective and vasodialatory actions of glucagon-like peptide 1 receptor are medicated through both glucagon-like peptide 1 receptor-dependent and independent pathways[J]. Circulation, 2008, 117(18): 2340-2350.
[38] Amori RE, Lau J, Pittas AG. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta-analysis[J]. JAMA, 2007,Jul 11, 298(2): 194-206.
[39] Koehler JA, Baggio LL, Lamont BJ, et al. Glucagon-like peptide-1 receptor activation modulates pancreatitis-associated gene expression but does not modify the susceptibility to experimental pancreatitis in mice[J]. Diabetes, 2009, 58(9): 2148-2161.
[40] Vilsboll T, Agerso H, Krarup T, et al. Similar elimination rates of glucagon-like peptide 1 in obese type 2 diabetes patients and healthy subjects[J]. J Clin Endocrinol Metab, 2003, 88(1): 220-224.
[41] Rosenstock J, Sankoh S, List J, et al. Glucose-lowering activity of the dipeptidyl peptidase-4 inhibitor saxagliptin in drug-naive patients with type 2 diabetes[J]. Diabetes Obes Metab, 2008, 10(5): 376-386.
[42] Richter B, Bandeira EE, Bergerhoff K, et al. merging role of dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes[J]. Vasc-Health-Risk-Manag, 2008, 4(4): 753-768.
[43] Matteucci E, Giampietro O. Dipeptidyl peptidase-4 (CD26): knowing the function before inhibiting the enzyme[J]. Curr-Med-Chem, 2009,16(23): 2943-2951.
- 药品评价的其它文章
- 磺脲类药物的作用机制
- 中国糖尿病患者餐后高血糖的药物治疗