外源MeJA诱导烟草叶面防御反应
冯 琦,王 永,武东玲,魏跃伟,崔 红*
(1.河南农业大学烟草学院,郑州 450002;2.三门峡市烟草公司渑池分公司,河南 渑池 472044)
腺毛是植物表面的特化器官。作为植物“感受器”,它能够感受外界环境细微的压力并诱导一系列防御反应[1]。人们发现茉莉酸及其衍生物(JAs)对腺毛防御具有重要作用。外源茉莉酸可替代伤害刺激,有效地促进植物新生叶片腺毛密度大幅度增加[2-4]。烟草茎叶腺毛密布,种类繁多,分泌旺盛。在水分胁迫条件下,腺毛细胞中叶绿体类囊体膜降解,高电子致密物质逐渐增多[5],烟叶表面西柏三烯二醇的含量升高[6];在遮荫条件下,腺毛叶绿体类囊体片层发达,叶绿素荧光强烈,黑色嗜锇颗粒稀少,叶面西柏烷类化合物的含量大大降低[7]。逆境条件下腺毛形态学和物质代谢所发生的变化,说明烟草腺毛在烟株防御过程中具有重要作用,对其反应机制的深入解析是实现高效调控的重要前提。
本试验采用外源茉莉酸甲酯(MeJA)处理烟苗,并对叶片腺毛密度结构、叶面化学组分及蚜虫趋避性进行分析检测,研究MeJA对烟草腺毛形态发生、物质代谢和烟株抗性的影响,并探讨烟草腺毛防御系统的反应机制,为烟草腺毛防御代谢工程奠定理论基础。
1 材料与方法
1.1 材料
以烟草品种中烟100为材料,依照《优质烟栽培技术规范》进行漂浮育苗,成苗后移栽到花盆。1个月后选择生长态势一致的烟株,用 0.8 mM MeJA(无水乙醇含量 0.8%)充分喷施,对照组用0.8%的无水乙醇溶液处理,对照和处理组隔离3 d后,随机摆放在实验网棚中培养。试验于2011年6月1日移栽,8月30日结束,试验期间平均气温26.1 ℃。
1.2 试验方法
1.2.1 腺毛密度统计及形态观察 自烟株处理后,待顶部第1片新叶长到10 cm时,小心摘取,直接撕取叶片下表皮在MOTIC光学显微镜下统计腺毛密度[8]。新鲜叶片沿主脉两侧切下约5 mm×8 mm的平整小块叶片,直接使用VEGA Ⅱ LMU扫描电子显微镜(Tescan公司,捷克)观察叶片下表面腺毛形态及类型,并拍照。扫描电镜采用气体二次电子成像,工作电压 20 kV,工作距离 21 mm(21.25~21.70 mm),样品室和镜筒状态选用高真空(10-6Pa)。
1.2.2 叶面化学成分分析 采用有机溶剂萃取的方法[9],对MeJA处理后0、3、7、11 d的叶片进行叶面化学成分提取,并采用紫外分光光度计法[10]进行叶面化学成分总量检测。
对处理后第 7天的叶面化学成分进行 GC/MS检测:于二氯甲烷提取液中加入内标(2.020 mg/mL的蔗糖八乙酸酯和 2.542 mg/mL的正十七烷醇的500 mL二氯甲烷溶液)1 mL,旋转蒸发浓缩,硅烷化处理后,采用 GC/MS与微机联用进行定性、定量分析。色谱仪为HP-5890,质谱仪是vc-70SE。GC条件:色谱柱:DB-5MSUI石英毛细管柱(30 m×0.25 mm i.d.×0.25 μm d.f.);进样口温度:250 ℃;程序升温:40 ℃保持2 min,然后以6 ℃/min升温至180 ℃保持2 min,以2 ℃/min升温至280 ℃保持20 min;载气:高纯氦气;载气流速:恒流0.8 mL/min;进样量:1.0 μL,分流比:15:1。MS条件:传输线温度:250 ℃;EI离子源温度:280 ℃;电离能量:70 eV;质量数范围50~650 amu;检索谱库:NIST08。
1.2.3 叶面腺毛基因表达分析 叶片腺毛的获得:参照文献[11]的方法进行改良。选取幼嫩健康的叶片液氮中低温固定形态5 min,使用硬度适中的毛刷由叶基向叶尖方向将腺毛刷至盛有适量液氮的研钵中,每个样品刷取约100 cm2的叶片,刷取完成后直接研磨提取。
腺毛 RNA提取及反转录:RNA提取使用QIAGEN公司的RNeasy Plant Mini Kit试剂盒,反转录使用 NEWBIO INDUSTRY公司生产的M-MLV反转录酶,反转录的cDNA用于PCR检测。
引物设计:采用Premier Prime 5.0软件,根据Genbank发布的L25、DXR、CBT和CYP71D16序列设计各基因扩增引物(表1),用于PCR检测。其中L25是烟草核糖体蛋白[12],本研究中作为内参基因。
PCR检测:PCR反应体系为20 μL。PCR扩增程序为:94 ℃ 5 min 预变性;94 ℃ 30 sec变性,48~51 ℃ 30 sec退火(具体按各引物Tm值设定),72 ℃1 min延伸,共30个循环;72 ℃延伸10 min。
结果检测:PCR产物使用 1.5%琼脂糖凝胶进行检测,并使用 Manual BioSpectrum Imaging System(UVP公司,美国)进行观察拍照。
1.2.4 蚜虫选择性试验 分别选择处理与对照两片幼叶,分别置于15 cm直径的培养皿中;挑选健康的无翅蚜于一小玻璃杯中,将玻璃杯等距离倒扣在叶片之间,轻敲杯底使蚜虫掉落于培养皿上,移去玻璃杯,使蚜虫自由活动;于 24 ℃恒温光照培养箱中培养7 h后,统计处理与对照叶片上的蚜虫数。结果为3次重复的平均值。
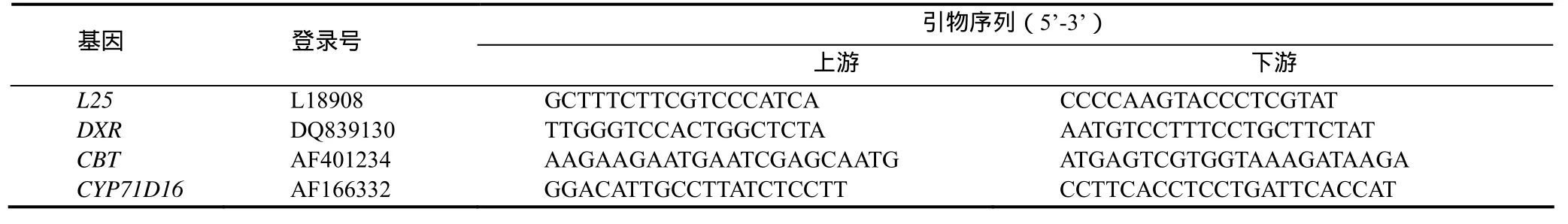
表1 扩增引物序列Table 1 Primer sequence
2 结 果
2.1 MeJA处理对腺毛形态发生的影响
MeJA喷施烟株后,对新叶进行扫描电镜观察,结果如图1所示。可以看出,MeJA处理烟株的新叶,腺毛密度高,且长柄多腺头腺毛较多,体型较大(图1-A),而对照烟株叶片腺毛密度相对较低,体型较小,长柄单细胞腺头腺毛较多(图1-B)。体视镜下对叶片下表皮的腺毛腺密度进行统计,结果如图2所示。可以看出,MeJA处理与对照相比,烟株新叶腺毛密度有所提高;但短柄腺毛以及无头腺毛密度差异不显著,长柄腺毛尤其是长柄多腺头细胞差异达到显著水平。
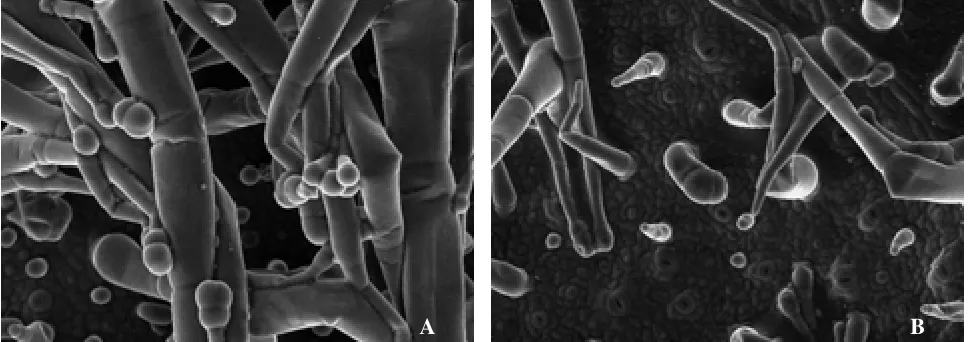
图1 MeJA处理对叶面腺毛形态的影响Fig.1 Effect of treatment on leaf trichomes shape

图2 MeJA处理对烟株第1片新叶腺毛密度的影响Fig.2 Effect of MeJA spraying on trichomes density of the first new leaf
2.2 叶面化学成分分析
利用分光光度法,对MeJA处理后不同时间的叶片进行叶面成分分析,叶面化学成分总量变化趋势如图3所示。可以看出,在第3天,MeJA处理的叶片和对照叶片在叶面化学成分含量上就有明显不同。虽然,随着时间的延长,对照烟株叶面分泌物也呈现缓慢上升的趋势,但MeJA处理能使烟株叶面分泌物含量大幅度提高,并在处理后第7天达到积累高峰,随后有所下降,但仍显著高于对照。
采用GC/MS技术,对处理后第7天的烟株叶面分泌物成分进行检测,峰值图如图4所示,结果见表2。从中可以发现,无论是在处理还是对照中,西柏三烯二醇都是叶面化学成分中含量最高的组分;在MeJA处理后,该组分含量显著增加,说明MeJA刺激诱导了该物质的生物合成和积累。烷烃类物质种类繁多,难以准确定性;与对照相比,MeJA处理叶片中烷烃类物质含量大多表现出小幅度增加的趋势。实验中检测到5种蔗糖酯类物质,与对照相比,在MeJA处理叶片中各有升降,但变幅不大,说明该类物质受MeJA的影响并不显著。

图3 叶面分泌物含量变化趋势Fig.3 Changes of leaf secretion

图4 MeJA喷施第7天叶面分泌物化学峰值比较Fig.4 Comparison of the leaf secretion on the 7th day
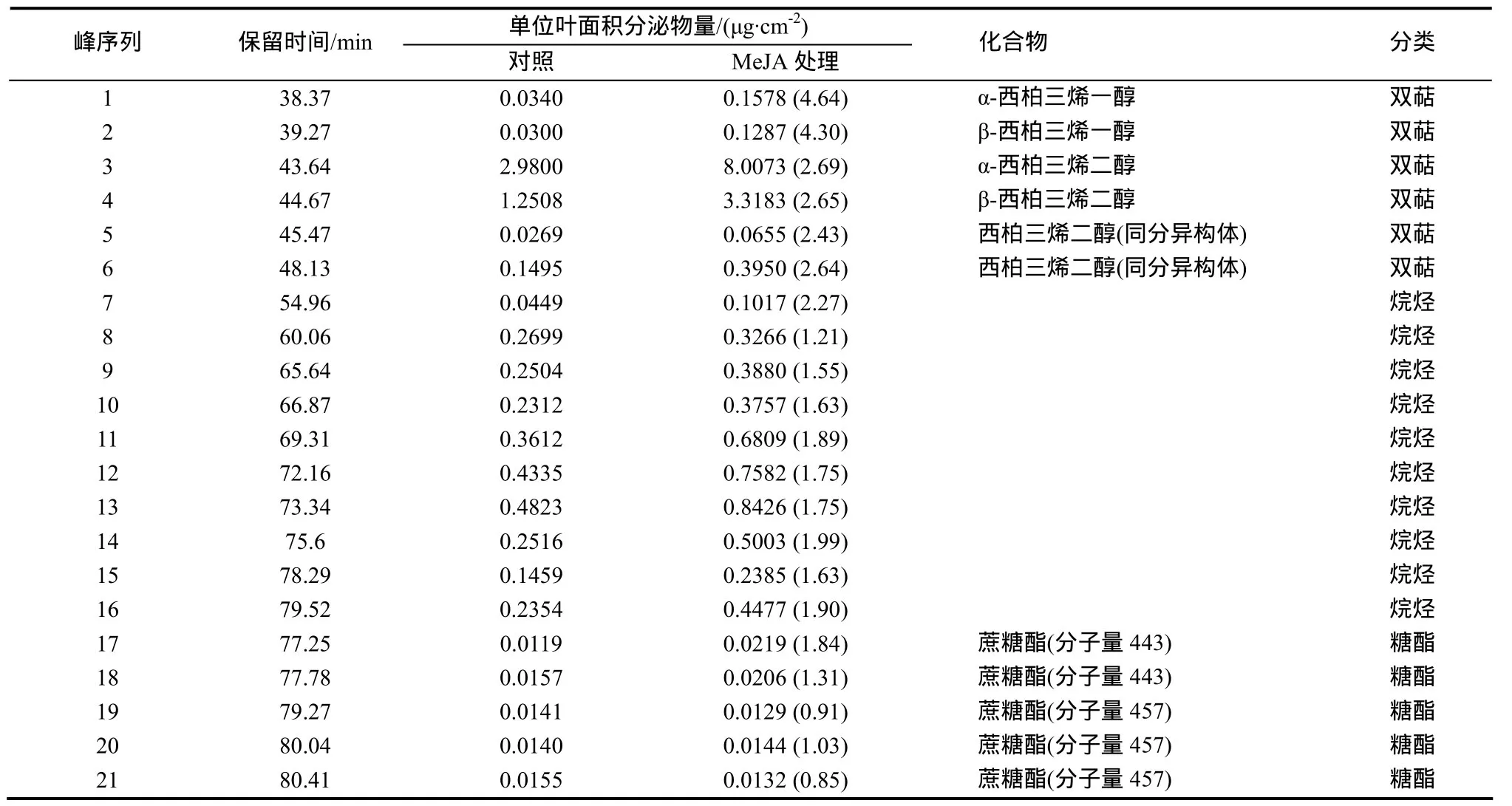
表2 MeJA喷施第7天叶面分泌物化学成分分析Table 2 Chemical constituents of the leaf secretion on the 7th day
2.3 基因表达分析
在MeJA处理后,分别在处理0 d和处理后1、2、3、4、5、6、7 d刷取叶面腺毛,提取腺毛总 RNA,利用RT-PCR技术检测萜类代谢相关基因转录水平的表达变化,如图5所示。脱氧磷酸木酮糖还原异构酶(DXR)催化脱氧磷酸木酮糖(DXP)形成甲基赤鲜糖醇-4-磷酸(MEP),是类萜代谢前体物质异戊二烯(IPP)合成的关键酶。西柏三烯一醇合成酶(CBT)是二萜环化酶,催化牻牛儿基牻牛儿基焦磷酸(GGPP)向西柏三烯一醇的转化,西柏三烯一醇羟化酶(CYP71D16)则催化西柏三烯一醇向西柏三烯二醇的转化。这三个酶的基因与叶面腺毛主要分泌物的合成密切相关,但RT-PCR结果表明,三基因的转录均未随MeJA的处理而发生明显的变化。
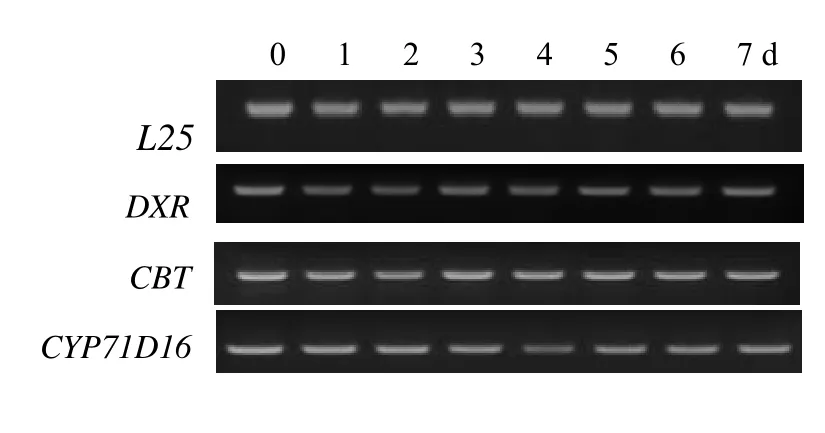
图5 腺毛二萜代谢相关基因表达分析Fig.5 Gene expression analysis by RT-PCR
2.4 MeJA处理对烟株蚜虫抗性的影响
MeJA喷施处理7 d后,对烟株幼叶进行蚜虫选择性实验。在放有处理和对照叶片的密闭容器中(图6-A),无翅蚜通过爬行寻找喜好的栖身之地。7 h之后,统计叶片上的蚜虫数目,发现更多的蚜虫集聚在未喷施 MeJA的叶片上(图 6-B)。表明MeJA处理使得叶片对蚜虫的驱避性增强。

图6 叶片对蚜虫的抗性比较Fig.6 Comparison of the leaf resistance to aphid
3 讨 论
烟株茎、叶表面覆盖着浓密的腺毛。它不仅形成了烟株与环境间的物理屏障,腺毛主要分泌物-西柏烷类二萜化合物也构筑了烟株抵御病原微生物侵袭的化学防线。由烟草腺毛构筑的烟草叶面防御体系,是烟株防御体系的重要组成部分,但目前人们对其反应模式及作用机制尚缺乏认识。
本实验采用MeJA喷洒烟株后,叶片对蚜虫的驱避效果证明烟草叶面防御能力得到了增强。处理后烟株新生叶片腺毛密度发生了明显变化,但只有长柄多腺头腺毛的差异达到了显著水平。长柄多细胞腺头腺毛是烟草腺毛中分泌最旺盛的类型,说明MeJA对烟草分泌型腺毛诱导的选择性。这与同样为多腺毛类型植物的番茄研究结果相同[2]。但在Traw等[4]的报道中,拟南芥腺毛虽为单一的非分泌型腺毛,它的发生也受到MeJA的强烈诱导,表明了不同植物中腺毛发生诱导机制的不同。在已发育叶片中,MeJA处理对腺毛密度和类型产生影响不大,但却使烟株叶面化学成分发生了明显变化,尤其是腺毛分泌物——西柏烷类化合物含量明显提高。在有关曼陀罗腺毛的研究[13]中报道,MeJA处理并不改变腺毛的密度及类型,却可以使腺毛主要分泌物acylsugars的含量提高44%。在番茄研究[14]中发现,MeJA处理可诱导腺毛单萜环化酶LeMTS1的活跃表达。但本实验中,对烟草叶面腺毛基因表达分析表明,与烟草腺毛分泌物——西柏烷类化合物合成相关的基因在转录水平并未受到MeJA的诱导。关于植物类萜代谢中DXS,DXR和HDR酶受到转录后调节已被研究所证实[15],因此推测烟草腺毛中二萜化合物的生物合成存在着相同的调节机制。
4 结 论
本研究发现:(1)喷施MeJA能诱导烟草叶面防御反应,使叶片对蚜虫的驱避性增强;(2)烟草叶面防御反应的主要表现是诱导了分泌型腺毛的发生,是导致西柏烷类化合物为主的叶面分泌物增加的主要原因;(3)西柏烷类化合物合成相关的基因在转录水平上并不受MeJA的诱导,推测烟草二萜代谢具有较复杂的转录后调节机制。
[1]Tooker J F, Peiffer M, Luthe D S, Felton G W.Trichome as sensors[J].Plant signaling & behavior, 2010(5):73-75.
[2]Boughton A J, Hoover K, Felton G W.Methyl jasmonate application induces increased densities of glandulartrichomes on tomato, Lycopersicon esculentum[J].Chem.Ecol, 2005, 31: 2211-2216.
[3]Kobayashi H, Yanaka M, Ikeda T M.Exogenous Methyl Jasmonate Alters Trichome Density on Leaf Surfaces of Rhodes Grass (Chloris gayana Kunth)[J].Plant Growth Regul, 2010 29: 506-511.
[4]Traw B M, Bergelson J.Interactive effects of jasmonic acid, salicylic acid and gibberellin on induction of trichomes in Arabidopsis[J].Plant Physiol, 2003, 133:1367-1375.
[5]张华,崔红.水分胁迫对烟草腺毛超微结构的影响[J].中国烟草学报,2008,14(5):45-47.
[6]Johnson A W.Tobacco leaf trichomes and their exudates[J].Tobacco Science, 1985, 29: 67-72.
[7]翁梦苓,崔红.遮阴对烟草叶片腺毛形态结构及分泌物含量的影响[J].河南农业大学学报,2008,42(6):613-616.
[8]时向东,刘国顺,韩锦峰,等.不同类型肥料对烤烟叶片腺毛密度、种类及分布规律的影响[J].中国烟草学报,1999,5(2):19-22.
[9]Nielson M T, Severson R F.Variation of flavor components on leaf surfaces of tobacco genotypes differing in trichome density[J].Agric Food Chem, 1990,38: 467-471.
[10]张小全,杨志晓,李钦奎,等.分光光度法定量测定烟草叶面分泌物含量研究[J].华南农业大学学报,2011,32(4):18-20.
[11]Erming W, Joseph D P.Suppression of P450 hydtoxylase gene in plant trichome glands enhances naturalproduct-based aphid resistance[J].Nature Biotechnology,2001, 19: 371-374.
[12]Schmidt G W, Delaney S K.Stable internal reference genes for normalization of real-time RT-PCR in tobacco(Nicotiana tabacum) during development and abiotic stress[J].Mol Genet Genomics, 2010, 283: 233-241.
[13]Hare J D, Walling L L.Constitutive and jasmonateinducible traits of Datura wrighti[J].Journal of Chemical Ecology, 2006, 32: 29-47.
[14]Van Schie C C, Haring M A, Schuurink R C.Tomato linalool synthase is induced in trichomes by jasmonic acid[J].Plant Molecular Biology, 2007, 64: 251-263.
[15]Cordoba, E M Salmi, P Leon.Unravelling the regulatory mechanisms that modulate the MEP pathway in higher plants[J].Exp Bot, 2009, 60(10): 2933-2943.

