3种微生态制剂对水质及刺参幼参生长的影响
武鹏,赵大千,蔡欢欢,王芳,高悦勉
(1.大连海洋大学 辽宁省水生生物学重点实验室,辽宁 大连116023;2.大连金砣水产食品有限公司,辽宁 大连116400)
微生态制剂又称益生菌,Kozasa[1]首次将其应用到水产养殖,此后得到迅速推广。已有研究表明,微生态制剂对刺参生长和免疫有良好的改善作用[2-9]。微生态制剂,不仅可以降解水中氨氮、亚硝酸氮和硫化氢等有害物质,还能改善养殖对象肠道微生态环境和分泌消化酶,提高饲料转化率,预防疾病,促进生长[10]。本试验中,作者研究了3种微生态制剂在不同浓度下对水质、刺参Apostichopus japonicus 幼参生长和免疫的影响,旨在为其在刺参养殖中的应用提供科学依据。
1 材料与方法
1.1 材料
试验用幼刺参(简称幼参)由大连金砣水产食品有限公司提供,幼参规格一致,鲜体质量为(0.7053 ±0.0046)g。
3种微生态制剂为免疫增强剂、复合芽孢杆菌和EM 菌,其中免疫增强剂主要成分为枯草芽孢杆菌、嗜酸乳杆菌、乳酸片球菌、产朊假丝酵母等活菌(60 ×108cfu/mL)以及免疫肽、氨基酸和独特生物活性因子,为深褐色液体,购自青岛绿海洋生物技术有限公司;复合芽孢杆菌主要成分为多种有益芽孢杆菌(30 ×108cfu/mL),为白色液体,购自大连神龙生物技术有限公司;EM 菌主要成分为海洋芽孢杆菌、海洋放线菌、海洋酵母等(50 × 108cfu/g),为红色固体粉末,购自潍坊东方海洋生物科技研发中心。生产上,一般将EM 菌加水配制成菌液后使用,1 g/m3(固体粉末)≈1 mL/m3(液体菌液)。
1.2 方法
1.2.1 试验设计与日常管理 试验设9 个处理组,其中A1、A2、A3 处理组分别投喂添加浓度为2、4、8 mL/m3的免疫增强剂饲料;B1、B2、B3 处理组分别投喂添加浓度为2、4、8 mL/m3的复合芽孢杆菌饲料;C1、C2、C3 处理组分别投喂添加浓度为2、4、8 mL/m3的EM 菌饲料;另设1 个对照组,只投喂基础饲料(主要成分为大叶菜藻液)。由于条件限制,每组设2 个重复。试验在100 L 的PVC 塑料桶中进行,试验水体为80 L,每桶放35头幼参。日投饵2次(7:00、17:00),投饵量为幼参体质量的5%。上午观察幼参的摄食情况,确定投饵量,下午清除残饵和粪便。日换水1次,换水量为水体的1/5,换水后将微生态制剂直接泼洒至水体中。试验期间,水温为12 ~16 ℃,盐度为31 ~32,连续充气。每隔12 d(换水前)测定水体中的pH 值及和含量。试验共进行60 d。
1.2.2 水质检测 用pHS -25 型测定仪测定pH值,采用纳氏比色法测定含量,采用萘乙二胺分光光度法测定含量[11]。
1.2.3 生长指标的测定 试验结束24 h 后,对每组幼参总体质量进行称量,计算特定生长率(SGR)和成活率:

式中:W0和Wf分别为试验初始和终末时幼参的均体质量(鲜质量,g);t 为试验时间(d)。
1.2.4 体腔液中免疫酶活力的测定 试验结束24 h 后,从每组随机挑选幼参5 头,抽取体腔液测定其免疫酶活力。
以羊腿股二头肌为取样点,每组分别从原料腿(0 d)、腌制结束(3 d)、风干前期(8 d)、风干中期(15 d)、风干后期(23 d)、成熟期(30 d)等六个工艺点取样,置于-20 ℃冷冻保藏,以备各指标的测定。
酸性磷酸酶(ACP)的测定:ACP 分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用,经铁氰化钾氧化生成红色醌衍生物,根据红色深浅测定酶活力的高低。酶活力定义:100 mL 体腔液在37 ℃下与底物作用30 min,产生1 mg 酚为1 个酶活力单位。
过氧化氢酶(CAT)的测定:CAT 分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,在405 nm 处测定其生成量,据此可计算出CAT 的活力。酶活力定义:每毫升体腔液每秒钟分解1 μmol H2O2的量为一个酶活力单位。
溶菌酶(LSZ)的测定:一定浓度的混浊菌液中,由于LSZ 能水解细菌细胞壁上肽聚糖使细菌裂解而浓度降低,透光度增强,然后根据透光度的变化来推测LSZ 的含量。
以上3种酶活力均采用南京建成生物工程研究所生产的专用试剂盒进行测定。
1.3 数据处理
试验数据均以平均值± S.E.表示,用SPSS 11.7 软件进行相关性检验、方差分析和LSD 多重比较,以P<0.05表示有显著性差异。
2 结果与分析
2.1 微生态制剂对养殖水体水质的影响
2.1.1 pH 值 整个养殖过程中,处理组和对照组养殖水体中的pH 值都在7.6 ~7.8 之间波动,各组间均无显著性差异(P >0.05)。
表1 不同试验时期3种微生态制剂对养殖水体中含量的影响Tab.1 The effects of the three probiotics on levels in different test periods

表1 不同试验时期3种微生态制剂对养殖水体中含量的影响Tab.1 The effects of the three probiotics on levels in different test periods
注:同一种微生态制剂中,同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P >0.05),下同。Note:In the same probitics,the means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group ρ(NH +4 -N)/(mg·L -1)12 d 24 d 36 d 48 d 60 d对照 0.239 ±0.021a0.348 ±0.012a0.432 ±0.013a0.483 ±0.025a0.508 ±0.013 a A1 0.225 ±0.017a0.351 ±0.023a0.421 ±0.006a0.478 ±0.021a0.497 ±0.008a A2 0.218 ±0.014a0.334 ±0.011a0.405 ±0.014b0.435 ±0.007b0.463 ±0.013b A3 0.188 ±0.032b0.303 ±0.012b0.356 ±0.013c0.388 ±0.016c0.415 ±0.021c B1 0.217 ±0.014a0.319 ±0.007b0.381 ±0.015b0.427 ±0.007b0.458 ±0.007b B2 0.188 ±0.022b0.262 ±0.016c0.327 ±0.014c0.354 ±0.015c0.366 ±0.014c B3 0.173 ±0.038b0.233 ±0.022d0.284 ±0.009d0.322 ±0.016d0.343 ±0.008d C1 0.228 ±0.016a0.336 ±0.014a0.413 ±0.016a0.452 ±0.022b0.481 ±0.009b C2 0.204 ±0.031b0.296 ±0.009b0.369 ±0.005b0.407 ±0.017c0.447 ±0.024c C3 0.172 ±0.022c0.221 ±0.018c0.271 ±0.012c0.318 ±0.014d0.325 ±0.015 d
表2 不同试验时期3种微生态制剂对养殖水体中含量的影响Tab.2 The effects of the three probiotics on levels in different test periods
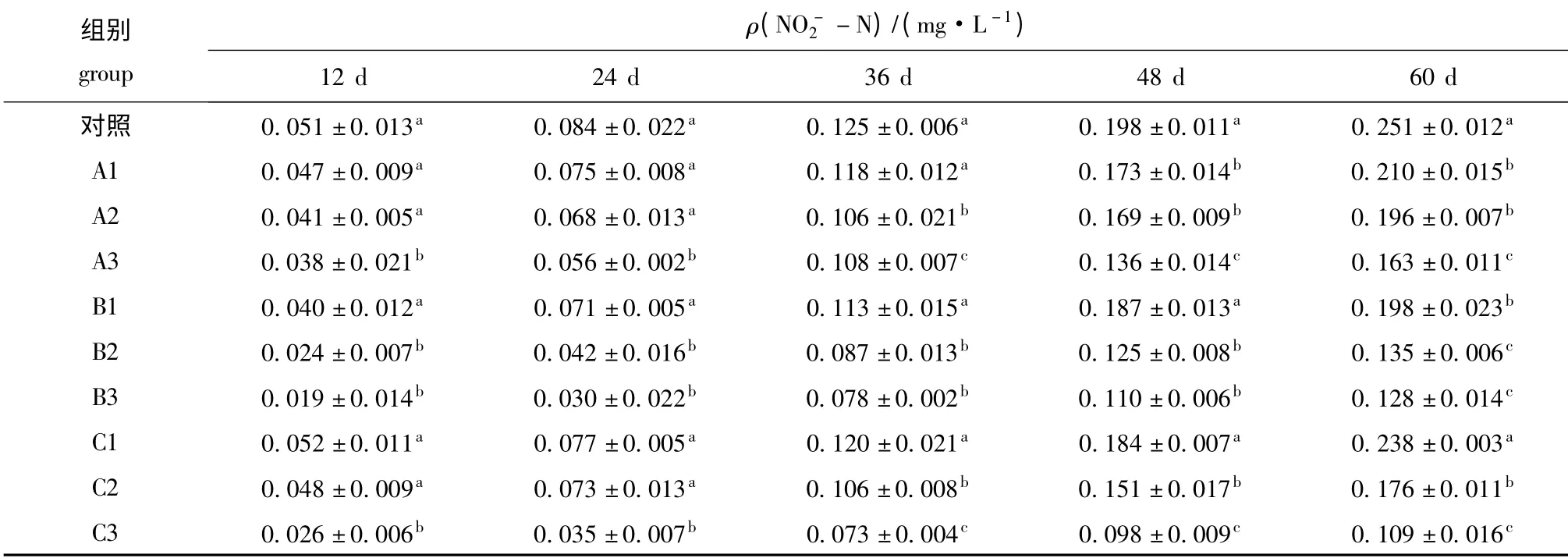
表2 不同试验时期3种微生态制剂对养殖水体中含量的影响Tab.2 The effects of the three probiotics on levels in different test periods
组别group ρ(NO -2 -N)/(mg·L -1)12 d 24 d 36 d 48 d 60 d对照 0.051 ±0.013a0.084 ±0.022a0.125 ±0.006a0.198 ±0.011a0.251 ±0.012 a A1 0.047 ±0.009a0.075 ±0.008a0.118 ±0.012a0.173 ±0.014b0.210 ±0.015b A2 0.041 ±0.005a0.068 ±0.013a0.106 ±0.021b0.169 ±0.009b0.196 ±0.007b A3 0.038 ±0.021b0.056 ±0.002b0.108 ±0.007c0.136 ±0.014c0.163 ±0.011c B1 0.040 ±0.012a0.071 ±0.005a0.113 ±0.015a0.187 ±0.013a0.198 ±0.023b B2 0.024 ±0.007b0.042 ±0.016b0.087 ±0.013b0.125 ±0.008b0.135 ±0.006c B3 0.019 ±0.014b0.030 ±0.022b0.078 ±0.002b0.110 ±0.006b0.128 ±0.014c C1 0.052 ±0.011a0.077 ±0.005a0.120 ±0.021a0.184 ±0.007a0.238 ±0.003a C2 0.048 ±0.009a0.073 ±0.013a0.106 ±0.008b0.151 ±0.017b0.176 ±0.011b C3 0.026 ±0.006b0.035 ±0.007b0.073 ±0.004c0.098 ±0.009c0.109 ±0.016 c
2.2 微生态制剂对幼参生长的影响
试验期间各组的成活率均为100%,说明微生态制剂对幼参成活率没有影响。从表3可见,各处理组的特定生长率均显著高于对照组(P<0.05),3种微生态制剂对幼参生长的促进作用随浓度的增加而增强。其中,免疫增强剂作用最显著,A1、A2、A3 组的特定生长率分别比对照组提高13.7%、19.4%和31.8%,B1、B2 组的特定生长率与B3 组有显著性差异(P<0.05),C1、C2、C3 组间有显著性差异(P<0.05)。
2.3 微生态制剂对幼参免疫的影响
2.3.1 ACP 活力 从图1可见,各处理组幼参体腔液中的ACP 活力均显著高于对照组(P<0.05);在试验浓度范围内,幼参的ACP活力均随微生态制剂浓度的增加而显著升高,其中免疫增强剂作用最明显,A1、A2、A3 组间均有显著性差异(P<0.05),分别比对照组提高70.6%、130.1%和164.0%;而复合芽孢杆菌和EM 菌各组间差异则相对不明显。

表3 不同种类和不同浓度的微生态制剂对幼参生长的影响Tab.3 The effects of the kinds and concentrations of the probiotics on growth in the sea cucumber
2.3.2 CAT 活力 从图1可见:各处理组幼参体腔液中的CAT 活力均显著高于对照组(P<0.05);在试验浓度范围内,幼参的CAT 活力均随着微生态制剂浓度的增加而显著升高,其中免疫增强剂的作用最明显,A1、A2 组的CAT 活力与A3组间有显著性差异(P<0.05),分别比对照组提高18.0%、28.4%和54.0%。
2.3.3 LSZ 活力 从图1可见:除A1、B1、C1组外,其他处理组幼参体腔液中的LSZ 活力均显著高于对照组(P<0.05);在试验浓度范围内,幼参的LSZ 活力均随着微生态制剂浓度的增加而显著升高,其中EM 菌作用最明显,C1、C2、C3组间有显著性差异(P<0.05),分别比对照组提高20.0%、60.7%和100.7%。
3 讨论
由于养殖场试验条件的限制,各试验组只设置了两个重复,相对于3 个重复的结果来说,会有一定的误差。但本试验结果基本上还是可以表明水质和幼参各项指标的变化趋势。
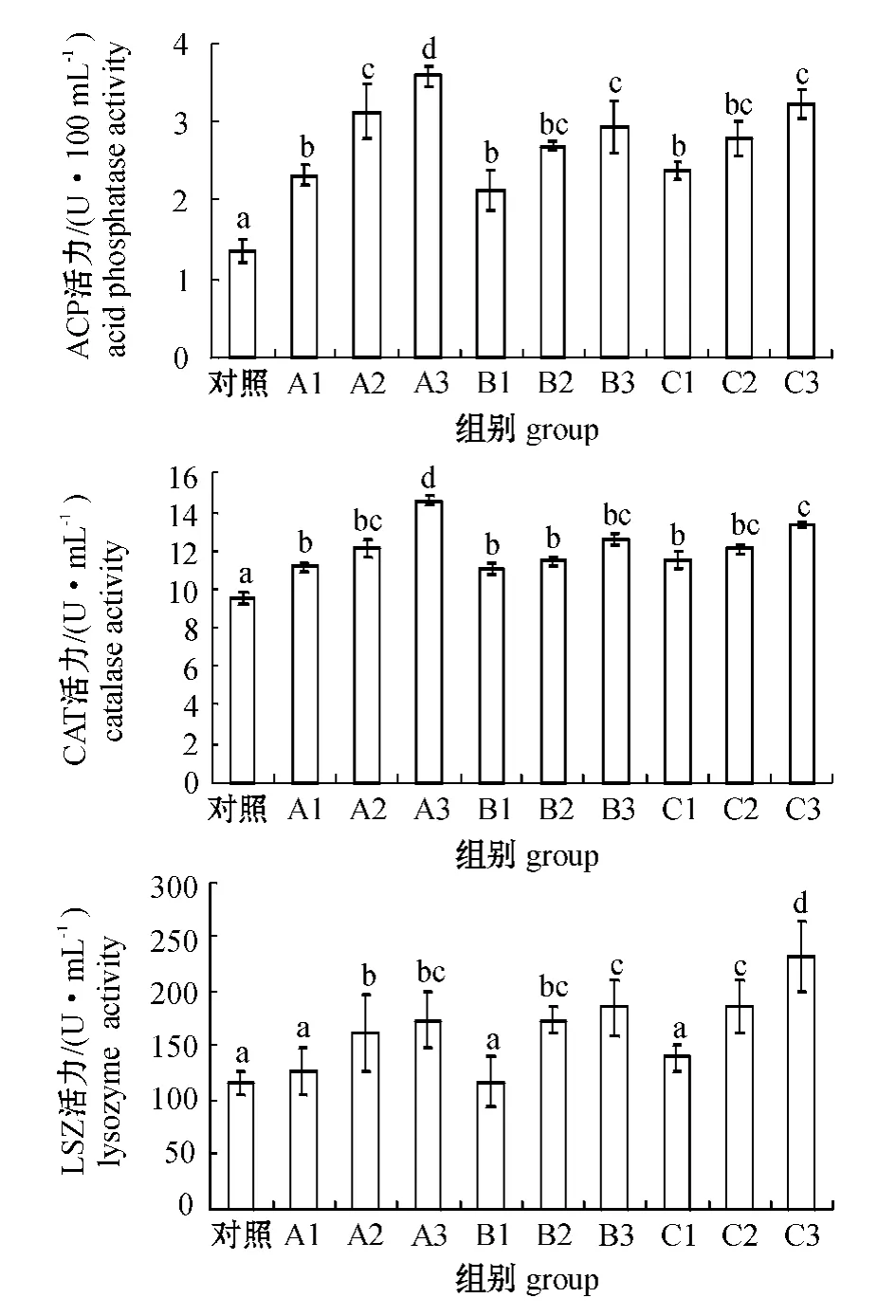
图1 3种微生态制剂对幼参体腔液中ACP、CAT、LSZ活力的影响Fig.1 The effect of the three probiotics on activities of acid phosphatase,catalase,and lysozyme in coelomic fluid of the sea cucumber
3.1 微生态制剂对幼参养殖水环境的影响
有研究表明,在水体中添加微生态制剂能在一定程度上改善水质,其作用原理是利用益生菌排斥水体中的致病菌和有害菌,通过分泌抑菌物质,竞争生态位来抑制致病菌的增长,同时还能直接影响水中氮循环细菌数量而促进水体的氮循环,达到降低水体含量的目的[12-13]。在养殖过程中,残饵、粪便是污染的主要来源,N 含量升高,引起水质恶化,同时也为某些条件性致病菌提供了营养,增加了刺参致病的危险。水体中加入微生态制剂后,通过氨化、氧化、硝化等作用,降解有机废物,减小其危害性,使水体环境稳定[14-15]。
3.2 微生态制剂对幼参生长的影响
微生态制剂本身含有大量的营养物质,同时随着它们在动物消化道内的定植、繁衍和代谢,可产生动物生长所需的维生素、氨基酸、促生长因子以及蛋白酶、脂肪酶、淀粉酶、纤维酶等多种酶,从而增强养殖对象的营养代谢,增加机体对养分的消化利用,促进其生长。另一方面,微生态制剂还可通过竞争抑制以及产生抑菌物质等方式抑制有害细菌,从而起到预防病害的作用。试验表明,微生态制剂对刺参生长有一定的促进作用。如袁成玉等[18]发现,使用光合细菌和芽孢杆菌投喂幼参能明显促进幼参生长;周慧慧等[19]采用分离自刺参肠道的益生菌投喂稚参,显著提高了稚参的成活率和生长率。
本试验结果表明,各处理组生长率显著高于对照组,说明3种微生态制剂可在一定程度上促进幼参生长。不同浓度之间,试验范围内浓度越大对幼参生长的促进作用越显著。这可能与投喂浓度高,有益菌可以更快进入和定植幼参肠道,提高幼参消化吸收率有关。不同微生态制剂之间,以免疫增强剂的促生长效果最显著,可能与其含有免疫肽和乳杆菌,快速改善刺参消化代谢有关。对于刺参消化道内益生菌的定植规律和作用周期尚需进一步探讨。
3.3 微生态制剂对幼参免疫的影响
刺参通过体腔液中具有吞噬能力的细胞对侵入的外来物质进行吞噬清除,借助细胞内的溶酶体酶,如酸性磷酸酶、碱性磷酸酶、过氧化氢酶等对异物进行裂解和消化,以达到免疫保护的效果。ACP是巨噬细胞溶酶体的标志酶和巨噬细胞内最有代表性的水解酶之一。CAT是一种含Fe(Ⅲ)-原卟啉的氧化还原酶,主要用于快速催化分解代谢中产生的过氧化氢,对生长发育和代谢活动具有重要意义。LSZ是一种碱性蛋白,通过水解细菌细胞壁中的乙酰氨基多糖,破坏和消除侵入体内的异物。陈文典等[20]使用枯草芽孢杆菌胶囊投喂中华绒螯蟹,可以明显提高其LSZ和ACP 活力。徐琴等[21]研究表明,微生态制剂是良好的非特异性免疫增强剂,能有效地增强机体的免疫力,提高抗逆能力,使中国对虾表现出最佳的生长状态。本试验中,各处理组幼参体腔液中的ACP、CAT、LSZ 活力均显著高于对照组,表明添加微生态制剂可以有效地提高幼参的免疫力。其中免疫增强剂对ACP和CAT 活力的增强作用最显著,EM 菌对LSZ 活力的增强作用最明显,随着制剂用量的增加作用效果显著。益生菌的种类和用量是微生态制剂作用的关键因子,生产上应根据不同用途选择含有所需益生菌的微生态制剂,亦可尝试添加混合益生菌剂,以达到改善水环境、防病和促生长的效果。
[1]Kozasa M.Toyocerin(Bacillus toyoi)as growth promotor for animal feeding[J].Microbiologie Aliments Nutrition,1986,4(1):121 -135.
[2]张涛,白岚,李蕾,等.不同添加量的益生菌组合对仿刺参消化和免疫指标的影响[J].大连水产学院学报,2009(S1),24:64-68.
[3]Zhang Q,Ma H M,Mai K S,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,nonspecific immunity of sea cucumber,Apostichopus japonicus[J].Fish& Shellfish Immunology,2010,29(2):204 -211.
[4]付鑫,吴垠,苏显屹,等.添加微生态制剂及投饲模式对幼刺参生长的影响[J].水产科学,2011,30(12):739 -743.
[5]Zhao Y C,Zhang W B,Xu W,et al.Effects of potential probiotic Bacillus subtilis T13 on growth,immunity and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus[J].Fish &Shellfish Immunology,2012,32(5):750 -755.
[6]Zhao Y C,Mai K S,Xu W,et al.Influence of dietary probiotic Bacillus TC22 and probiotic fructooligosaccharide on growth,immune responses and disease resistance against Vibrio splendidus infection in sea cucumber Apostichopus japonicus[J].Journal of Ocean University of China,2011,10(3):293 -300.
[7]王吉桥,王志香,张凯,等.饲料中添加蛋氨酸硒对仿刺参幼参存活、生长及免疫指标的影响[J].大连海洋大学学报,2012,27(2):110 -115.
[8]吴亚楠,柳鹏,李强,等.复方中草药对仿刺参免疫力和抗病力的影响[J].大连海洋大学学报,2011,26(2):338 -343.
[9]王吉桥,王志香,于红艳,等.饲料中不同类型的硒对仿刺参幼参生长和免疫指标的影响[J].大连海洋大学学报,2011,26(2):306 -311.
[10]王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29(6):72 -75.
[11]陈佳荣.水化学实验指导书[M].北京:中国农业出版社,1998:158 -159.
[12]吴保承,沈国强,杨春霞,等.微生态制剂在水质净化中的应用现状及展望[J].环境科学与技术,2010,33(12):408 -410.
[13]王笃彩,闫斌伦,李士虎,等.3种微生态制剂对养殖水体水质影响的比较研究[J].水生态学杂志,2011,32(1):66 -70.
[14]朱学芝,郑石轩,潘庆军,等.微生态制剂对凡纳滨对虾生长及水质的影响[J].中山大学学报,2008,47:58 -62.
[15]刘铁钢,赵文,刘钢,等.5种微生态制剂对刺参幼参的生态安全性[J].大连海洋大学学报,2012,27(2):129 -136.
[16]徐琴,李健,刘淇,等.4种微生态制剂对对虾育苗水体主要水质指标的影响[J].海洋科学,2009,33(3):10 -15.
[17]王路平,吴垠,班红琴,等.微生态制剂对刺参幼参在封闭式循环系统中的应用研究[J].中国微生态学杂志,2009,21(6):497 -499.
[18]袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612 -615.
[19]周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):955 -963.
[20]陈文典,李义,郝向举,等.枯草芽孢杆菌微胶囊制剂对中华绒螯蟹免疫机能及抗病力的影响[J].中国饲料,2009(5):33-36.
[21]徐琴,李健,刘淇,等.噬菌蛭弧菌和粘红酵母对中国对虾生长及非特异免疫因子的影响[J].海洋水产研究,2007,28(5):42 -47.

