牦牛脱脂乳中酪蛋白受热处理温度及时间影响的研究
杨 楠,梁 琪,*,杨 敏,张卫兵,宋雪梅
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070; 2.甘肃省功能乳品工程实验室,甘肃兰州730070; 3.甘肃农业大学理学院,甘肃兰州730070)
在日常生产加工过程中,为了增强食品的安全性,对牛乳进行加热处理是最基本的操作步骤,特别是酸性凝胶如酸奶、干酪等的生产,加热能增加牛乳的功能性并使产品达到合适的性质,比如增加酸奶的黏度等[1]。酪蛋白主要是由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白四种单体组成,并通过磷酸钙进行连接[2],形成无数磷酸钙包裹的单个酪蛋白分子的球状微粒,平均直径约为200nm,且微粒表面主要是由κ-酪蛋白单体形成延伸的毛发层,使整个微粒存在一定的空间和静电平衡[3]。70℃以上温度处理,能使乳清蛋白发生变性,自身发生聚集或与存在于酪蛋白表面的κ-酪蛋白结合,形成复杂的配合物[4],而形成最多的是β-乳球蛋白/κ-酪蛋白复合物,但也有报道称α-乳白蛋白的不可逆变性也提供一定的作用[5]。同时,维持酪蛋白分子胶束结构稳定性的诸多作用力,疏水作用、氢键、二硫键等,在加热处理时也发生改变,可能会进一步促进β-乳球蛋白与κ-酪蛋白的结合[6]。
牦牛乳是青藏高原特有的天然绿色食品,蛋白质含量为5.60%,比荷斯坦牛乳高100.7%,而乳蛋白的组成以酪蛋白为主,含量约84%[7]。近几年来,我国对牦牛乳的研究利用逐渐增多,主要集中于营养成分、功能性质、产品加工等方面,对外界条件影响牦牛乳中酪蛋白的研究不多。因此,热处理过程中,由于加热温度和时间的不同,导致牦牛脱脂乳中酪蛋白功能特性和胶束变化的研究,必将促进开发新的牦牛乳产品,为牦牛乳酪蛋白及其产品的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜牦牛乳 甘肃天祝;叠氮化钠、磷酸氢二钠、磷酸二氢钠、8-苯胺-1-萘磺酸(ANS)、十二烷基磺酸钠(SDS) 均为分析纯;去离子水。
立式高速冷冻离心机(KR25i) 法国Jouan公司;分光光度计(722S) 上海精密科学仪器有限公司;电热恒温水浴锅(HWS26) 上海一恒科技有限公司;双光束紫外-可见分光光度计(UV-2100) 郑州博邦科贸有限公司;荧光分光光度计(RF-5301PC)日本岛津公司;激光光散射仪(BI-200SM) 美国Brookhaven仪器公司;均质机;微量注射器;Whatman玻纤滤纸。
1.2 实验方法
1.2.1 样品预处理 新鲜牦牛乳用纱布过滤除杂后,在20℃、3500×g的条件下离心30min,去除上层脂肪。再用Whatman玻纤滤纸过滤三次以除去残留的脂肪,得到的即为脱脂乳。最后加入0.02%(w/v)叠氮化钠以防止微生物生长,并在4℃下储存[8]。
1.2.2 不同温度及时间热处理 将上述脱脂乳在水浴锅中恒温加热,温度分别为30、40、50、60、70、80、90℃(牛乳温度),处理时间分别为5、10、15、20、25m in,将处理后样品取出后在冷水中迅速冷却至室温,在4℃保存[9]。处理后样品最多保存5d,在测定前将试样在室温下放置1h。
1.2.3 指标测定
1.2.3.1 热稳定性的测定[10]分别取热处理后的样品溶液20m L,称取一定量的溶液于离心管中,在20℃,3920×g的条件下离心10m in,倒出上层溶液,称取下层沉淀物重量,计算比较沉淀量与样品溶液的比例,沉淀量越大,热稳定性越差。

1.2.3.2 乳化性的测定[11]取5m L菜籽油与15m L待测样品溶液,在高速分散均质机上均质1m in,立即用微量注射器从乳状液的底部取100μL,用质量分数为0.1%的SDS溶液稀释至10m L,在500nm波长下测定吸光度值。将乳状液静置10min后再以同样的方法稀释并测定,得到的吸光值A1与初始值A0用来衡量乳化活力指数(EAI)与乳状液稳定性(ES)。

式中:EAI为每克蛋白质的乳化面积(m2/g); C为溶液中样品蛋白的浓度(g/m L);L为比色杯直径1cm);A为500 nm处的吸光值;N为稀释倍数; Φ为油相所占的分数;A0为零时刻的吸光值;A1为30m in后的吸光值。
1.2.3.3 浊度的测定[12]分别用微量移液器移取热处理后样品200μL,用去离子水稀释至10m L,在室温、633nm的波长条件下,用紫外-可见分光光度计测定样品溶液的吸光度(A),以去离子水为参比溶液,平行测定三次。
1.2.3.4 表面疏水性测定[13]分别用微量移液器移取热处理后样品100μL,用0.01mol/L、pH7.0的缓冲溶液稀释至20m L,最后加入100μL ANS荧光剂,振荡,静置3min,在激发波长390nm、发射波长470nm的条件下测定荧光强度值。用荧光强度(I)来衡量溶液中蛋白的表面疏水性。
1.2.3.5 粒径测定[14]分别用微量移液器移取热处理后样品100μL,用去离子水稀释至10m L,使其达到仪器测量的浓度范围,在激光器的波长为632.8 nm,散射角为90°的条件下进行扫描,测定粒径分布及微粒强度。
1.2.4 数据统计分析 实验中所有数据均采用Excel统计、Orign8.0作图,再运用SPSS17.0进行显著性方差分析。
2 结果与分析
2.1 热稳定性
加热温度的上升和时间的延长可引起蛋白质间的化学键发生变化、相互反应以及空间构象的改变,相应会导致整个蛋白质溶液体系稳定性发生不同程度的变化。
沉淀率越大则热稳定性越差。由图1可知,随着温度的上升,牦牛脱脂乳中沉淀量随之增大,且在低于70℃时,总体变化不大,70~80℃急剧增加,80~90℃基本恒定;随着加热时间的延长,沉淀率总体也呈增大的趋势,在30~70℃间加热5、10min时总体缓慢增加,15~25m in基本恒定不变;单从增加的幅度来看,短时间(5、10m in)的加热在较低温度较大,在较高温度(80~90℃)与较长时间热处理基本一致。结果说明,不同温度及时间的加热处理,都能导致乳液系统的稳定性下降,尤其是温度70℃以上、大于10m in的处理时间,可使脱脂乳中存在的大量乳清蛋白变性程度显著提高,与酪蛋白之间以新的化学键进行连接,导致彼此空间构象发生改变[15]。而加热在破坏存在于脱脂乳系统中各成分间平衡的同时,更能破坏主要存在的酪蛋白之间的氢键、疏水作用等作用力,使之发生新的反应,但从结果可以看出,脱脂乳的沉淀率总体由约1.2%增至1.9%左右,也未造成明显的大量絮集,因此30~90℃、25m in内的加热处理对牦牛脱脂乳的热稳定性影响不显著(p>0.05)。
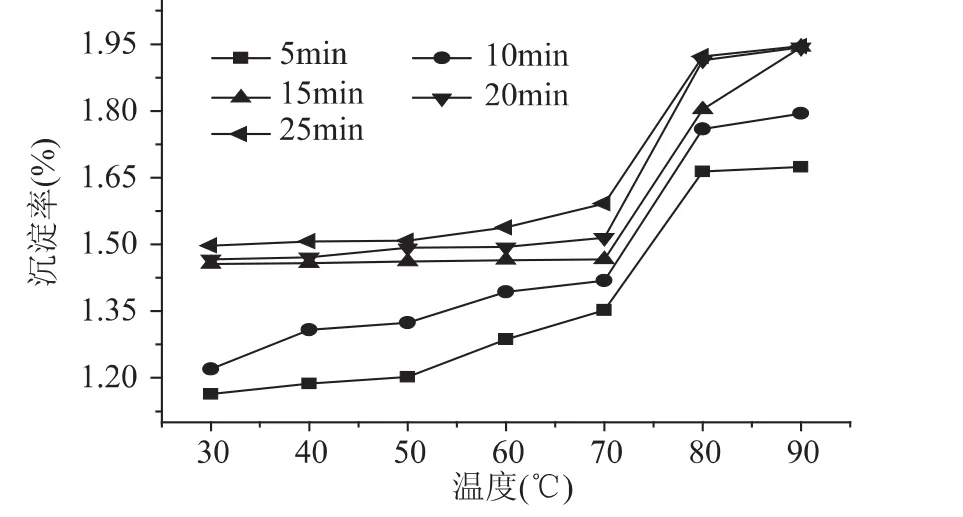
图1 不同温度及时间热处理后牦牛脱脂乳热稳定性的变化Fig.1 Difference of heat stability of the skim milk with the rise of temperature and time
2.2 乳化性
乳化性是指既能降低水和油的表面张力,又能降低水和空气的表面张力的性质。蛋白质的乳化性与疏水作用相关。研究中主要对乳化性中的两个重要的指标(乳化活力指数EAI、乳化稳定性ES进行了测定,见图2。

图2 不同温度及时间热处理后牦牛乳脱脂乳中蛋白乳化性的变化Fig.2 Difference of emulsifying of the skim milk with the rise of temperature and time
由图2(a)可知,随着加热温度的上升,脱脂乳中的蛋白EAI呈下降趋势,在较低温度(30~60℃)总体变化不明显,但在较高温度(60~90℃)减小幅度增大;加热时间的延长也导致EAI改变,总体来看,15m in的加热时间使得脱脂乳中蛋白质有较高的EAI,但与其他时间差别不大(相差≤0.5m2/g)。说明随着加热温度升高,脱脂乳中蛋白质的疏水作用增强,主要是由于加热时β-乳球蛋白变性程度增大,形成的β-乳球蛋白聚合体结合在酪蛋白胶束表面,导致其表面疏水性增加[16],而酪蛋白在加热时,内部大量的疏水基在温度的作用下也转移至酪蛋白胶粒表面,使表面疏水性增加,EAI随之降低。实验结果也进一步表明加热时间的增加也能促进所有反应的发生,但加热超过15m in反而不利于反应的发生。
图2(b)表示的是ES随温度和时间的变化。图中可明显观察到,温度的上升可使ES随之降低,在30~50℃间基本不变,50℃以上时减小幅度显著增大(p<0.05),当温度上升到90℃时总体降至51%左右;在较低温度(30~70℃),加热20、25m in对ES的影响较大,且短时间(5~15m in)加热时整个溶液体系ES降低幅度较大。
2.3 浊度
浊度体现酪蛋白胶束的变化,能定性说明胶束间相互作用的改变。因为胶体悬浮液的浊度与胶体大小和微粒的散射特性相关,若粒子具有较大的尺寸和较高的散射系数,则体系的浊度较大。
由图3可看出,随着温度的增加,脱脂乳的浊度呈上升的趋势,在低于70℃时浊度以约10%的增长率缓慢增加,而在高于70℃以上时急剧增大,总体增长率约为30%,较高温度的增幅明显大于较低温度;而加热时间的延长同样也导致浊度增大,加热20、25m in时,脱脂乳的浊度在 30~80℃间显著高于5~15m in,90℃时吸光度均在0.62±0.02左右,差异不显著(p>0.05)。这说明牦牛脱脂乳中存在的大量酪蛋白、乳清蛋白、乳糖等微粒,它们的尺寸和光散射系数都随温度的上升和时间的延长而变大、增强,从而导致浊度的增大。是因为温度和加热时间的增加都能促进大量的乳清蛋白、乳糖等与酪蛋白发生作用,以及原有存在的化学键断裂与重组,都引起整个乳液系统浊度的改变[17];其次,乳清蛋白在温度70℃以上时,原有构造被破坏,转变为低一级的次序,变性的乳清蛋白部分聚集在酪蛋白胶束表面,或与酪蛋白胶束表面结合形成复杂的配合物,致使样品溶液中部分微粒的直径显著增大[18];再次,温度的增加及加热时间的延长,也能引起酪蛋白胶束自身发生离解与聚集程度的增强,由研究结果可以看出,70℃以上的温度可以更大程度的使酪蛋白自身聚集并与乳清蛋白发生反应,20、25min的加热时间也是比较有利于聚集反应[19];而且乳糖及微量元素在加热时对与酪蛋白的相互作用起到一定的促进作用[20]。因此,诸多反应最终导致浊度大幅度增加,而加热时间的延长也能使反应的程度增大。

图3 不同温度及时间热处理后牦牛脱脂乳浊度的变化Fig.3 Difference of turbidity of the skim milk with the rise of temperature and time
2.4 表面疏水性
蛋白质网络的形成是由于蛋白质中相邻多肽链之间的吸引力与排斥力达到平衡时的结果,加热使蛋白质分子呈舒展状态,原来包埋在卷曲内部的疏水基团暴露在外面,从而使原来处于卷曲结构外部的亲水基团相对减少。
由图4可知,脱脂乳中蛋白质的表面疏水性随着温度的上升逐渐增大,总体约由780增至945,而在较低温度(30~60℃)变化不大,在较高温度(60~90℃)显著增加(p<0.05);同时随着加热时间的延长,总体变化不是很明显,但在50~60℃之间,可明显观察到,5、10min与15、20、25m in加热处理时间的变化趋势不同,前者呈持续增加的趋势,后者则有略微下降。结果说明,加热温度和时间的不同可导致脱脂乳中酪蛋白表面疏水性发生变化,主要是因为加热使乳清蛋白及酪蛋白等成分的亲水基与疏水基的排列改变,尤其是包埋于酪蛋白胶束内部的疏水基部分转移至表面;且大量乳清蛋白变性,使通常包埋的容易反应的氨基酸侧链基团暴露,特别是β-乳球蛋白的巯基反应增加,其中主要为二硫化物与变性乳清蛋白及酪蛋白表面的κ-酪蛋白发生的交换反应,导致乳蛋白中疏水基团之间的相互作用随着温度的增加而增强[21]。这更能说明上述乳蛋白EAI的变化,表面疏水性的增加说明疏水基团增多,亲水基减少,油-水界面的作用力减弱,从而引起蛋白的EAI减小。但是加热时间的延长对牦牛脱脂乳中蛋白表面疏水性影响不显著(p>0.05),因此蛋白乳化性的降低不是完全依靠表面疏水性,也与其他作用有关,这有待于进一步进行验证。
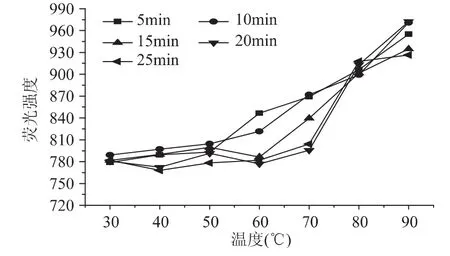
图4 不同温度及时间热处理后牦牛脱脂乳中酪蛋白表面疏水性的变化Fig.4 Difference of surface hydrophobicity of the skim milk with the rise of temperature and time
2.5 粒径
牦牛脱脂乳中的酪蛋白胶束微粒不是完全相同的,它存在一个比较宽的分布区间,而在加热过程中,酪蛋白自身发生不同程度的离解与聚集,又与乳清蛋白、乳糖等发生作用,粒径变化就更不能用一个固定的值来衡量,因此,在探讨加热时酪蛋白胶束大小的变化时,只能借助于平均粒径来进行说明。光散射技术在研究高聚物的分子量及链构象中应用很广泛,研究中所使用的动态光散射能得到粒径分布、分子量分布、平移扩散系数等参数,可以用于研究蛋白质的分子链构象、聚集体尺寸及形态等。
由图5可以看出,在温度30~90℃的加热过程中,脱脂乳中酪蛋白胶束平均粒径总体呈增大的趋势,且在60℃以上显著增大(p<0.05);加热时间延长时,酪蛋白胶束平均粒径也随之增大,20、25m in处理时尤为明显,如在30℃,加热时间25m in时比5~20m in的平均粒径大20nm左右;70℃时,25m in的加热处理也导致粒径显著增大,由 199.2nm增至268.1nm,随后基本保持恒定。结果表明,加热温度和时间对脱脂乳中酪蛋白胶束大小影响比较大,70℃以上的温度导致乳清蛋白的变性程度显著增大,并大量粘附于酪蛋白胶束表面使胶束粒径增大,加热时间的延长也同样使变性程度增大[22]。但在加热处理时酪蛋白胶束表面的κ-酪蛋白单体发生解离,并随温度的升高而增大,刚开始缓慢,温度越高、加热时间越长解离程度越大[23]。但由实验结果可知,在脱脂乳中,由于乳清蛋白的存在,加热时乳清蛋白变性黏附在酪蛋白胶束表面的速度明显大于酪蛋白自身的解离,使粒径总体呈增大的趋势。这与上述浊度的结果相对应,解离程度及粒径的增大都能在一定程度导致牦牛脱脂乳样品溶液中微粒数增多、增大,必然导致浊度的增大。
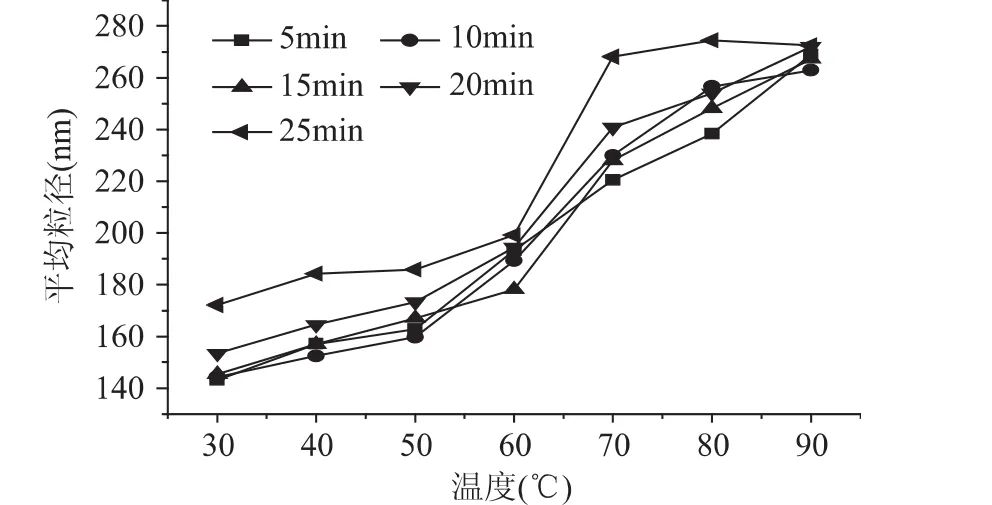
图5 不同温度及时间热处理后牦牛脱脂乳中酪蛋白胶束平均粒径的变化Fig.5 Difference of average particle size of the skim milk with the rise of temperature and time
3 结论
3.1 牦牛脱脂乳经过不同温度(30~90℃)及不同时间(5~25m in)的热处理后,由于乳清蛋白变性及酪蛋白自身的离解、聚集作用,热稳定性、乳化性及浊度发生都改变。因此,随着加热温度的上升、时间的延长,热稳定性下降,尤其在70℃、15m in以上剧减;乳化性也呈下降趋势,但在加热15m in时,在整个加热温度范围内EAI比其他加热时间大;浊度总体呈增加趋势,且70℃、15m in以上增幅较大。
3.2 脱脂乳中酪蛋白表面疏水性及平均粒径都随温度的上升、时间的延长而增大,温度越高、时间越长,变化越明显。也进一步说明加热时酪蛋白胶束的表面发生一定程度的变化,且乳清蛋白变性的程度比酪蛋白胶束自身离解速率更快,尤其是70℃以上。因此,热处理时牦牛乳酪蛋白变化的研究,对探讨牦牛乳在加工过程中酪蛋白的变化具有重要的指导意义。
[1]VASBINDER A J,ALTING A C,EDKIUIFCG.Quantification of the heat-induced casein-whey protein interactions inmilk and it relation to gelation kinetics[J].Colloids and Surfaces B: Biointerfaces,2003,31:115-123.
[2]LITTLE EM,HOLT C.An equilibrium thermodynamic model of the sequestration of calcium phosphate by casein phosphopeptides[J].European Biophysics Journalwith Biophysics Letters,2004,33:435-447.
[3]KARINE J,MARIE R,FANNY G.Structure and surface propertie s of the serum heat-induced protein aggregates isolated from heated skim milk[J].International Dairy Journal,2006,16: 303-315.
[4]LAURENCE D,MARCELA A,ANDDOUGLASG D.Acid gelation in heated and unheatedmilks:interactions between serum protein complexes and the surfaces of casein micelles[J].Journal of Agricultural and Food Chemistry,2007,55: 4160-4168.
[5]PAN X Y,MU M F.Micellization of casein-graft-dextran copolymer prepared through maillard reaction[J].Wiley Periodicals,2006,81:29-38.
[6]ANEMA S G,LI Y.Further studies on the heat-induced pH-dependent dissociation of casein from the micelles in reconstituted skim milk[J].Lebensmittel Wissenschaftund Technologie,2000,33:335-343.
[7]妥彦峰.甘肃天祝放牧白耗牛乳营养成分及脂肪酸研究[D].兰州:甘肃农业大学,2006.
[8]PATRICA H,RISSO V M,RELLINGe M S,et al.Effect of size,proteic composition,and heat treatment on the colloidal stability of proteolyzed bovine casein micelles[J].Colloid and Polymer Science,2007,285:809-817.
[9]ANEMA S G,HENNING K.Heat-induced,pH-dependent dissociation of casein micelles on heating reconstituted skim milk at temperatures below 100℃[J].Journal of Agricultural and Food Chemistry,1997,45:1108-1115.
[10]MENG G T,Ma C Y.Thermal properties of Phaseolus angularis(red bean)globulin[J].Food Chemistry,2001,4(73): 453-460.
[11]JIANG S J,ZHAO X H.Transglutaminas einduced crosslinking and glucosamine conjugation of casein and some functional properties of themodified product[J].International Dairy Journal,2011,21:198-205.
[12]CLAUDIA P,UWE S,SVEN R,et al.Crosslinking of casein bymicrobial transglutaminase and its resulting influence on the stability of micelle structure[J].Journal of Biotechnology,2007,2:456-461.
[13]SAVA,VANDER P,CLAEYS,et al.The kinetics of heatinduced structural changes ofβ-LactoglobulinJournal[J].Dairy Science Association,2005,88:1646-1653.
[14]ANEMA SG.Effect ofmilk concentration on heat-induced,pH- dependent dissociation of casein from micelles in reconstituted skim milk at temperatures between 20 and 120℃[J].Journal of Agricultural and Food Chemistry,1998,46: 2299-2305.
[15]CORREDIG M,DALGLEISH D G.The mechanisms of the heat-induced interaction ofwhey proteins with casein micelles in milk[J].International Dairy Journal,1999,9:233-236.
[16]MOTTAR,BASSIER.Effect of heat-induced association of whey proteins and caseinmicelles on yogurt texture[J].Journal of Dairy Science,1989,72(9):2247-2256.
[17]HASMUKH A,PATEL,HARJINDER S.Effects of Heat and high hydrostatic pressure treatments on disulfide bonding interchanges among the proteins in skim milk[J].Journal of Agricultural and Food Chemistry,2006,54:3409-3420.
[18]DALGLEISH D G,BANKS.The formation of complexes between serum proteins and fat globules during heating of whole milk[J].Mischwissenschaft,1991,46:75-78.
[19]ANEMA SG.Heat and/or high-pressure treatment of skim milk:changes to the casein micelle size,whey proteins and the acid gelation properties of the milk[J].International Journal of Dairy Technology,2008,61(3):245-254.
[20]YANG Y Q,NARENDRA R.Properties and potentialmedical applications of regenerated casein fibers crosslinked with citric acid[J].International Journalof BiologicalMacromolecules,2012,51:37-44.
[21]KEENAN T W,PATTON S.The structure of milk: Implications for sampling and storage[J].Handbook of Milk Composition,1995,5:42-50.
[22]BRENDAN T O,KENNED Y.Control of heat-induced aggregation ofwhey proteins using casein[J].International Journal of Dairy Technology,2006,54:5637-5642.
[23]ANEMA SG.Role ofκ-Casein in association of denatured whey proteins with casein micelles in heated reconstituted skim milk[J].International Journal of Dairy Technology,2007,55: 3635-3642.

