利用RAPD技术对牡丹江地区红松根际土壤微生物多样性的分析
贾 丹,王 刚,王文帆,陈 迪
(1.黑龙江省森林工程与环境研究所,哈尔滨150081;2.森林可持续经营与环境微生物工程黑龙江省重点实验室,哈尔滨150081;3.黑龙江省林业科学院,哈尔滨150081)
土壤是岩石圈表面的疏松表层,是陆生植物生活的基质,为植物提供必需的营养和水分。植物的根系与土壤有着极大的接触面,在植物和土壤之间进行着频繁的物质交换,彼此有着强烈影响,因此通过控制土壤因素就可影响植物的生长和产量。而在众多因素当中,土壤微生物因素是最为重要的。
土壤微生物组成复杂[1],数量巨大,种类繁多,一直被认为是研究中的黑匣子[2]。其中,土壤中的细菌和真菌在生物地球化学循环过程中扮演着非常重要的角色[3-4],而且对土壤中有机物质的转换也起着至关重要的作用[5]。土壤微生物还对地表生态系统[6],对植物的健康[7-8],土壤的结构[9],土壤的肥力[10-11]产生重要的影响。
土壤微生物多样性指生命体在遗传、种类和生态系统层次上的变化。它代表着土壤微生物群落的稳定性,同时也反映土壤生态机制和土壤胁迫对微生物群落的影响。经研究发现,微生物多样性丰富的土壤其生态功能也呈现多样性,且生态系统稳定持续。因此对土壤微生物的多态性及功能的研究会对树木生理生化的研究及土壤环境的研究提供依据。
目前,针对土壤微生物多样性的研究,主要为传统的基于培养分离的方法、土壤酶活性测定、生物标记及分子生物学技术。
随着人们对土壤中微生物的原位生存状态研究,越来越发现常规的分离培养方法很难全面地估价微生物群落多样性。应用现代生物化学和分子生物学方法,成功克服了传统微生物生态学研究技术的局限性。随机扩增的多态性DNA(RAPD,Random Amplified Polymorphic DNA)是由 Williams和Welsh在1990年同时提出的一种快速、简便、多态性检出率高、可自动化分析的一项DNA分子标记技术[13-14]。RAPD 建立在聚合酶链式反应(PCR)的基础上,以一系列人工合成的不同随机寡核苷酸序列(l0bp)为引物,对所研究的基因组DNA进行PCR扩增,扩增产物通过聚丙烯酰胺凝胶电泳后银染,或者是通过琼脂糖凝胶电泳经溴化乙锭(EB)染色来检测。RAPD技术以检测多态性DNA为目的,因快速、简便的特点,其在DNA水平上反映微生物群落的多样性等方面得到了广泛的应用,此外也可用于物种分类和亲缘关系鉴定、基因组分析等方面。
红松(Pinus koraiensis)是我国东北山地的地带性顶级植被类型——红松阔叶林的优势树种。红松因其树体高大通直,材质优良而具有很高的经济价值。最近研究表明红松的自然分布呈下降趋势,且土壤微生物功能多样性正朝着不利于红松更新的方面进行。研究红松土壤根际微生物多样性,可以揭示红松林土壤结构和肥力等信息,有助于改善红松林土壤条件,从而更好地保护红松[15-16]。
1 研究区域概况及土壤样品的采集
研究区域为穆棱县,海拔高度在400m左右,地势多为丘陵漫岗,年平均气温2.3℃。平均降水量500~550mm,主要集中在6、7、8三个月。地带性土壤为暗棕壤。森林植被以中温带针叶——阔叶混交林,以红松为代表树种,除红松外还分布着云杉、冷杉、枫桦、椴树和蒙古栎等。林下灌木以毛榛子、胡枝子、榛柴、刺玫果和马林等为主。多年生草本植物以小叶樟为主,伴生有野豌豆、草玉梅和银莲子等。
在实验区范围内共取了3种林型,分别为椴树红松林、云冷杉红松林和蒙古栎红松林,且每种林型中又选取了幼龄、中龄和成熟林共9块样地。
在每一个林分内设置(20×20)m2的样地,并将其按照对角线分为四个小样地,在每个小样地挖土壤剖面至母质层。用土壤环刀在红松根际取3个平行土样,放入冰箱4℃ 冷藏保存。
2 试验方法
由于RAPD基于PCR反应,所以PCR反应体系以及PCR扩增程序的确立尤为重要。本试验通过查阅郑成木[17]及曹立成[18]等相关文献,主要对退火温度进行了优化,最终确定了退火温度为38℃。具体试验反应体系如下:
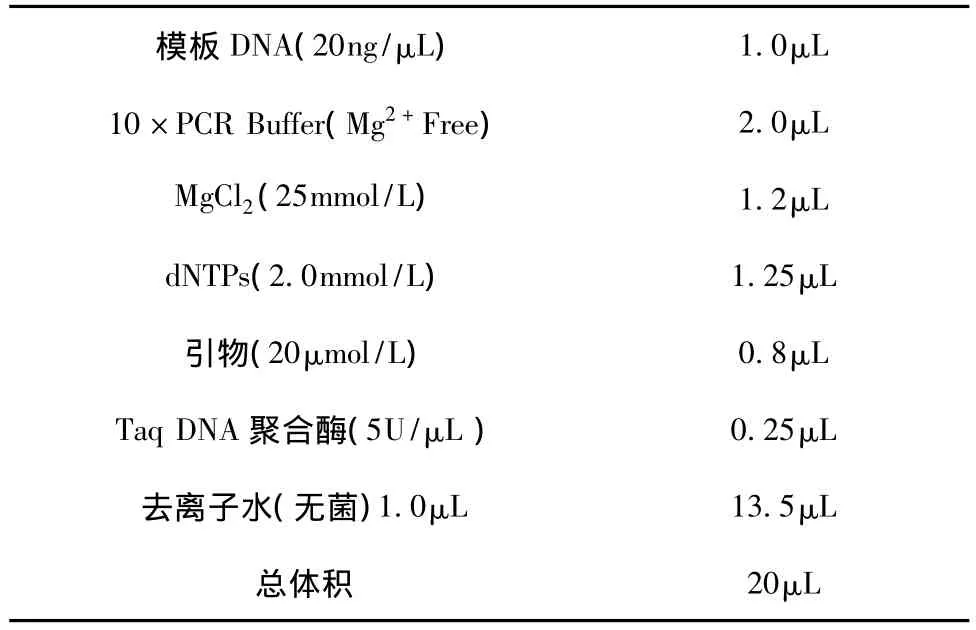
表1 具体试验反应体系Tab.1 Specific test reaction

3 结果与分析
3.1 RAPD-PCR产物的检测结果
取8μL PCR产物与6×加样缓冲液充分混合后,点入TAE为缓冲液的1%的琼脂糖凝胶中,同时点入DL2000 Marker进行电泳,电泳结束后在凝胶成像系统中检测PCR结果。其结果如图1所示。图1中,标准物为DL2000,1~3道分别为椴树红松林幼龄林、中龄林及老龄林。4~6道为蒙古栎红松林幼龄林、中龄林及老龄林。7~9道为云冷杉红松林幼龄林、中龄林及老龄林。且按电泳结果顺序将上述9块样地编为1#~9#。
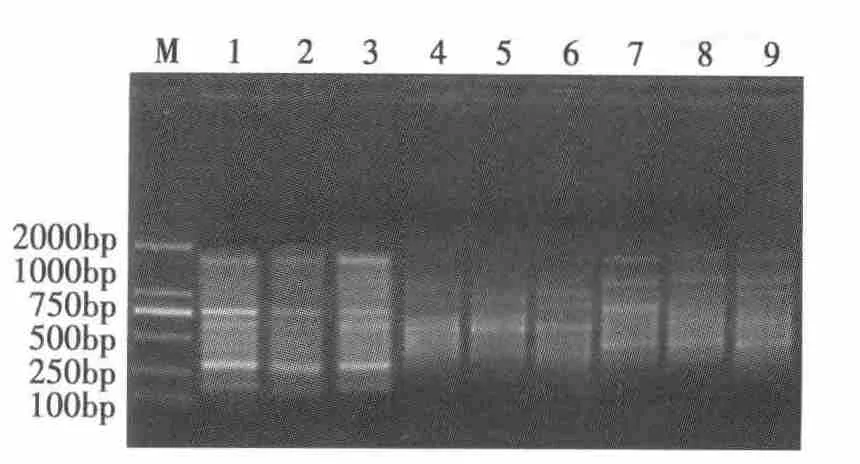
图1 RAPD扩增结果Fig.1 RAPD amplification result
由图1中显示,1~3泳道中得到的的条带最丰富,其次为7~9泳道,4~6泳道条带最少。由此可以说明,椴树红松林中林木根际土壤微生物的多态性最为丰富,云冷杉红松林其次,蒙古栎红松林最底。
3.2 RAPD数据分析
电泳图谱中的每一条谱带均代表了引物与模板DNA互补的一对结合位点,记为一个分子标记。根据分子量标准对照反应产物在胶片上的对应位置,对同一引物不同模板的电泳结果进行分析。所有模板都具有的带为公共带,表示无多态性;其余为多态带,表示有多态性。有带记为1,无带记为0,形成0/1矩阵图输入计算机。用 NTSYS-pc(version 2.10)软件包中的Nei&Li法的计算方法分别计算遗传相似系数。用UPGMA法聚类分析,用NJTREE程序构建样本间的树状聚类图。
用上诉分析方法得到遗传系数表(见表2)和聚类分析图(如图2所示)。

表2 RAPD遗传相似性分析Tab.2 RAPD genetic similarity analysis
由表2可知,椴树红松林的幼龄林与中龄林和老龄林的遗传系数分别为0.92和1.00,中龄林与老龄林的遗传系数为0.92;蒙古栎红松林幼龄林与中龄林和老龄林的遗传系数为0.83和0.83,中龄林与老龄林的遗传系数为0.83;云冷杉红松林幼龄林与中龄林和老龄林的遗传系数为0.75和0.75,中龄林与老龄林的遗传系数为0.83。

由聚类图2可知;蒙古栎红松林中4#、5#、6#在遗传系数为0.83时聚成一类;椴树红松林的1#与3#遗传系数完全相同,而与2#在遗传系数为0.92时聚成一类;云冷杉红松林中8#与9#在遗传系数为0.83时聚成一类,而与7#在遗传系数在0.75时聚成一类。
由聚类分析可知,三种林型在幼龄林阶段的1#椴树红松林与7#云冷杉红松林在遗传距离为0.58时聚成一类,而与4#蒙古栎红松林在遗传距离0.33时聚成一类。中龄林阶段的2#椴树红松林与8#云冷杉红松林在遗传距离为0.58时聚成一类,而与5#蒙古栎红松林在遗传距离为0.33时聚成一类。成熟林阶段的3#椴树红松林与9#云冷杉红松林在遗传距离为0.58聚成一类,而与6#蒙古栎红松林在遗传距离0.33时聚成一类。
4 结论
从以上分析得出结论:椴树红松林根际土壤微生物的多态性大于云冷杉红松林,云冷杉红松林大于蒙古栎红松林。3种林型内的土壤微生物是相互独立变化的,总体趋势大致相同。椴树红松林与云冷杉红松林的土壤微生物构成较为近似,与蒙古栎红松林的土壤微生物结构较远。椴树红松林在幼龄林时期向中龄林过渡时,土壤微生物结构有细微的变化,到成熟林时又恢复至幼龄林时期的水平。蒙古栎红松林在三个时期都在变化,变化的趋势较无规律。云冷杉红松林在中龄林和成熟林阶段土壤微生物的构成较为相似,与幼龄林时期相差较大。
[1] 沈 萍.微生物学[M].北京:高等教育出版社,2000.
[2] Tiedje J M,Asuming-Brempong S,Nusslein K,et al.Opening the black box of soil microbial diversity [J].Applied Soil Ecology,1999,13:109 -122.
[3] Molin J,Molin S.CASE:complex adaptive systems ecology [J].New York:Jones J G(Ed),Advances in Microbial Ecology,1997,16:27-29.
[4] Wall D H,Virginia R A.Control on soil biodiversity:insights from extreme environments [J].Applied Soil Ecology,1999,13:137 -150.
[5] Kirk J L,Beaudette L A,Hart M,et al.Methods of studying soil microbial diversity[J].Journal of Microbiological Methods,2004,58:169-188.
[6] Timonen S,Finlay R D,Olsson S,et al.Dynamics of phosphorous translocation in intact ectomycorrhizal system:non-destructive monitoring using a B-scanner[J].FEMS Microbiol Ecol,1996,19:171-180.
[7] Filion M,St-Amaud M,Fortin J A.Direct interaction between the arbuscular mycorrhizal fungus Glomus intraradices and different rhizosphere microorganisms[J].New Phytol,1999,141:525 -533.
[8] Smith K P,Goodman R M.Host variation for interactions with beneficial plant-associated microbes[J].Annu Rev Phytopathol,1999,37:473 -491.
[9] Dodd J C,Boddington C L,Rodriguez A,et al.Mycelium of arbuscular mycorrhizal fungi(AMF)from different genera:form,function and detection[J].Plant Soil,2000,226:131 -151.
[10] Yao H,He Z,Wilson M J,et al.Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use[J].Micro Ecol,2000,40:223 - 237.
[11] O'Donnell A.q Seasman M,Macrae A,et al.Plants and fertilizers as drivers of change in microbial community structure and function in soils[J].Plant Soil,2001,232:135 -145.
[13] Noyes R D,Rieseberg L H.Two independent loci control agamospermy(apomixis)in the triploid flowering plant Erigeron annuns[J].Genetics,2000,155:379 -390.
[14] Grimanelli D,Leblanc O,Espinosa E,et al.Mapping diplosporous apomixis in tetraploid Tripsacum:one gene or several genes[J].Heredity,1998,80:33 -39.
[15]胡海清,张富山,魏书精,等.火干扰对土壤呼吸的影响及测定方法研究进展[J].森林工程,2013,29(1):1 -8.
[16]何 娜,王立海.压实对土壤理化特性及土壤呼吸的影响研究进展[J].森林工程,2010,26(1):7 -11.
[17]郑成木.植物分子标记原理与方法[M].长沙:湖南科学技术出版社,2003.
[18]曹立成.甜菜M14品系分子标记的研究[D].哈尔滨:黑龙江大学,2006.
- 森林工程的其它文章
- 自走风力灭火机离合电机控制精度的研究

