注射用头孢曲松钠的质量对比研究
贾国慧 呼海涛
(上海医药集团股份有限公司中央研究院 上海 201203)
注射用头孢曲松钠为第三代头孢菌素类抗生素,大量用于临床的抗菌治疗,疗效好副作用小,目前国内外有众多企业生产,上海新亚药业为其中之一。为提高产品质量、上海新亚药业早在2009年即委托上海医药中央研究院对其自身产品、原研品及业内龙头企业生产的头孢曲松产品进行了全面深入的质量研究与评价,力求找出与同行企业间的质量差异,取长补短、精益求精。本研究采用上海新亚药业(简称新亚)产品和本品原研企业(简称原研)市售样品所开展的一系列质量对比研究。研究工作从物质基础角度对可能影响产品疗效与安全的相关指标进行了检测与分析。
1 仪器与试药
高效液相色谱仪(安捷伦1200)、液质联用仪(THERMO LTQ)、旋光仪(鲁道夫AOTO POLⅥ)、粒度分布仪(马尔文Mastersizer 2000)、X-粉末衍射仪(Bruker D8 Advance XRD、RIGAKU/max 2550VB/PC)、差示扫描量热仪(DSC Q2000)、元素分析仪(Elementar Vario EL Cube)等。
甲醇、乙腈(色谱纯,Merck KGaA);纯净水[乐百氏(广东)食品饮料有限公司];正辛胺(分析纯,批号:O5802-100G,SIGMA);磷酸氢二钠、磷酸二氢钠(分析纯,批号分别为:20101109和20040818,国药集团化学试剂有限公司):蓝色葡聚糖2000(批号:10012605,GE Healthcare);头孢曲松对照品(批号:130480-200302,中国食品药品检定研究院);注射用头孢曲松钠样品(上海新亚药业,批号:100725;原研(市售),批号 :SH1259)。
2 方法与结果
2.1 有效性相关指标的比较
众所周知,制剂有效性与其有效物质的含量息息相关,因此我们围绕该指标,考察了两企业样品的原始含量、不同溶药介质中的含量、药品配置后不同放置时间对含量的影响以及输液器过滤装置对样品量的影响。
2.1.1 含量测定
高效液相色谱法[1],固定相:Agilent C18柱(4.6 mm×150 mm,5 µm)。流动相:正辛胺溶液(0.02 mol/L)-乙腈=73:27,用磷酸调pH至6.5;流速:1.0 ml/min;检测波长:254 nm;柱温:25 ℃;进样量:5 µl。
样品配制:取本品约6.5 mg,精密称定,至10 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
对照品配制方法:取头孢曲松钠对照品适量,同上制备。
测定结果表明新亚和原研企业生产的注射用头孢曲松钠产品,按无水物(C18H18N8O7S3)计,含量分别是84.94%和84.04%。测定结果无明显差异。
2.1.2 临床用药稳定性与输液器影响
为考察活性成分进入体内实际有效量的一致性,我们还对产品临床使用中的各环节进行了研究。如样品在常用稀释液10%葡萄糖溶液中的稳定性、0.9%氯化钠溶液中的稳定性,输液器过滤前后浓度的一致性等,以避免因临床用药方式不同所带来的疗效差异[2-4]。
测定方法:称取本品适量,分别用10%葡萄糖溶液、0.9%氯化钠溶液溶解,测定过滤前后,峰面积的变化,并将过滤后样品于0.5、1、2、4 h分别取样测定,与过膜前样品比较,观察峰面积的变化。
计算公式:
过滤前后变化率=(过滤后峰面积-过滤前峰面积)/过滤前峰面积×100%
放置变化百分率=(取样时间点峰面积-零时间点峰面积)/零时间点峰面积×100%
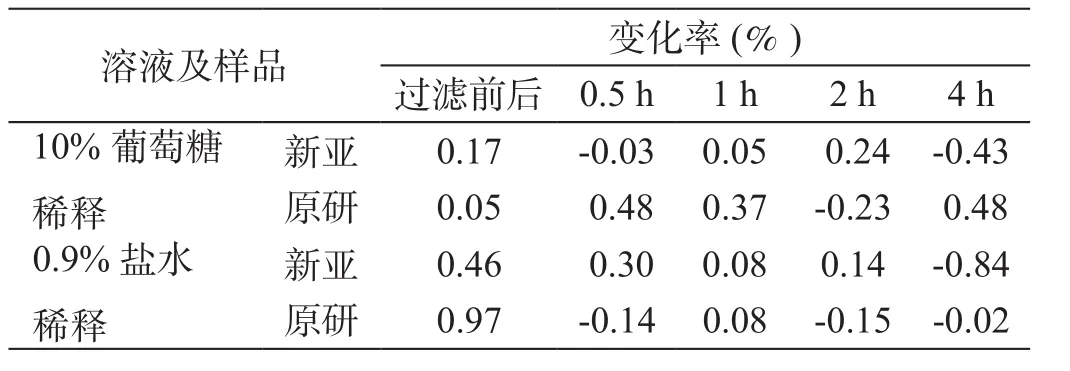
表1 稀释剂、放置时间及过滤对本品有效量的影响
表1可见,临床用药过程中经常遇到的不同种类的样品配置溶液、配置后放置时间、输液器过滤膜对两产品的有效样品量影响,其波动均在±1%以内,可忽略。
上述结果表明两产品用药过程各因素对其有效剂量的影响可以忽略。
2.2 安全性相关指标的研究与对比
安全是药品控制中最重要的考虑因素,除活性成分本身的特性影响外,杂质控制是安全性控制最重要的一环。本品根据其结构有机杂质控制主要包括有关物质、手性异构体、聚合物杂质这几个方面。
2.2.1 有关物质
有关物质是杂质控制中最重要的控制手段,我们通过紫外、质谱两种检测器,对比了两来源样品的有关杂质分布,未见新亚样品有需报告的杂质种类的不同,已有杂质的含量未见明显高于原研品或超出标准规定。
采用高效液相色谱检测,条件同2.1.1,流动相梯度洗脱见表2。

表2 有关物质流动相梯度表
供试品配制方法:取本品约6.5 mg,精密称定,至10 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
对照品配制方法:精密量取上述供试品溶液1 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀,即得。测定结果见表3。

表3 有关物质测定数据对比
作为HPLC-UV方法检测有关物质的补充,我们同时开发了LC-MS方法,并对两厂家样品进行了检测,测定结果显示,新亚样品与原研比对,在LC-MS谱图上未见明显的新增杂质,已有杂质的含量水平基本不高于原研品(图2 A、B)。针对两产品的质谱形貌,我们对正负离子模式下获取的信息均进行了比对,确证了主成分正负离子模式的可靠性(图2 C、D)。
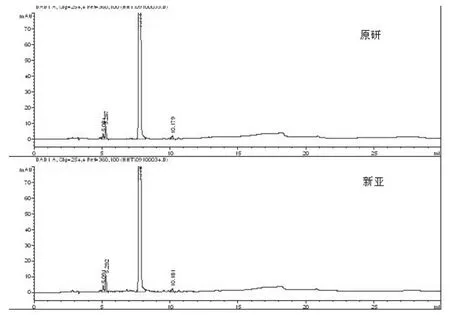
图1 有关物质检测图(HPLC-UV)
2.2.2 聚合物杂质
聚合物杂质是抗生素类产品中容易产生的杂质,同时也经常与过敏等安全因素相关[5-6],因此我们对两产品的聚合物杂质采用分子排阻色谱法进行了对比测定,测定结果无差异。
方法:采用高效液相分子排阻色谱法。
流动相A:0.1 mol/L磷酸盐缓冲液[0.1 mol/L磷酸氢二钠溶液-0.1 mol/L磷酸二氢钠溶液(61:39),pH 7.0],流动相B:水,流速:1.5 ml/min,检测波长:254 nm,进样量 :100 µl。
对照品溶液的制备:取头孢曲松对照品适量,精密称定,加水溶解并定量稀释成每ml约含0.1 mg的溶液。以流动相B进行测定。

图2 LC-MS检测杂质分布图
供试品溶液的制备:取本品适量,精密称定,加水溶解并定量稀释成每ml约含20 mg的溶液。以流动相A进行测定。
限度与计算:按外标法以峰面积计,含头孢曲松聚合物以峰面积计,不得过0.5%。
测定:经系统适用性评价后对新亚和原研头孢曲松钠的聚合物进行测定,结果分别为新亚样品含0.39%、原研含0.32%,均符合中国药典2010版规定(≤0.5%)。
2.2.3 比旋度与手性分析
头孢曲松钠结构中存在多个手性中心,为避免手性异构体杂质引起的实际有效性下降或安全风险增加,各国药典在标准中都进行了考虑,其中中国药典、日本药典均采用比旋度进行控制[1,7]。美国药典采用手性高效液相色谱法进行控制[8]。
我们在工作中,对比旋度和高效液相手性分离法都进行了考查,两样品比旋度测定数据均符合限度要求。采用美国药典及其他多种手性固定相分析,均未检测到其他构型的杂质。比旋度测定数据见表4,高效液相E型异构体检测,未检出E型异构体(图3)。

表4 比旋度测定数据对比
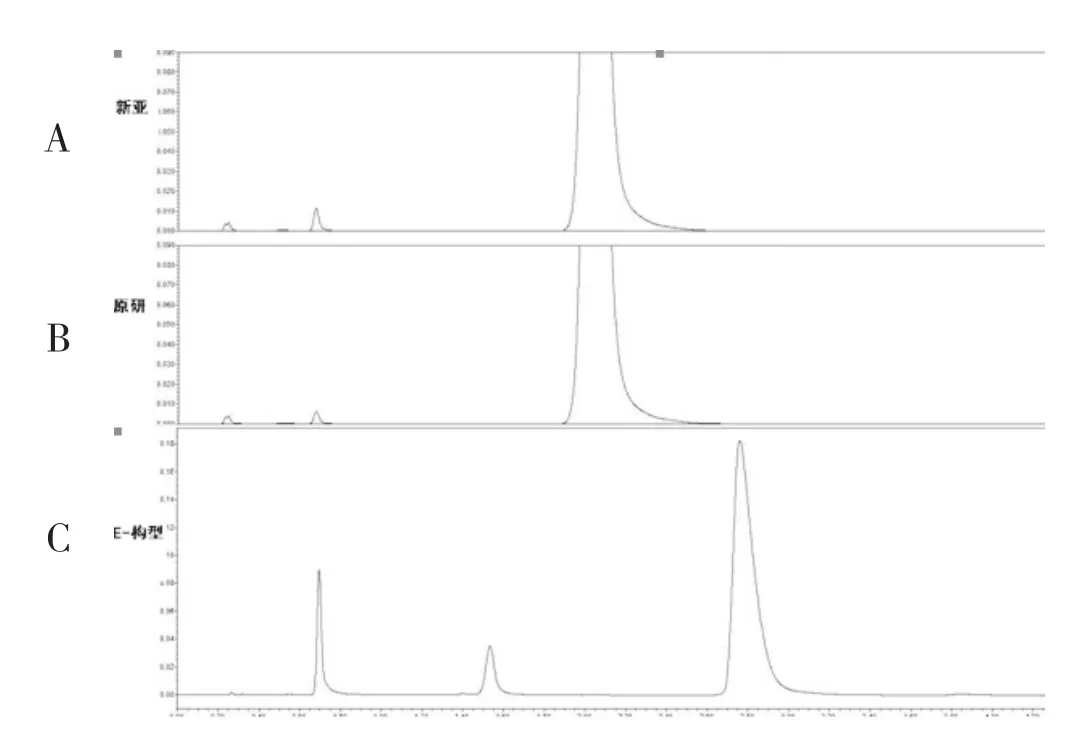
图3 异构体杂质对比
上述有关物质、聚合物杂质、手性杂质的数据表明,两产品在有机杂质水平上无明显差异。
为从不同角度考察两样品纯度、验证样品结构的正确性,我们对两来源样品进行了元素分析检测(表5),其结果均与理论量一致(图4)。
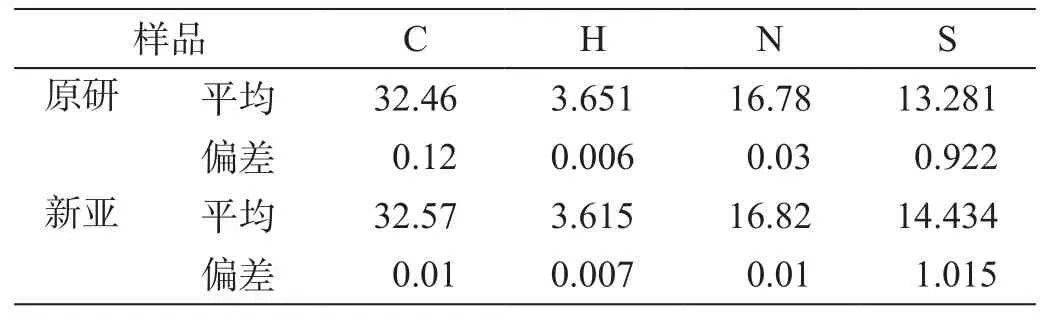
表5 元素分析测定数据(%)
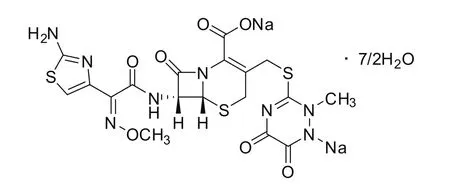
图4 头孢曲松钠的化学结构和分子式
元素分析数据表明,两样品在主要元素的组成上,与理论量一致,进一步从元素组成上验证了两样品的纯度和结构的正确性。
2.3 理化相关指标的对比与分析
首先对两样品的溶解度、澄清度、酸碱度进行了考察[9-11]。
2.3.1 澄清度、酸碱度与溶解度
参照中国药典pH测定、澄清度检查及溶解度测定相关要求进行测定,两样品上述几项指标的测定结果无明显差异(表6)。

表6 澄清度、酸碱度、溶解度对比
2.3.2 粒度、结晶性与热分析
从样品理化特性差异对比的角度,我们还对两样品的粒度分布、X粉末衍射与差示扫描量热的特性进行了对比。结果显示原研样品95%粒径小于9.82 µm,新亚样品95%粒径小于51.84 µm。x-粉末衍射与DSC测定结果无明显差异。
3 讨论
本研究从探寻注射用头孢曲松钠国产仿制制剂与原研制剂物质基础差异的角度出发,对上海新亚与原研注射用头孢曲松钠在含量、有关物质、异构体杂质、聚合物杂质、临床用药、理化特性等方面进行了对比研究。结果显示,两企业产品在我们所考虑到的影响其有效性、安全性相关的一系列指标上无明显差异。粉末粒度分布的差异未影响产品宏观溶解行为,应对产品的有效性与安全性无影响。
[1] 国家药典委员会. 中华人民共和国药典2010版(二部)[M].北京: 中国医药科技出版社, 2010: 181.
[2] 刘晓兰, 李凌春, 周金彩. 头孢曲松钠与常用输液配伍的稳定性[J]. 药物研究, 2005, 2(20): 47.
[3] 郑妍, 李广乾, 刘敏. 头孢曲松钠在不同浓度氯化钠、氯化钾水溶液中的稀释过程热力学[J]. 聊城大学学报(自然科学版, 2013, 26(1): 57-64.
[4] 孙忠实, 朱珠. 头孢曲松钠与钙剂配伍问题之释疑[J]. 中国医院用药评价与分析, 2007, 7(2): 85-88.
[5] 任学毅, 李绪伦, 李宁, 等. 超声处理对β-内酰胺类抗生素高分子杂质含量的影响[J]. 儿科药学杂志, 2005, 15(1):38-40.
[6] 江晓玲, 刘昆, 邓俊丰, 等. 头孢菌素类抗生素中高分子杂质的研究进展[J]. 国外医药(抗生素分册), 2007, 28(6):264-269.
[7] 日本厚生労働省. JP XVI[EB/OL]. [2013-06-03]. http://www. drugfuture. com/Pharmacopoeia/JP16/.
[8] The United States Pharmacopeial Convention. USP32-NF27[M]. Rockcille: The United States Pharmacopeial Convention, 2009: 1862.
[9] 李艳枫, 王晶. 头孢曲松钠生产工艺与色级的关系[J]. 黑龙江医药, 2010, 23(2): 203-205.
[10] 邓凯顺, 王鹏辉, 宋表, 等. 提高非无菌头孢曲松钠溶液澄清度的探讨[J]. 河北医科大学学报, 2006, 27(5): 441-442.
[11] 王海荣, 张春桃, 王永莉. 加晶种控制头孢曲松钠溶析结晶产品粒度分布的研究[J]. 中国抗生素杂志, 2009, 34(6):337-340.

