草地早熟禾胚胎结构石蜡切片制作方法初探
田晨霞,张咏梅,马晖玲
(1.甘肃农业大学草业学院,甘肃 兰州 730070; 2.草业生态系统教育部重点实验室,甘肃 兰州 730070;3.中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 4.甘肃农业大学研究测试中心,甘肃 兰州 730070)
采用石蜡切片技术了解植物胚胎发育过程已经成为研究植物生殖现象的重要手段之一。石蜡切片是观察植物组织结构常用的技术之一,在研究植物形态建成、植物杂交育种、特殊植物的培育和鉴别等方面应用较多[1-2]。草地早熟禾(Poapratensis)为禾本科早熟禾属多年生草本植物,具有兼性无融合生殖的特性[3]。借助石蜡切片技术,可对草地早熟禾胚胎的显微结构及其发育过程进行研究,从而确定各种草地早熟禾品种及野生材料的生殖方式及无融合生殖比率,也可为早熟禾属种质的杂交亲本选择、杂交优势预测及新品种选育提供理论依据。
在石蜡切片技术中,确定和优化影响切片质量的各关键因素,是保证供试材料细胞学和胚胎学研究顺利实施的关键和基础。石蜡切片的制作包括样品的采集、固定、脱水、透明、浸蜡、包埋、切片、展片、贴片、烘片、脱蜡、染色和封片等一系列过程[4]。不同的植物材料或同一植物的不同组织、器官,其材料的固定、透明、浸蜡、展片、烤片及染色等过程均存在显著差异。前人已对不同材料不同组织的切片方法进行了大量改进。苏印泉等[4]在传统石蜡切片法的基础上,对固定、软化、包埋及染色等步骤进行了适合松萝属植物特点的改良,制得了组织完整、染色清晰的松萝切片。何承坤等[5]利用番红-固绿两种染液对植物石蜡切片进行一步双重整体染色,这两种染料能一次性地进行双重染色,因组织不同着色不同,红绿鲜明,分色效果良好。由于植物的生殖生长阶段是植物生长的重要阶段,观察花器官的显微结构也是了解植物生殖过程常用的手段之一,因此,如何通过石蜡切片观察植物生殖过程成为人们关注的焦点。为了观察板栗(Castaneamollissima)雄花序的解剖结构,韩宝等[6]采用改良的切片技术将制片时间缩短为原来周期的1/3,并获得质量同常规方法无区别的切片。于小刚等[7]以粳稻(Oryzasativasubspkeng)开花后不同天数的颖果为试材,对传统石蜡切片技术中固绿染色时间进行试验,发现不同时期的材料所需固绿染色时间不同。赵桂琴和曹致中[8]应用胚囊整体染色透明法,对不同品种和来源的草地早熟禾无融合生殖进行了研究。杨弘远[9]、李和平等[10]用胚囊整体透明法结合切片法对草地早熟禾胚胎发育进行了研究,取得了很好的效果。
由于草地早熟禾花极小且颖片和稃角质化,浸蜡比较困难,切片易碎,草地早熟禾胚胎发育的石蜡切片技术方面的研究报道相对较少。近年来,国内外在利用石蜡切片技术观察粮食作物和油料树木[11]胚胎发育方面的研究相对较多,而草地早熟禾生殖现象的观察多借鉴高粱(Sorghumvulgare)[12-13]和水稻[14-15]的石蜡制片方法。但因材料大小存在差异,利用粮食作物石蜡切片法观察草地早熟禾的胚胎发育过程存在一定困难。目前,子房整体透明法,因其程序相对简单、制片周期短、成功率高,成为草地早熟禾胚胎发育的首选研究方法,但在观察胚胎过程中,受胚珠外子房壁的影响,不能直接清晰地观察到细胞层面。石蜡切片技术是观察植物解剖结构的重要方法之一,草地早熟禾胚胎制片过程中采用常规石蜡切片法成功率低,但如果将石蜡切片技术加以改良,提高其成功率,这一技术将在观察胚胎发育过程中发挥重要作用。本研究以草地早熟禾胚胎为供试材料,对影响其石蜡切片质量的各关键因素进行优化,探讨石蜡切片制作过程中需要注意的各项技术环节的不足和改良措施,分析比较切片制作中经不同染色剂及染色时间处理所产生的效果,以期获取优质的草地早熟禾胚胎结构石蜡切片,为进一步开展草地早熟禾生殖特性研究提供理论数据。
1 材料与方法
1.1试验材料 选取无病斑、无虫害且生长状况良好的开花期草地早熟禾小穗轴。
1.2样品采集与固定 采集新鲜材料固定于70%乙醇浓度的FAA混合固定液(福尔马林∶冰醋酸∶70%乙醇=1∶1∶18)中。真空抽气 15~20 min,保证药品充分浸泡材料以迅速杀死细胞,防止细胞自溶,保存完整的细胞结构。24 h后转入70%乙醇中进行脱水处理或保存。
将材料置于70%乙醇中放在显微镜下用解剖刀和解剖针去掉早熟禾小花的内颖和外颖,并将每朵小花分离。
1.3脱水 采用酒精梯度浓度法脱水。脱水程序:70%(2 h)→85%(2 h)→95%(2 h)→100%(1 h)→100%(1 h),在脱水过程中将95%的酒精换为以95%酒精作溶剂的伊红溶液[1],摇床摇动脱水。
1.4透明 本研究采用的透明剂为二甲苯(Xylene),透明步骤在通风橱中进行。为防止材料发生收缩,采取逐级过渡的方法,即逐步从无水乙醇过渡到纯二甲苯中。该步骤为2/3无水乙醇+1/3二甲苯→1/2无水乙醇+1/2二甲苯→1/3无水乙醇+2/3二甲苯→二甲苯I→二甲苯II。纯二甲苯更换两次,以除尽乙醇。
1.5浸蜡与包埋 选用熔点为52~56 ℃的石蜡浸蜡,各级浸蜡时间及温度如表1所示。包埋前事先备好冰袋,将蜡液倒入包埋盒中并平置于冰袋上降温,待底层蜡液稍有凝固后迅速将材料移入包埋盒中,立刻置于冷水中待其凝固。
1.6修块及固定 取出包含有材料及蜡块的小纸盒,除去包被蜡块周围的纸,露出包含有材料的蜡块。依据材料所处位置,将蜡块切割并修成下宽上窄的梯形,使每个小块包含一个材料,注意上部矩形对边平行。滴几滴融化的蜡于小木块上,将梯形蜡块底部粘贴其上,使其粘贴牢固。
1.7切片、展片、烤片 切片前事先在展片台盛满蒸馏水,水温调至40 ℃,然后将切成的蜡带漂在水面中(亮面朝下),待蜡带平整后用干净的载玻片一端浸入展片台中并将蜡带轻轻移到载玻片上整齐排列,贴上标签放置在烤片台上,烤片台调至38 ℃,待载玻片上水珠蒸发后放在烘箱37 °C中烤片72 h,进行脱蜡染色。
1.8染色与封固
1.8.1番红-固绿双重染色法 染色中番红以水配制,固绿用95%乙醇配制。番红-固绿对染具体步骤为:脱蜡结束→100%乙醇(3 min)→95%乙醇(2 min)→83%乙醇(2 min)→70%乙醇(2 min)→50%乙醇(2 min)→35%乙醇(2 min)→番红染液(质量分数1%,1~12 h)→35%乙醇(2 min)→50%乙醇(2 min)→70%乙醇(2 min)→83%乙醇(2 min)→固绿染液(0.5%浓度,5~10 s)→95%乙醇(2 min)→100%乙醇(1 min)→2步透明(5~10 min)→封片→自然风干。
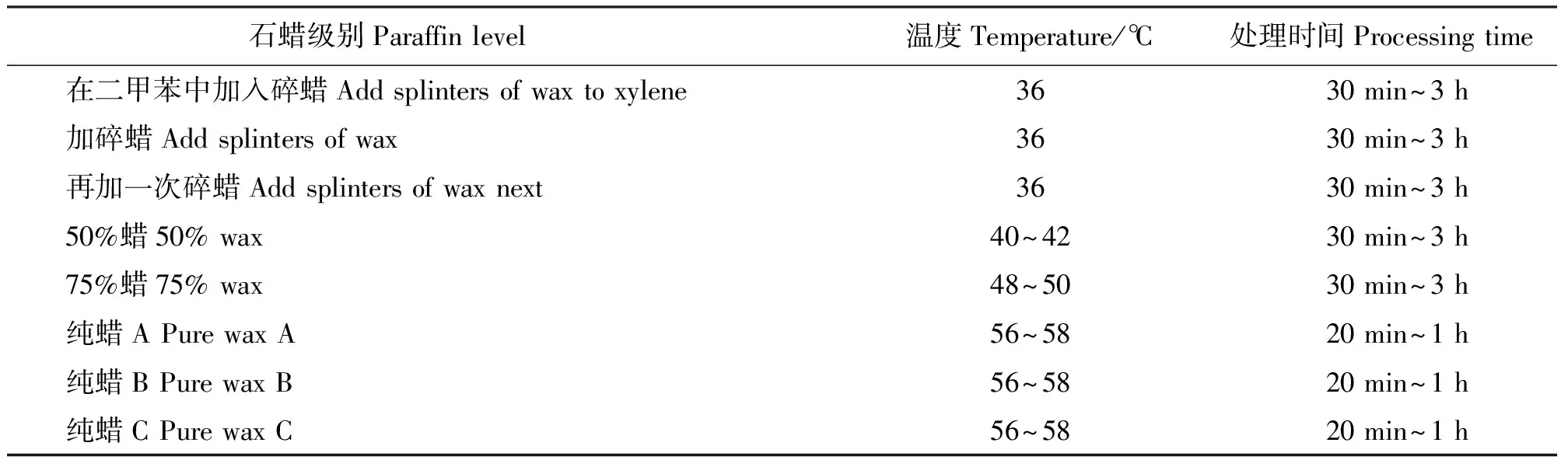
表1 各级蜡所需温度及浸蜡时间Table 1 Paraffin required temperature and time of each level
番红-固绿双重染色时采用4种染色组合:番红2 h+固绿5 s、番红3 h+固绿5 s、番红4 h+固绿5 s和番红4 h+固绿10 s。
1.8.2埃利希氏(Ehrlich’s)苏木精-伊红染色(H.E.)双染 埃利希氏苏木精的配制:苏木精1 g,纯酒精(或95%酒精)50 mL,冰醋酸5 mL,甘油50 mL,钾矾(硫酸铝钾)5 g,蒸馏水50 mL,瓶口用双层纱布包扎,放于通风处,直至变为紫红时即可使用。用前将原液一份加50%酒精与冰醋酸等量混合液稀释。
伊红用95%乙醇配制:材料前处理阶段进行脱水处理时将95%的酒精换为以95%酒精作溶剂的伊红溶液[1]。脱蜡后进行“复水”,染色,具体步骤为:脱蜡结束后→100%乙醇(3 min)→95%乙醇(2 min)→83%乙醇(2 min)→70%乙醇(2 min)→50%乙醇(2 min)→35%乙醇(2 min)→蒸馏水(2 min)→4%铁矾(10 min)→流水冲洗(10 min)→蒸馏水过一下→埃利希氏苏木精(0.5%浓度,10~30 min)→自来水返蓝(10~30 min)→2%铁矾(8 s)→自来水(10 min)→35%乙醇(2 min)→50%乙醇(2 min)→70%乙醇(2 min)→83%乙醇(2 min)→伊红(0.5%浓度,5 min)→100%乙醇(2 min)→两步透明(5~10 min)→封片→自然风干。
埃利希氏苏木精-伊红双重染色中采用3种染色组合:苏木精10 min-伊红10 min+自来水返蓝10 min、苏木精20 min-伊红20 min+自来水返蓝20 min和苏木精30 min-伊红10 min+自来水返蓝30 min。
2 结果与讨论
2.1材料处理对石蜡切片质量的影响 草地早熟禾为圆锥状花序,每个小穗有内、外颖,均由3~4朵小花组成,每朵小花的体积不足2 mm3,每朵小花由内、外稃包被,颖片和稃均角质化。在切片制作过程中,这样的结构使得药品不易通过角质化的颖片和稃片透入材料内部,造成材料质量不均一,后期切片易破裂,很难观察到完整的子房结构和胚胎的发育过程。若剥除内外稃片,则因草地早熟禾内、外稃包被紧密,剥除过程大量子房破裂,损伤材料,从而影响观察结果。草地早熟禾的子房极小,在后期换药及包埋过程中给试验的操作造成了极大的困难。对于脱水过程中将95%的酒精换为伊红溶液(95%酒精作溶剂),在染色前观察到草地早熟禾小花的稃片往往被染为浅红色,子房几乎未被染色,而在后期的透明、浸蜡及包埋过程易于观察材料,且对后期染色过程亦无影响,故在材料选取中保留稃片。
2.2样品脱水程序的改良及效果分析 因草地早熟禾的小穗外有颖片,每朵小花外有稃片,颖片和稃片表皮角质化致使脱水剂透过组织受阻,可采用摇床摇动脱水[16]。增加脱水剂与材料表面的接触机会,从而提高脱水效率并缩短脱水时间。直接采用无水乙醇脱水必会导致材料组织硬化,应采用梯度浓度法脱水。脱水过程中严格控制脱水时间,不宜过长,起始脱水剂浓度也不宜过高,否则组织会变硬变脆。本研究采用常规的石蜡脱水程序,即70%酒精(2 h)→85%酒精(2 h)→0.5%伊红溶液(95%酒精为溶剂,2 h)→100%酒精(1 h)→100%酒精(1 h)。
与常规石蜡切片法相比,将95%的酒精换为0.5%的伊红溶液(95%酒精作溶剂),可在后期透明、浸蜡、包埋、切片过程中避免因草地早熟禾颖花小而不易观察,材料因无色透明而造成丢失。在染色过程中由于再次用到伊红而不影响染色,可在应用过程中获得较好的效果。
2.3浸蜡与包埋方法改良及效果分析 浸蜡是通过包埋剂代替透明剂且渗入整个组织,来支撑整个组织并稳定其结构的过程[16]。草地早熟禾稃片角质化而造成浸蜡困难,在浸蜡过程中需要有多个梯度,一点一点加入碎蜡,通过二甲苯这一介质使蜡进入子房中。浸蜡温度过高会引起组织收缩,造成切片中材料变形;过低则使石蜡不能完全熔化,难以均匀地渗透到组织内部且组织材料中易混有气泡,切片过程中易发生断片、掉片或切片呈空洞蜡带。本研究选用熔点为52~56 ℃的石蜡浸蜡。按照常规包埋程序因石蜡凝固慢,造成一些嫩小材料的包埋困难[17]。针对此问题,在包埋前事先备好冰袋平置于台面,放入包埋材料后将蜡液平置于冰袋上降温,待底层蜡液稍有凝固后迅速将材料移入盛有冷水的包埋盒中凝固。此法可使材料稳定性提高,易于掌握。
2.4切片、展片和烤片及方法的改良和效果分析 切片成败不仅与切片前一系列处理有关,而且与切片过程中的操作密切相关[18]。切片时用力应均匀一致,不宜过重过猛,否则容易造成切片厚薄不均且蜡带卷曲。常规贴片是将蜡带放到贴片板上,石蜡切片法中传统的贴片方法主要为烫片台法,即在一定的温度下进行摊片、用甘油蛋清粘片。这种贴片方法速度慢,操作时还易出现蜡带中间有皱褶、组织材料不能完全展开的现象;且过程烦琐,贴出的片子在脱蜡过程中,蛋清甘油不易脱落,造成切片染色后蛋清甘油染色,使切片背景模糊,影响材料的后期观察。本研究采用改良的方法,即在切片前在展片台盛满蒸馏水,调节水温至40 ℃,然后将切成的蜡带漂在水面中,亮面朝下,待蜡带平整后,用干净的载玻片一端浸入展片台中将蜡带轻轻移到载玻片上,整齐排列,贴上标签放置在烤片台上烤片。采取此方法贴片速度快,展片效果良好,且一次可获得较长蜡带,可以从中选择最理想的材料,选择余地大,对于连续或不连续切片都适宜。
在石蜡切片制作过程中,因粘片剂的有无,植物组织大小的不同,所需烤片时间也不同。将刚从温水中捞出的切片放在38 ℃烤片台烤片,待载玻片上水珠蒸发后放置37 °C烘箱中烤片72 h进行染色。采用此改良方法,可使蜡带不起皱、硬度适中且不粘连,确保材料组织的完整性,且样品染色背景干净清晰。在本试验过程中因材料小,未使用粘片剂,烤片时间需不少于72 h才能保证在染色过程中不会脱片。
2.5各种处理的染色效果对比
2.5.1番红-固绿双重染色效果 采用番红-固绿双重染色,在不同染色时间组合下均未取得良好的效果。在染色过程中番红染色2 h,固绿染色5 s时,细胞核染色清晰,细胞壁亦明显,番红-固绿分色效果不明显,胚胎处细胞集中区染色较深,细胞核颜色发蓝,细胞壁绿色较淡;番红染色3 h,固绿染色5 s时,细胞核染色清晰为紫色,细胞壁染色不明显,部分区域番红染色集中,番红-固绿分色不明显,胚胎处细胞集中区染色较深;番红染色4 h,固绿染色5 s时,细胞核染色较深为紫色,细胞壁不明显,部分区域番红染色集中,番红-固绿分色不明显,胚胎处细胞集中区染色太深;番红染色4 h,固绿染色10 s时,整个材料染色过深,胚胎部位细胞染色极深,细胞边缘不明显,无分色效果(表2、图1)。
2.5.2埃利希氏苏木精-伊红染色效果 采用3种染色处理,经苏木精-伊红双重染色后,细胞核着蓝紫色,其余部分为淡红色。 本研究表明,不同染色剂和染色时间处理下所表现出的染色效果均不同。埃利希氏苏木精-伊红染色过程中,苏木精染色10 min,伊红染色10 min,自来水返蓝10 min,胚胎处细胞核浅红色,细胞壁染色浅,细胞边缘不明显;苏木精染色20 min,伊红染色10 min,自来水返蓝20 min,胚胎处细胞核粉红色,细胞壁染色较浅,细胞间边缘明显;苏木精染色30 min,伊红染色10 min,自来水返蓝30 min,胚胎处细胞核紫色,细胞壁粉色,深浅分明,不同部位颜色不同,染色效果较好。相比较,苏木精染色30 min,伊红染色10 min,自来水返蓝30 min的处理下显示出良好的效果(表3、图2)。
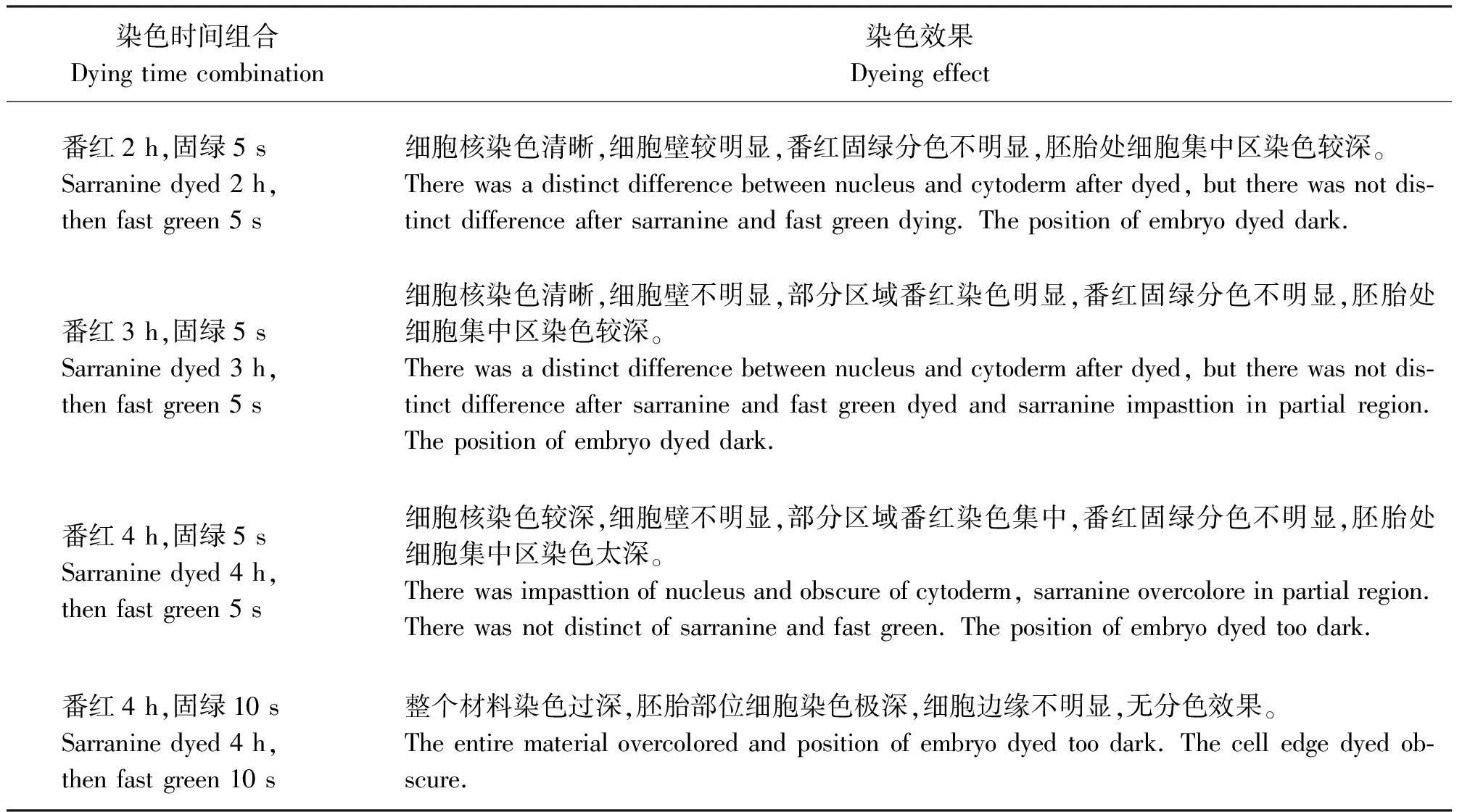
表2 番红-固绿不同染色时间处理下的效果比较Table 2 Comparison of dying effects with different Sarranine-Fast green dying times
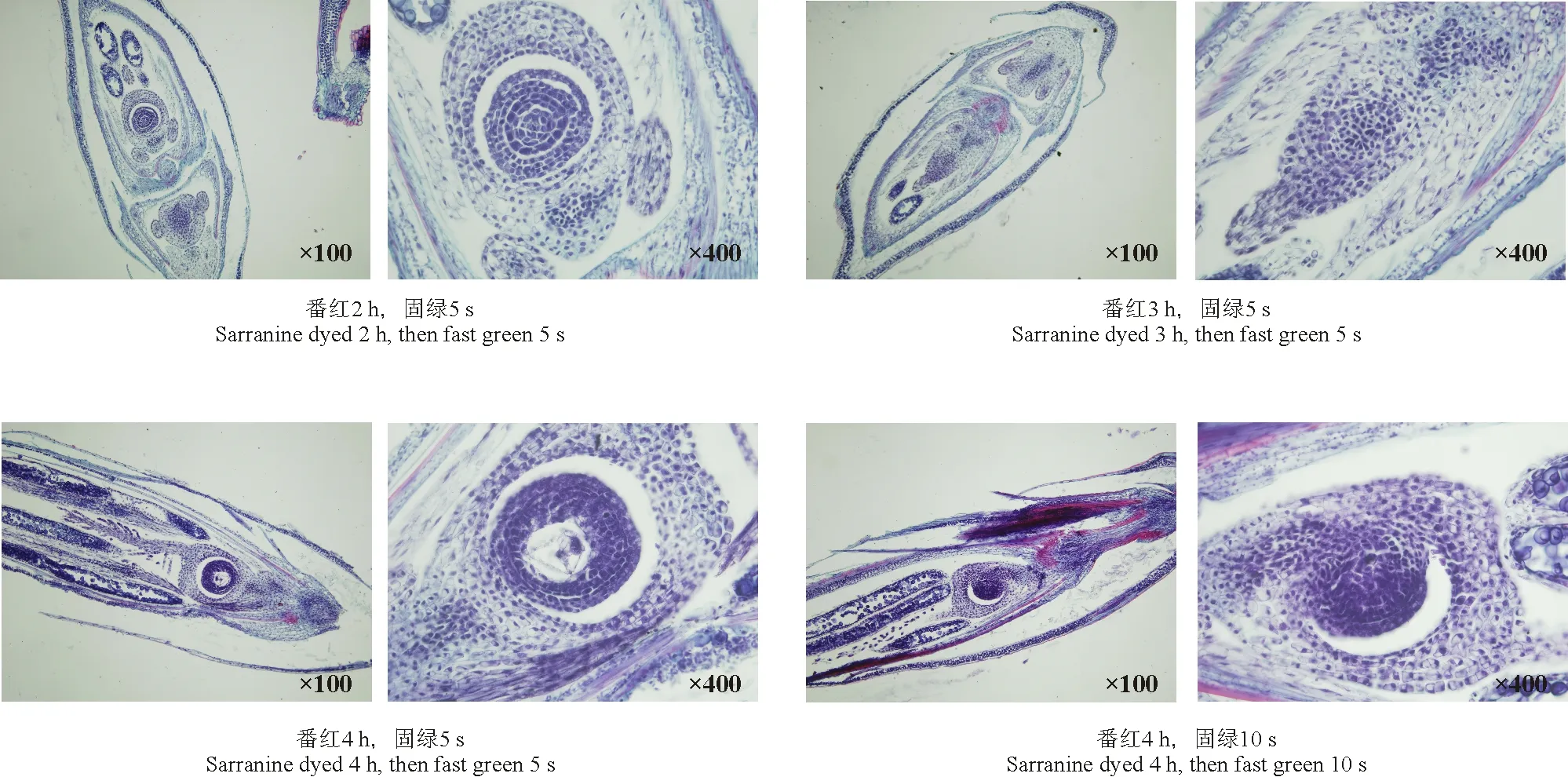
图1 番红-固绿不同染色时间下的染色效果图Fig.1 Comparison of dying effects with different Sarranine-Fast green dying times
2.5.3草地早熟禾胚胎石蜡切片过程中染色剂的选择及染色效果 植物组织制片过程应根据观察目的、样品的结构来选择适当的染色方法。植物制片中使用的染料种类较多,根据染色时所用染料的种类可分为单染、双重染色及多重染色。在石蜡切片制片过程中一般采用双重染色法,番红-固绿染色法和苏木精-伊红是双重染色法中最常用的两种染色方法。
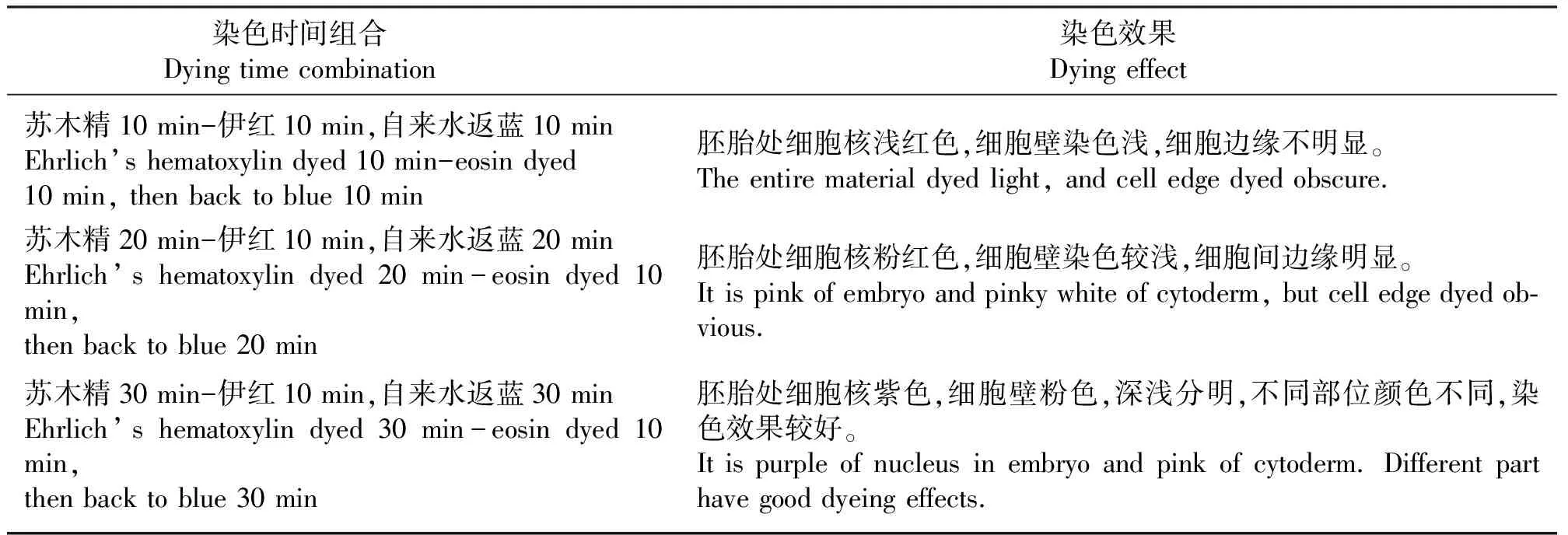
表3 苏木精-伊红及染色时间处理下的效果比较Table 3 Comparison of dying effects with different Ehrlich’s hematoxylin-eosin dying times
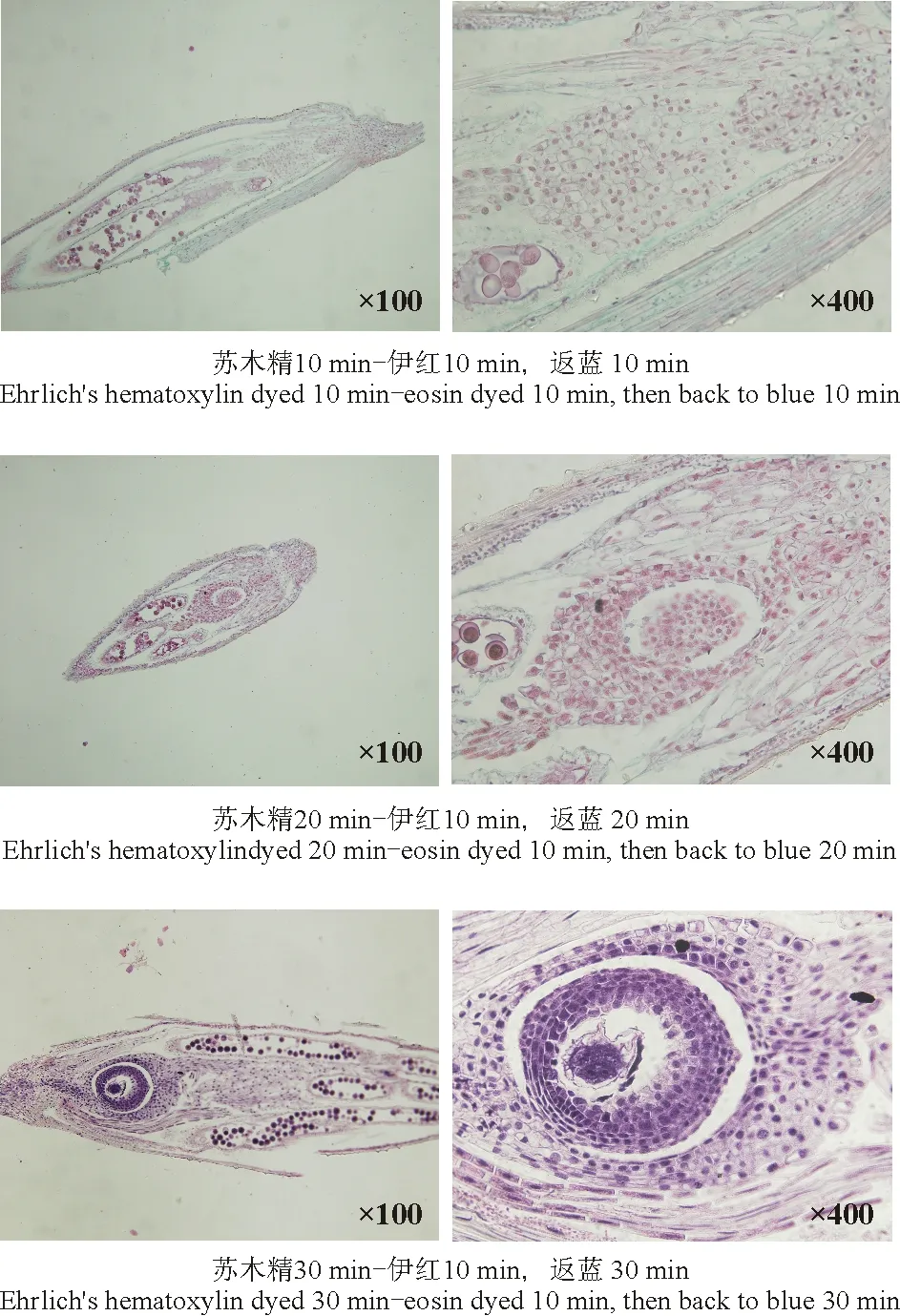
图2 埃氏苏木精-伊红对染中不同染色时间及返蓝时间的染色效果图Fig.2 Comparison of dying effects with different Ehrlich’s hematoxylin-eosin dying times
番红-固绿对染法适用材料为一般植物组织,特别是分生组织。其染色目的是将染色质、细胞质、纤维素细胞壁与木质化细胞壁区别开[1]。草地早熟禾子房小,胚珠细胞小而集中,细胞核占据整个细胞的大部分位置,细胞质少。对草地早熟禾胚胎石蜡切片采用番红-固绿对染法染色后存在细胞界线不清,核仁不清晰等缺点,相比之下,苏木精-伊红染色法的目的是将细胞核、细胞质区别开,染色过程中经本试验确定的时间染色后,草地早熟禾胚胎处色彩艳丽,核膜、核仁清晰,细胞界线明显。
本研究采用埃利希氏苏木精-伊红双重染色的3种染色组合:即苏木精10 min-伊红10 min+自来水返蓝10 min、苏木精20 min-伊红10 min+自来水返蓝20 min和苏木精-伊红10 min+自来水返蓝30 min,此过程中只有苏木精染色和自来水返蓝时间变化,伊红染色时间为10 min不变。结果表明,苏木精30 min-伊红10 min、自来水返蓝30 min的处理下细胞核部分染色较深,细胞壁部分颜色浅,细胞边缘清楚,能较好地观察胚胎发育过程。
3 结论
草地早熟禾胚胎石蜡切片过程并不复杂,但每一个操作步骤都至关重要,要制作出高质量的石蜡切片,必须对制作石蜡切片过程中的每一环节予以重视。本研究通过对石蜡制片中的一些步骤进行改进,得出苏木精30 min-伊红染色10 min、自来水返蓝30 min处理下的细胞核部分染色较深,细胞壁部分颜色浅,细胞边缘清楚,能较好观察胚胎发育过程。
[1] 王灶安.植物显微技术[M].北京:农业出版社,1992:8.
[2] 李正理.植物制片技术[M].第二版.北京:科学出版社,1987:138-148.
[3] Grazi F,Umaerus M,Akerberg E.Oberservations on the mode of reproduction and the embryology ofPoapratensis[J].Hereditas,1961,47:489-541.
[4] 苏印泉,彭锋,黎斌,等.桦树松萝的石蜡切片方法改良及形态学研究[J].西北植物学报,2007,27(5):0859-0863.
[5] 何承坤,部伸坤,李家慎.植物石蜡切片一步双重整体染色[J].福建农学院学报,1989,18(4):565-569.
[6] 韩宝,冯永庆,秦岭.板栗雄花序石蜡切片改进方法的研究[J].安徽农学通报,2008,14(3):29-30.
[7] 于小刚,张文忠,韩亚东,等.粳稻颖果石蜡切片中染色时间的摸索及其解剖结构的观察[J].作物杂志,2010(5):80-83.
[8] 赵桂琴,曹致中.草地早熟禾无融合生殖的细胞学鉴定[J].草业学报,1997:64-70.
[9] 杨宏远.用整体染色与透明技术观察胚囊、胚、胚乳和胚状体[J].植物学报,1986,28(6):575-581.
[10] 李和平,孙蒙祥,蔡得田,等.草地早熟禾无融合生殖现象的研究[J].武汉植物学研究,1991(1):11-15.
[11] Zhang B,Wang Z J,Jin S H,etal.A pattern of unique embryogenesis occurring via apomixis inCaryacathayensis[J].Biologia Plantarum,2012,56(4):620-627.
[12] Wu S B,Han X M,Shang Y J,etal.Morphological characteristics of apomictic embryo in sorghum[J].Acta Agriculture Boreali-sinica,1994,9:12-15.
[13] 吴树彪,尚勇进,韩雪梅,等.高粱SSA-1 无融合生殖胚胎学研究[J].植物学报,1994,36(11):833-837.
[14] 姚家琳,蔡得田,马平福,等.水稻无孢子生殖的胚胎学研究[J].中国水稻科学,1997,11(2):113-117.
[15] 姚家琳,蔡得田.水稻HDAR细胞胚胎学研究——不定胚的发生和发育[J].武汉植物学研究,1997,15(1):5-9.
[16] 杨虎彪,李晓霞,罗丽娟.植物石蜡制片中透明和脱蜡技术的改良[J].植物学报,2009,44(2):230-235.
[17] 郑兴峰.植物石蜡切片法中细小或薄片状材料的包埋[J].生物学杂志,2003(4):41-43.
[18] 路健,王伶.石蜡切片制作中的问题与解决[J].基础医学教育,2001(3):263-264.

