俄罗斯杂花苜蓿再生体系的建立
张凌云,师尚礼,尹成学,崔国忠
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.甘肃省酒泉市林果服务中心,甘肃 酒泉 735000)
俄罗斯杂花苜蓿(Medicagosativasubsp.varia)从俄罗斯赤塔州引进,6年的引种试验(2001-2006年)证明该品种具有根系发达、主根入土深、适应性强、抗寒、耐旱、返青早、越冬率高及富含蛋白质且产量高等特性[1-2],是具有开发潜力的重要苜蓿种质资源,可作为改良苜蓿抗性品质、创造适宜寒旱环境种质的新遗传材料[3-9]。目前,国内对俄罗斯杂花苜蓿的研究仅限于引种试验[1-2],尚未见有关种质应用方面的研究报道。本研究拟建立一个操作简便、可重复性强且周期短效率高的俄罗斯杂花苜蓿再生体系,研究不同激素种类及组合对其再生体系的影响,以期为进一步开发利用其优良种质资源,进行细胞杂交及培育新的牧草品种奠定研究基础。
1 材料及方法
1.1试验材料 俄罗斯杂花苜蓿种子由甘肃农业大学草业学院提供。
1.2试验方法
1.2.1愈伤组织的诱导 挑选完整饱满大小均匀的俄罗斯杂花苜蓿种子,用蒸馏水冲洗浸泡30 min后,以升汞溶液浸泡10 min,再用酒精消毒处理1 min,无菌水洗涤3~5次后,接种在MS培养基上。在25 ℃下培养,光照强度为2 500 lx,光照周期为光照∶黑暗=16 h∶8 h。待5~7 d子叶完全展开而真叶尚未长出时,将其子叶及下胚轴剪切成3~5 mm,分别进行愈伤组织的诱导[10-11]。诱导愈伤所用基本培养基为添加了2.5%蔗糖和0.7%琼脂的MS培养基,先单独对不同浓度2,4-D(0.25~3.0 mg·L-1)进行试验[12],之后在最佳浓度2,4-D基础上对6-BA、KT、NAA 3种激素的3个不同水平进行L9(33)正交试验[13-16],试验设计见表1。
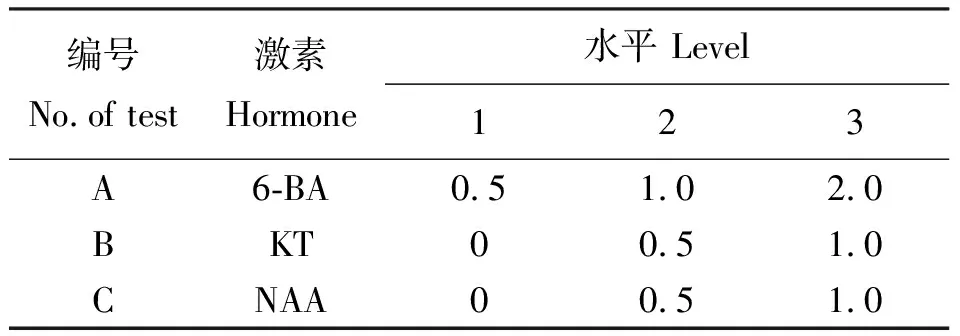
表1 L9(33)正交试验的因素与水平Table 1 Factors and levels of L9(34) orthogonal test mg·L-1
1.2.2愈伤组织的分化 待外植体在诱导培养基上培养30~45 d,挑选质地疏松、色泽鲜亮、胚性较好的愈伤组织转入分化培养基上进行分化培养,25 d后统计分化率,筛选愈伤组织分化最佳激素组合。
1.2.3生根培养及植株再生 将所得分化幼苗或不定芽(长1~2 cm)转至生根培养基上进行生根培养,15~20 d后,统计生根率。待大部分幼苗长出4~5条既粗且长的须根后进行炼苗。打开三角瓶的封口膜在室温条件下放置2 d,用自来水冲掉幼苗根部的培养基,移栽至装有配方土(蛭石∶营养土∶灰土=1∶1∶1)[17]的小花盆中培养,即可获得完整的再生植株。
1.2.4数据统计及分析 采用EXCEL和SPSS 16.0软件进行数据统计及分析,试验中每个处理重复3次。
出愈率=形成愈伤组织的外植体数/接入外植体总数×100%;
分化率=形成分化芽的愈伤数/接入愈伤总数×100%;
生根率=生根的分化芽个数/接种分化芽总数×100%。
2 结果与分析
2.1激素对愈伤组织诱导的影响
2.1.12,4-D浓度对愈伤组织诱导的影响 外植体在不同2,4-D浓度培养基上诱导培养3~5 d后均可发生萌动膨大现象,边缘处有明显的增殖细胞团,7~10 d后有肉眼可见的愈伤组织形成(图1)。继代2~3次后愈伤组织逐渐增多。下胚轴普遍出愈快,颜色较浅;子叶出愈慢,颜色较深。
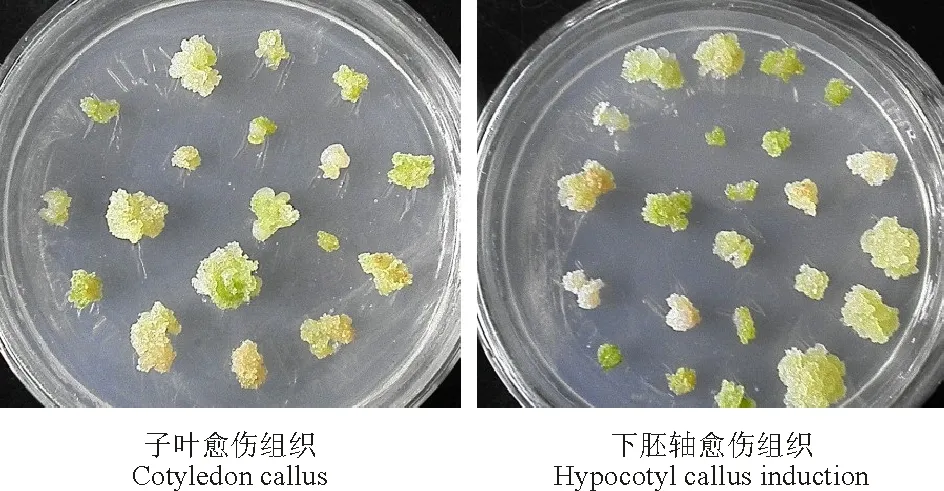
图1 愈伤组织诱导初期Fig.1 The beginning of callus induction
2,4-D浓度对愈伤组织诱导速度和出愈率起重要作用。随着2,4-D浓度的增加愈伤组织的诱导率也逐渐增大,E3浓度下子叶和下胚轴的出愈率均达到最高值,分别为90.0%和91.1%,此后出愈率反而随2,4-D浓度增加而降低;当2,4-D浓度上升为E6时,出愈率降至最低,分别为48.9%和54.4%(表2)。其中E3、E4的子叶和下胚轴所形成愈伤组织颜色为浅黄绿或浅绿色,质地疏松柔软,部分表面有突起颗粒,增殖速度较快;其余处理中下胚轴愈伤组织多为稀软糊状或表面呈绒毛状,增殖缓慢,易褐化死亡,子叶所得愈伤组织质地松脆易碎或表面呈白毛状,部分快速增殖后褐化死亡。由于良好的愈伤状态对后继的分化试验和原生质体的分离均有重要影响,因此,认为1.0 mg·L-1为诱导俄罗斯杂花苜蓿子叶和下胚轴形成愈伤组织的最佳2,4-D浓度。
根据愈伤组织的色泽、质地及生长快慢将获得的愈伤组织分为5个类型。Ⅰ:乳白色或浅黄色,质地稀软呈糊状,增殖速度缓慢,容易褐化死亡;Ⅱ:乳白色或浅黄褐色,质地坚密紧实,表面有雪花状或绒毛状物质,无分化能力,最终死亡;Ⅲ:浅黄绿色,表面为小颗粒突起,增殖较慢,有分化能力;Ⅳ:浅绿色,质地柔软疏松,有致密的绿色内核,表面突起,增殖较快,分化能力强,速度快;Ⅴ:黄色或浅绿色,表面有突起的颗粒,质地松脆易破碎,增殖迅速,易褐化。
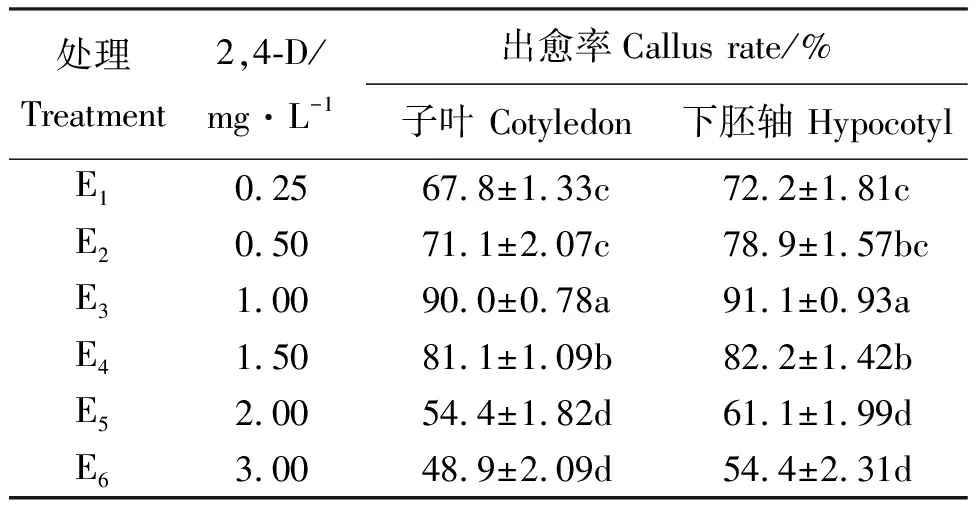
表2 不同2,4-D浓度对子叶和下胚轴愈伤组织出愈率的影响Table 2 Effects of different 2,4-D concentrations on callus
2.1.2不同激素浓度及组合对愈伤组织诱导的影响 本试验发现,虽然2,4-D对愈伤组织形成有明显的作用,但形成愈伤多为乳白色或黄色,组织结构不明显,分化能力差。因此,在2,4-D浓度为1.0 mg·L-1基础上对6-BA、KT、NAA 3种激素设计L9(33)正交试验。结果表明,以子叶为外植体时,T4的诱导效果最好,出愈率为91.1%(表3),愈伤状态为Ⅳ级(图2)。极差比较结果为A>B>C,因素和(Kimax)表明A2B1C3为最佳激素组合。方差分析结果显示(表5),A因素(6-BA)与子叶愈伤组织诱导间为极显著相关(P<0.01),B、C两因素(KT、NAA)为显著相关(P<0.05);各因素多重比较结果表明,A2B1C3为3种激素的最佳组合。综上分析可得,在MS+E3基础上1.0 mg·L-16-BA+0 KT+1.0 mg·L-1NAA组合为诱导子叶形成愈伤组织的最佳组合。
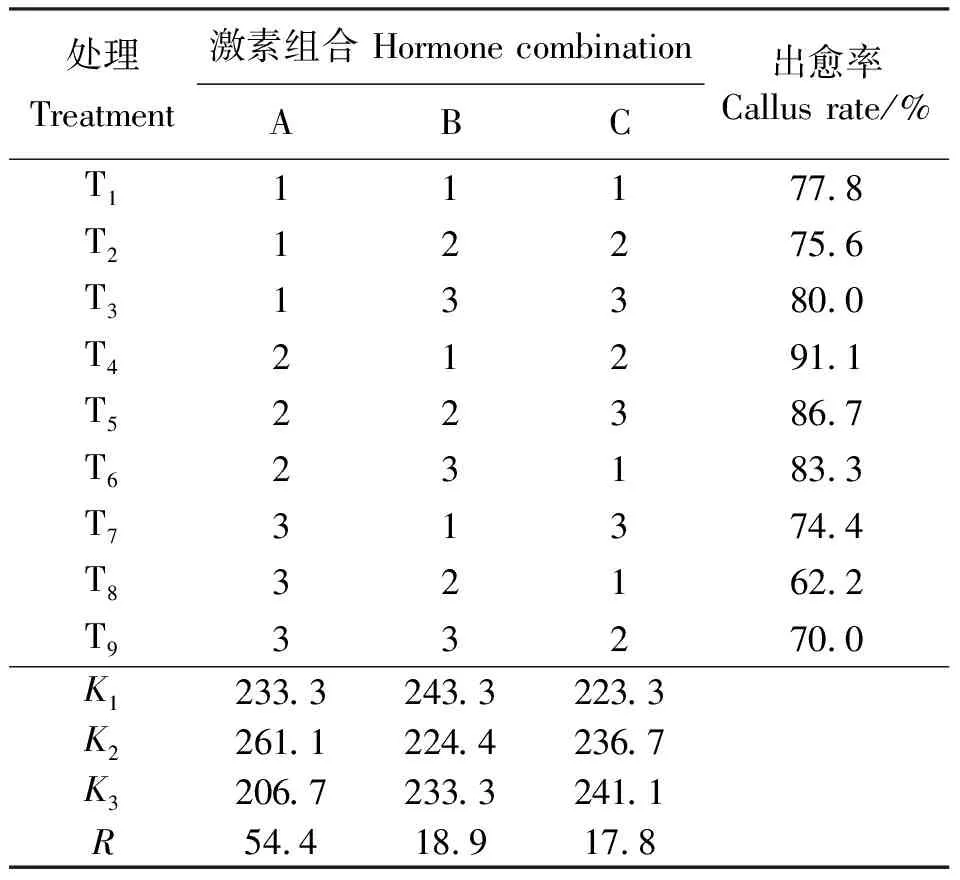
表3 子叶愈伤组织诱导正交试验设计表及结果Table 3 Results of orthogonal test for cotyledon callus induction
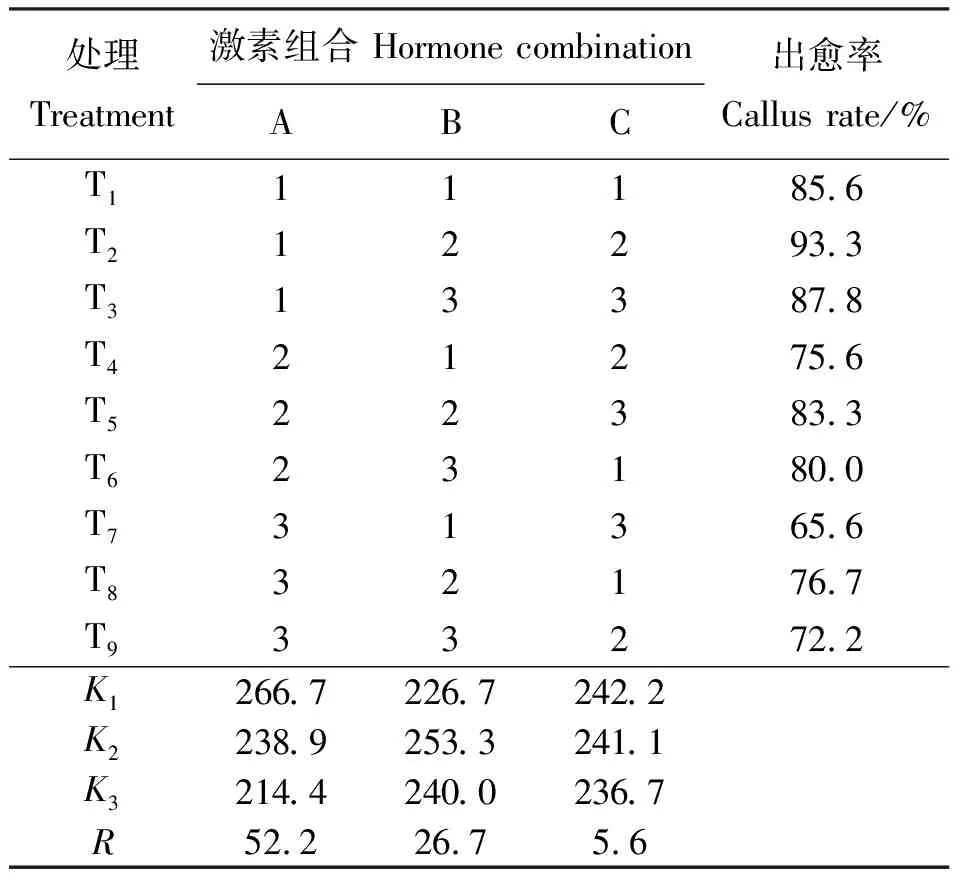
表4 下胚轴愈伤组织诱导正交试验设计表及结果Table 4 Results of orthogonal test for Hypocotyl callus induction
以下胚轴为外植体时,T2的诱导效果最好,出愈率为93.3%(表4),愈伤状态为Ⅳ级(图2)。极差比较结果为A>B>C,因素和Kimax表明,A1B2C1为最佳激素组合。方差分析结果显示,A、B两因素(6-BA、KT)与下胚轴愈伤组织诱导间为极显著相关(P<0.01),C因素(NAA)为显著相关(P<0.05),且6-BA效果最为显著,KT、NAA次之;各因素多重比较结果表明,A1B2C1为3种激素的最佳组合。综上分析,在MS+E3基础上0.5 mg·L-16-BA+0.5 mg·L-1KT+0 mg·L-1NAA为诱导下胚轴形成愈伤组织的最佳组合。
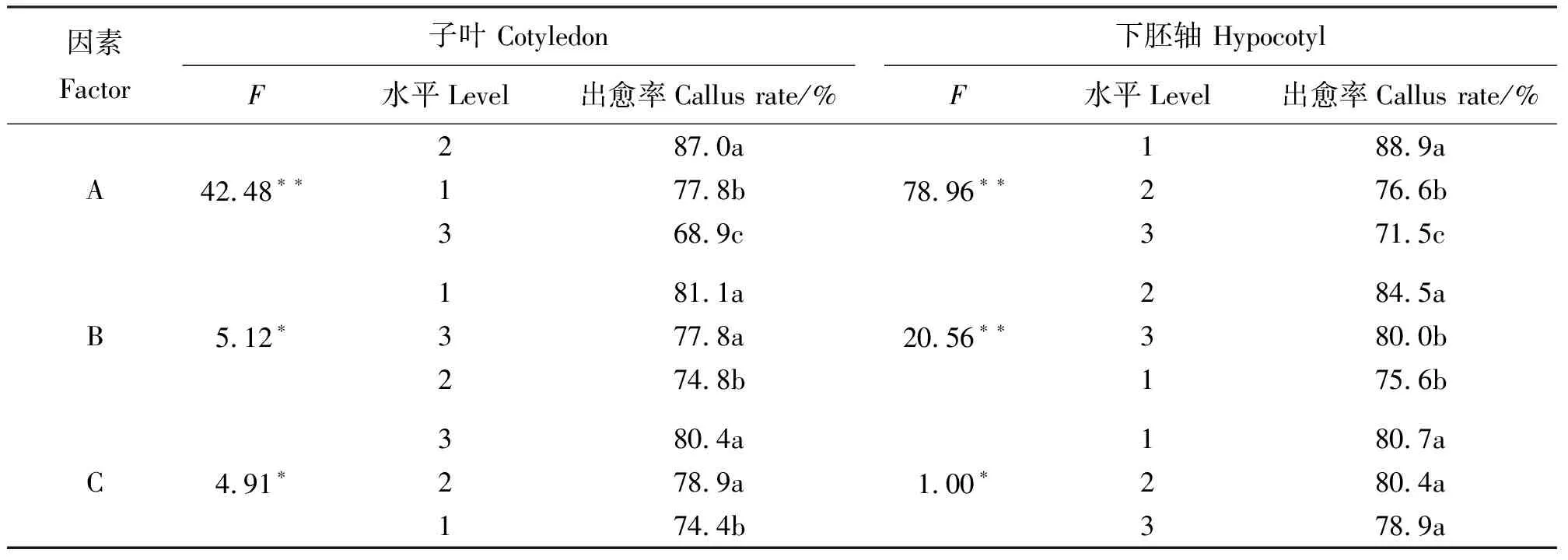
表5 方差分析及多重比较Table 5 Variance analysis and multiple comparison
2.2愈伤组织的分化 通过以上试验获得大量质地松软、色泽鲜绿且组织结构明显的愈伤组织后,将其转移到以MS为基础培养基,并添加不同浓度KT和NAA的分化培养基中(表6)。结果显示,8种分化培养基中子叶愈伤组织的分化率均高于下胚轴愈伤组织。其中,M6培养基的子叶愈伤组织与下胚轴愈伤组织分化率最高,分别为91.1%和83.3%,多重比较显示,M6与其它7个处理结果存在显著差异,且所形成的分化芽颜色鲜绿茁壮,说明M6为俄罗斯杂花苜蓿愈伤组织分化的最佳配比。愈伤组织经M6培养10~14 d后出现绿色芽点,20 d左右形成分化芽(图3),30 d左右可分化出叶片形成分幼苗(图3)。试验还发现,少数分化苗在形成过程中还伴有幼根形成。因此,使俄罗斯杂花苜蓿体细胞胚发生分化和形成分化芽效果显著的培养基是MS+0.5 mg·L-1KT+0.3 mg·L-1NAA。
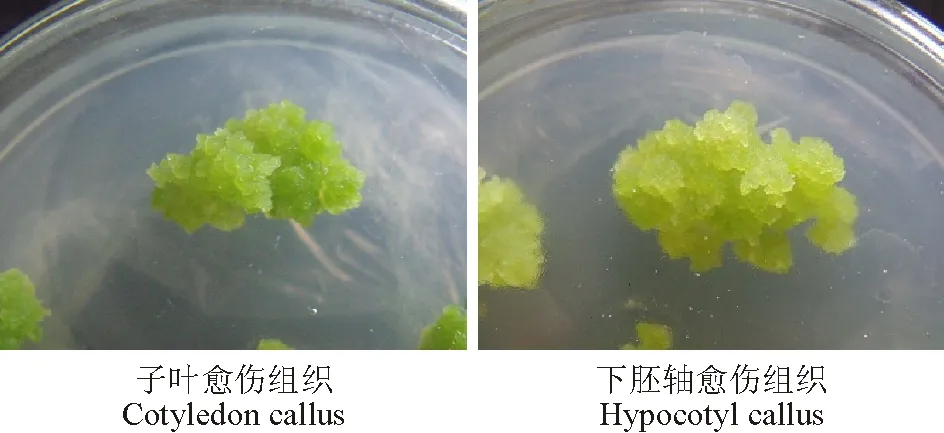
图2 Ⅵ级愈伤组织Fig.2 Ⅵ callus

图3 分化芽和分化苗 Fig.3 Differentiated buds and seedlings
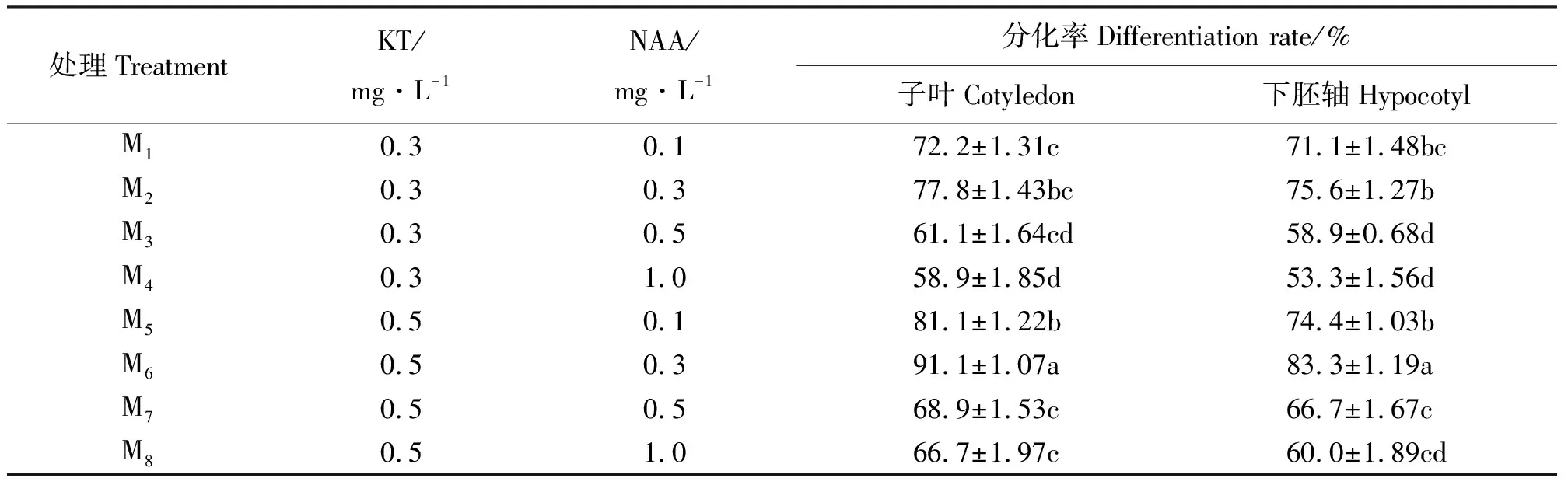
表6 不同激素组合对愈伤组织分化的影响Table 6 Effects of different phytohormone conbitions on embryogenic callus induction
2.3生根培养及再生植株的获得 将上述所得分化苗转移至装有生根培养基的三角瓶,培养生根。G6生根率最高,可达96.7%,生根速度快,根健壮粗长(表7)。多重比较显示,G6与其它处理生根率存有显著差异。说明生长素IBA比NAA更有利于生根,且低糖低无机盐的1/2 MS培养基较MS培养基的生根效果显著。分化苗转入生根培养基培养10~15 d可见根状突起形成,25~30 d后可形成正常根(图4)。当有3条以上长5 cm的粗壮根形成时即可炼苗移栽至花盆中,使其生长成完整的植株。
3 讨论
3.1利用正交设计法筛选最佳诱导愈伤组织的激素组合 植物愈伤组织诱导过程中植物生长调节物的种类及浓度的配比十分关键[18],为了诱导出质地及状态良好的愈伤组织,必须摸索适宜的激素组合。目前,在苜蓿愈伤组织诱导试验中多采用随机试验设计对植物生长激素种类及浓度进行配比研究,但此方法耗时费力且误差较大,故本研究对3种激素的3个水平进行L9(33)正交试验,通过对9种试验处理结果的数据分析,准确地综合评价各激素的影响力,优化筛选诱导俄罗斯杂花苜蓿愈伤组织的最佳激素组合,提高试验效率。
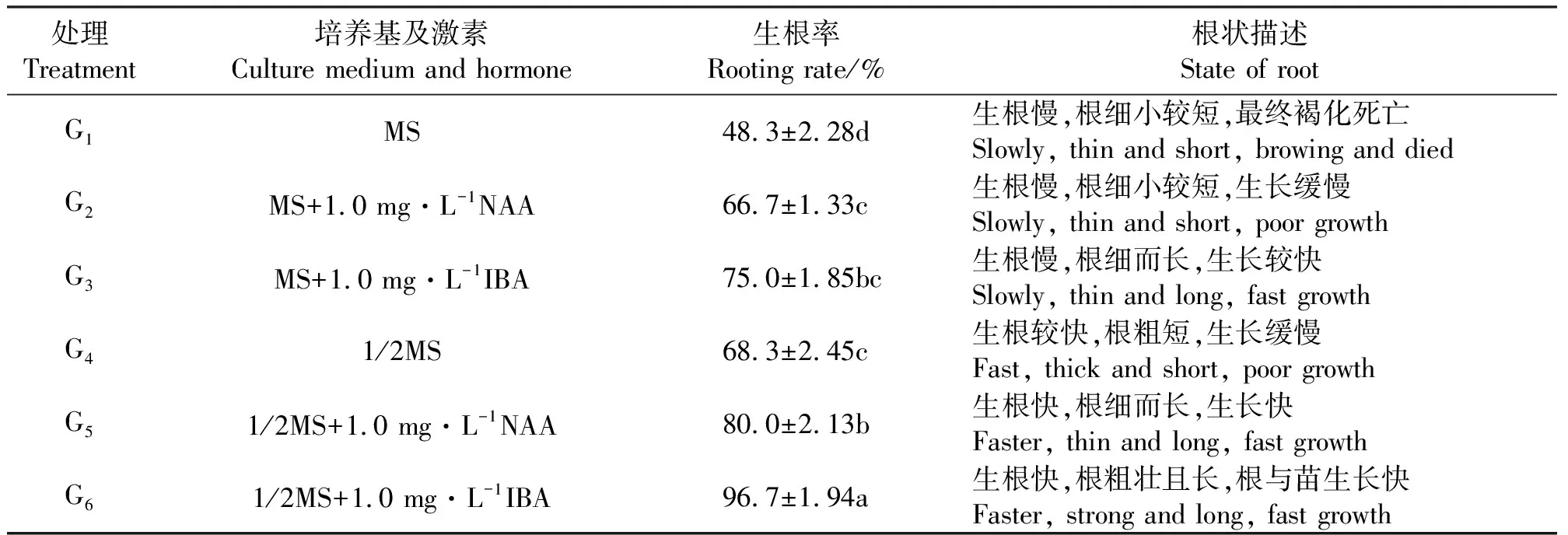
表7 不同培养基和激素浓度对生根率的影响Table 7 Effects of different medium and phytohormone on footing rate

图4 再生根系和再生植株 Fig.4 Regenerated roots and plants
3.2激素对愈伤组织诱导的影响 植物生长调节物质对愈伤组织的诱导具有重要作用,分为植物细胞生长素和植物细胞分裂素两类[18-20],豆科牧草组培试验中常采用的生长素有2,4-D、NAA、IBA,细胞分裂素有KT、6-BA、ZT等[21]。其中2,4-D是诱导愈伤组织时使用最多、作用明显的重要激素[22-23],但不是唯一激素,即2,4-D与其它激素组合和单独使用相比能更有效地形成良好的组织结构、质地及颜色。但在分化试验中随着2,4-D浓度增加,体细胞胚的分化能力明显下降[21],即2,4-D不适用于愈伤组织的诱导分化试验。本研究表明,适宜诱导俄罗斯杂花苜蓿子叶和下胚轴愈伤组织的2,4-D浓度为1.0 mg·L-1,这一结果与王姝杰等[17]的结论不同,说明不同苜蓿品种对2,4-D浓度的敏感性不同。在此基础上本试验又兼顾两类植物生长调节物质对6-BA、KT、NAA 3种激素进行愈伤组织诱导的正交试验,分析评价各激素的影响程度,综合优化了激素组合。试验发现,6-BA对俄罗斯杂花苜蓿愈伤组织诱导作用最高,KT和NAA次之,这与蔡文燕等[13]在紫花苜蓿(Medicagosativa)愈伤组织诱导研究中的结果相似。并且本研究发现,当KT浓度增大到1.0 mg·L-1时,易导致愈伤组织分裂增殖速度过快而疯长致死。
3.3激素对愈伤组织分化及再生的影响 本研究在分化试验中发现低浓度的KT、NAA对愈伤组织分化不定芽起到重要作用,当NAA浓度大于0.5 mg·L-1时,对愈伤组织的分化产生抑制作用。这与王娟等[12]在陇东野生紫花苜蓿研究中的结果一致。在使苜蓿分化苗生根培养的研究中常使用MS或1/2MS培养基[4,11],并添加不同浓度的NAA作为生根激素[12,17],本研究除设不同浓度NAA外,还采用了不同浓度IBA,分别对二者在生根作用中的影响进行比较。试验发现,IBA的生根作用显著高于NAA,生根率最高可达96.67%,且再生成的根系健壮粗长,可见IBA比NAA更有利于俄罗斯杂花苜蓿愈伤组织分化苗再生根形成。
[1] 吕绪清,吕新龙,义如格勒图,等.俄罗斯杂花苜蓿引种栽培试验初报[J].草原与草坪,2008(3):52-55.
[2] 贾淑杰,朝克图,义如格勒图,等.俄罗斯杂花苜蓿引种栽培试验[J].内蒙古草业,2009,21(4):48-51.
[3] 金淑梅,管清夫.苜蓿愈伤组织高频再生遗传和转化体系的建立[J].分子植物育种,2006,4(4):571-578.
[4] 王强龙,王锁民,张金林,等.紫花苜蓿体细胞胚高频再生体系的建立[J].草业科学,2006,23(11):21-27.
[5] 黄迎新,周道玮,岳秀泉,等.不同苜蓿品种再生特性的研究[J].草业学报,2007,16(6):14-22.
[6] 赵红娟,张博,陈爱萍,等.酶解对苜蓿子叶原生质体分离效果的影响[J].草地学报,2008,16(1):50-53.
[7] 马海燕,张博,郝兴明,等.苜蓿高效再生体系研究进展[J].草业科学,2005,22(11):63-67.
[8] 葛军,刘振虎,卢欣石.紫花苜蓿再生体系研究进展[J].中国草地,2004,26(2):77-79.
[9] 王海波,王永雄.细胞融合技术在苜蓿遗传改良中的应用研究[J].陕西农业科学,2006(4):30-35.
[10] 胡静,马晖玲,谢俊仁.甘农2号杂花苜蓿愈伤组织诱导及体细胞胚和芽分化的研究[J].甘肃农业大学学报,2007(4):87-91.
[11] 马伶俐,柳小妮,刘晓静,等.甘农4号紫花苜蓿组培再生体系的建立[J].草业科学,2008,25(12):67-70.
[12] 王娟,李玉珠,陶茸,等.陇东地区野生紫花苜蓿植株再生体系的建立[J].植物生理学通讯,2009(12):1177-1180.
[13] 蔡文燕,马晖玲,谢小冬,等.应用正交设计优化紫花苜蓿愈伤组织诱导的激素配比[J].草原与草坪,2008(5):40-47.
[14] 尚宏芹.正交设计优化彩色辣椒离体再生条件的研究[J].生物技术,2010,20(4):48-50.
[15] 薛春丽,郭俊明,周银丽,等.正交试验设计在扎米业愈伤组织诱导中的应用[J].安徽农业科学,2010,38(20):10573-10574.
[16] 李春喜.生物统计学[M].北京:科学出版社,2005.
[17] 王姝杰,闫淑珍,李世访.紫花苜蓿下胚轴愈伤组织诱导及再生植株的研究[J].植物保护,2005(3):50-52.
[18] 潘瑞炽.植物组织营养[M].广州:广东教育出版社,2001.
[19] Tian L,Brown D CW,Waltson E.Continuous long-term somatic embryogenesis in alfalfa[J].In Vitro Cellular & Developmental Biology,2002,38(3):279-283.
[20] 肖荷霞,王瑛,高峰,等.外植体及激素对紫花苜蓿愈伤组织诱导和分化的影响[J].河北农业大学学报,2003,26(4):47-52.
[21] 陶茸.扁蓿豆和清水野生紫花苜蓿原生质体分离与培养条件的筛选[D].兰州:甘肃农业大学,2011.
[22] Saunders J W,Bingham E T.Production of alfalfa plants from tissue culture[J].Crop Science,1972,12:804-808.
[23] 刘振虎,卢欣石,葛军.紫花苜蓿愈伤组织及体细胞胚的细胞学观察[J].草业科学,2005,22(2):42-47.

