植物体内自由基清除剂抗坏血酸研究进展
闫慧芳,夏方山,王明亚,毛培胜
(中国农业大学动物科技学院 草业科学北京市重点实验室 中国农业大学草地研究所,北京 100193)
抗坏血酸(Ascorbic Acid,AsA)又叫维生素C(Vitamin C,Vc),是植物体内的重要抗氧化剂之一,它具有水溶性,能够清除植物各项代谢过程中产生的自由基,减少膜脂过氧化作用对细胞造成的伤害[1]。AsA有L-型和D-型两种异构体[2],其中L-型异构体即维生素C,能够治疗坏血酸病,D-型异构体无治疗坏血酸病的作用,但两者均具有抗氧化功能。AsA广泛存在于高等动物、藓类和藻类等光合真核生物的细胞质、液泡、叶绿体、线粒体和细胞壁等结构内,其在叶绿体中的浓度可达到20 mmol·L-1。
AsA作为植物细胞内的一种己糖内酯类化合物,在植物细胞分裂与生长、细胞壁组成和光合作用等正常生长发育代谢活动以及抵御逆境胁迫的抗氧化保护等方面具有重要的功能,特别是其作为抗氧化剂对逆境胁迫下植物细胞老化的调节功能,成为近些年来研究的重点。研究表明,植物体中AsA的含量与抗逆性呈正相关,细胞中AsA含量增加可以增强植物耐盐耐旱耐热等能力[3]。 因此,对AsA在植物抵抗活性氧自由基伤害过程中的生理作用及其与植物抗逆性的关系进行研究具有重要的意义。
1 抗坏血酸的生物合成途径
70多年前,AsA在动物细胞中的合成途径就已经被研究清楚,但其在植物体中的合成途径却一直倍受争议,曾经有很多学者提出了AsA的碳链倒位途径(Inversion Pathway)、邻酮醛糖途径(Osone Pathway)、L-半乳糖途径(L-galactose Pathway或Smirnoff-Wheeler Pathway)和糖醛酸途径(Uronic acids Pathway)等学说[4]。目前能够被广泛认可的植物体内AsA的合成途径有4种,分别为糖醛酸途径、L-半乳糖途径、肌醇途径和L-古洛糖途径。 Davey等[5]用拟南芥(Arabidopsisthaliana)悬浮细胞做研究发现,半乳糖醛酸是植物体内AsA合成的底物,并由此认为植物中AsA的合成途径是糖醛酸途径。L-半乳糖途径也被称为Smirnoff-Wheeler途径,是由Wheeler等[6]在前人研究工作的基础上总结后提出的,他们认为该途径在AsA的合成中起着重要作用,这一合成途径在研究含有来自草莓(Fragariaananassa)果实的D-半乳糖醛酸还原酶基因的拟南芥试验中得到了证实[7]。肌醇途径是指肌醇在肌醇加氧酶的作用下生成葡萄糖醛酸,葡萄糖醛酸参与糖醛酸途径并促进植物AsA的合成[8]。在用拟南芥研究AsA代谢模式中发现,植物细胞中存在古洛糖酸,研究者认为植物中存在一个表异构酶,可以催化L-古洛糖醛酸-1,4-内酯与L-半乳糖醛酸-1,4-内酯的相互转化。研究发现[9],烟草(Nicotianatabacum)和生菜(Lactvcasativa)中的L-古洛糖醛酸-1,4-内酯氧化酶基因可以促进AsA含量的提高。由此可见,AsA通过多种合成途径共同维持植物自身的正常生长发育,并保证和增强植物对生态环境的适应性。
2 AsA的生理功能
AsA作为植物体内一种重要的自由基清除剂,在植物生长发育及代谢方面起着重要作用。前人众多研究证实了AsA可以参与植物细胞的分裂与伸长、作为辅酶参与细胞壁的形成、对光合系统有保护作用、作为电子传递和信号转导的载体,维持细胞氧化还原状态平衡等。特别是近些年来,有关其与植物抗逆境胁迫关系的研究受到很多学者的青睐,成为该领域研究的重点关注对象。
2.1参与细胞分裂与伸长 细胞中AsA含量的高低与该细胞的生长状态有关[10],一般认为,分裂活动旺盛的细胞中AsA的含量要高于非分裂状态的细胞。抗坏血酸氧化酶(Ascorbate Oxidase,AOX)主要存在于细胞壁中,其活性随着细胞分裂活跃程度的降低而升高。研究表明,AOX和编码该酶的mRNA的活性在细胞分裂时期较低,在细胞非分裂时期则较高[11]。可见,细胞中AsA与AOX的含量呈负相关,这一结果是因为AOX具有氧化性,可以氧化AsA,致使细胞AsA含量降低。
AsA是细胞分裂所必需的,它参与具有调节细胞周期进程功能的富羟脯氨酸糖蛋白(Hydroxyproline-rich Glycoproteins,HRGPs)的脯氨酸羟化作用。众多研究者发现,外源AsA可以促使处于分裂期的感受态细胞由G1期进入S期,使不活动中心细胞数量减少,并且当细胞中AsA含量不足时,蛋白质的脯氨酸羟化作用会受到抑制,进而使细胞分裂进程受阻[12]。黄文敏等[13]对外源AsA促进烟草细胞分裂的研究表明,2 mmol·L-1的AsA可以使烟草细胞分裂生长速率加快、可溶性蛋白含量增加、细胞膜透性降低、丙二醛(Malondialdehyde,MDA)含量降低、AsA和谷胱甘肽(Glutathiose,GSH)含量维持在较高水平,这说明AsA在促进细胞分裂和生长、减轻逆境胁迫下细胞膜所受的伤害和膜脂过氧化作用、延缓细胞衰老等方面起着重要的作用。
相关研究认为,AsA和AOX在细胞生长伸长过程中具有重要的调节作用[14]。AsA调节细胞伸长是通过酸生长理论[15]或ABA等植物激素介导[16]来刺激细胞伸长的。细胞生长过程中细胞壁在AOX的作用下产生MDA,MDA被结合在质膜上的细胞色素还原产生AsA,还原后的AsA再通过电子的跨膜运输被转运到质外空间。同时,AsA促进细胞伸长的作用还通过控制细胞壁蛋白和多糖的交联、木质素单体聚合作用调节胞壁木质化和Ca2+水平来完成。Kato和Esaka[11]报道,细胞伸长过程中,AsA、AOX活性及相关的mRNA含量均升高。
2.2作为辅酶参与细胞壁的形成 作为羟脯氨酸的辅酶,AsA参与了细胞壁结构的形成。细胞壁结构的骨架物质HRGPs,是细胞壁的重要组成成分,当细胞遭到病虫害或其它损伤时,细胞将会通过脯氨酸羟基化作用形成HRGPs[17]。AsA作为肽基-脯氨酰羟基化酶和肽基-赖氨酰羟基化酶的辅酶在脯氨酸和羟赖氨酸的合成中起到催化作用,进而参与HRGPs的合成。AsA还可以直接参与诱导HRGPs的合成[18]。另外,AsA是一些植物激素如赤霉素、花青素、乙烯等物质合成代谢中的辅酶[19]。因此,AsA对植物生长发育具有重要的生理作用。
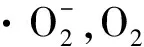
AsA参与细胞中ROS的清除既可以是直接的,也可以是间接的。AsA除了作为APx的辅酶清除光系统Ⅰ(PSI)氧气还原形成的H2O2外[21],还是光保护过程叶黄素循环(Xanthophyll Cycle)中紫黄质去环化酶(VDE)的辅酶,在环氧化过程中起到非常重要的作用[22]。其促使VDE作用下紫黄素脱环氧化生成环氧玉米黄素,环氧玉米黄素进一步脱环氧化生成玉米黄素,参与光系统Ⅱ的非光化学淬灭,将多余的光能转化为其它形式的能量散失[23]。如沙棘(Hippophaerhamnoides)等旱生植物果实中AsA含量极高,这是植物为适应干旱环境而进化的结果。外源AsA可以启动干旱胁迫下欧李(Cerasushumilis)叶片细胞的叶黄素循环,产生大量内源AsA,增加叶黄素循环中玉米黄素的含量,提高VDE的表达水平,进而提高植物的抗胁迫能力[24]。另外,液泡膜和质膜上含有AsA所依赖的细胞色素b561,在植物细胞光合作用过程电子传递中占有重要作用。因此,AsA在光合作用中起清除ROS和消除多余电子的作用。
但是,细胞中含有过量的AsA会加剧其自身氧化,其含量维持在一个安全浓度是保护细胞不受损伤的关键。研究表明,黄瓜(Cucumissativus)、甜瓜(C.melo)和萝卜(Raphanussativus)叶绿体中过量的维生素C加剧了电子的传递速率,使膜脂过氧化程度加深[25-26]。Packer等[27]认为,AsA能够加速氧化可能是因为细胞中存在着与AsA偶联的不协调氧化还原系统,这一偶联作用阻止了AsA对超氧阴离子等自由基的清除,或者是较高浓度的外源AsA激活了细胞内的脂氧化酶,促使膜脂中不饱和脂肪酸加速氧化。
2.4作为电子传递和信号转导的载体,维持细胞氧化还原状态平衡 逆境条件下,植物体内代谢过程中的电子传递链很容易遭到破坏,尤其是光合作用中的电子传递,而AsA和GSH在叶绿体water-water循环中能以协同作用清除光呼吸反应产生的ROS[28]。AsA被认为是调节细胞氧化还原状态中的重要信号物质,在光合系统、线粒体的电子传递及减轻逆境对植物伤害等过程中发挥重要功能[29]。
氧化还原过程中,AsA是光系统Ⅱ的电子供体,其氧化产物MDA可以作为光系统Ⅰ的电子受体参与电子的跨膜运输,清除自由基,从而达到恢复植物体内氧化还原势稳态平衡的效果[30]。研究表明,细胞中AsA的含量、氧化还原状态(AsA/DHA)及与其合成代谢相关的酶活性变化在植物抵抗逆境环境中发挥着不可替代的作用[31]。盐胁迫下,植物细胞中AsA含量降低,AsA/DHA比率降低,相关酶APx和MDHAR活性降低,从而导致植物抵抗逆境胁迫的能力下降[32-33]。而适宜浓度的外源AsA处理植物可以降低细胞内MDA和H2O2含量,提高APx、MDHAR、DHAR和GR等酶活性,增加AsA/DHA比率[34]。AsA氧化后的产物DHA能够形成胞壁草酸,草酸与细胞间隙中起信号转导调控作用的Ca2+结合形成结晶[35],通过控制细胞中Ca2+的含量来间接调控多种代谢和基因的表达[36]。同时,DHA信号传导途径在低温诱导烟草早花过程中有一定作用[37]。
研究还发现,植物细胞质外体中AsA的含量及氧化还原状态对植物抵抗逆境胁迫也起着不可忽视的作用[38]。质外体中的AsA作为一种氧化还原缓冲剂,是抵抗外界环境氧化胁迫的第一道防线,主要用于抵抗大气污染物等对植物细胞造成的伤害,从而保护细胞质膜的完整性。因此,细胞中含有较高浓度的AsA可以增强植物对逆境环境的抗性能力。
3 AsA参与植物逆境胁迫
植物处于正常生长条件下时,各项生理代谢过程产生的自由基维持在安全水平,不会对植物细胞造成任何伤害,但是当其遭受强光刺激、干旱、盐碱、极端温度、营养缺乏等其它胁迫环境条件时,细胞内多种电子传递链就会产生活性氧,如过氧化氢、超氧阴离子和羟自由基(Hydroxyl Radical,OH·)等。过量的ROS超过植物固有的抗氧化能力,便会对细胞造成氧化胁迫。植物体内ROS代谢水平取决于其产生和清除之间的动态平衡,当外界条件发生变化时,这种平衡可能会被打破。生物体内ROS的积累和膜脂过氧化是需氧生物遭受逆境伤害的重要特征。
植物为了适应不断变化的环境,体内进化出了复杂的抗氧化系统,如随着干旱胁迫程度的加深,苹果(Maluspumila)组织的AsA-GSH循环系统防御能力达到最大后开始下降[39-40]。AsA除了在维持植物正常生长和代谢方面起着重要作用外,还是该抗氧化系统中的一种重要抗氧化剂,在植物抵抗逆境胁迫、保护细胞免受逆境伤害方面也发挥着重要的生物学功能。
3.1AsA参与温度胁迫 高温条件下,植物细胞的膜结构是ROS攻击的主要目标,多数研究认为,自由基是通过膜脂过氧化作用对细胞膜造成伤害的,表现为膜通透性增大,电解质渗漏增多,抗氧化物质及相关酶活性变化等[41-45]。另外,高温还破坏了植物光合作用中的光系统Ⅱ(PSⅡ)和类囊体膜,阻断了电子传递的通路,抑制光合作用进行。
植物体内AsA主要通过叶黄素循环和抗坏血酸-谷胱甘肽循环(Ascorbate-G1utathlione,AsA-GSH Cycle)两大系统来清除逆境胁迫下植物细胞内产生的ROS,使细胞内氧化还原状态得以维持,保护细胞免遭侵害。研究表明[46],高温胁迫下,苹果细胞内AsA含量下降、GSH含量上升,而施用适宜浓度外源AsA后,细胞内AsA含量明显增加,GSH含量下降,抗氧化物酶活性下降受到抑制,丙二醛含量和膜透性增加得到缓解,这说明AsA主要通过AsA-GSH循环对细胞内AsA和GSH这两种物质产生不同影响,起到提高苹果组织热稳定性的作用。
外源施用AsA或AsA的合成前体L-半乳糖内酯后,水稻(Oryzasativa)根部和茎部细胞内的AsA含量显著提高,植株的抗寒能力得到增强[47]。最新研究从番茄(Lycopersiconesculentum)细胞中分离到的类囊体膜抗坏血酸过氧化物酶基因LetAPX如果在植株中表达沉默,则植株内APx的活性降低,H2O2的含量升高,因此,LetAPX基因的成功表达对叶绿体等细胞超微结构具有保护作用,可使其免受低温的破坏[48]。
3.2AsA参与盐胁迫 盐胁迫是植物在自然界中所受的典型胁迫之一,对植物细胞造成伤害主要因为离子平衡被破坏。盐胁迫对植物造成的伤害表现在光合作用过程中叶绿素和类胡萝卜素受损,气孔关闭,光合速率下降;细胞呼吸作用增强,能量消耗增多;细胞内蛋白质合成受阻,分解加速,导致蛋白质含量减少;代谢过程中有毒有害物质积累对细胞造成毒害作用等,严重的可使细胞代谢紊乱,甚至导致组织和细胞的死亡[49-50]。
AsA可以缓解盐胁迫对植物造成的损伤,如何文亮等[51]对盐胁迫下拟南芥野生型(wt)和抗坏血酸突变体(vtc-1)的研究发现,vtc-1中AsA总含量和GSH/GSSG比值下降,SOD、CAT活性降低,而wt中SOD、CAT、APX活性升高。外源AsA能够缓解盐胁迫对小麦(Triticumaestivum)幼苗生长的抑制作用,使幼苗根长、芽长得到提高,幼苗叶片可溶性蛋白含量升高,细胞膜透性及膜脂过氧化产物MDA含量显著降低[52]。它还可以增强盐胁迫下大麦(Hordeumvulgare)细胞液泡膜上H+-ATPase和H+-PPase的活性,从而降低膜脂过氧化作用对细胞造成的伤害[53]。这一结果与在水稻[54]和番茄[55]等中的研究结果相似。
同时,AsA参与了种子萌发过程中贮藏物质的转化,研究表明[56],外源AsA弥补了高盐条件下小麦种子中由于自身合成维生素能力受抑制而导致的含量不足,增强了小麦的抗盐能力。AsA参与了植物细胞内ROS代谢的清除,增强了逆境胁迫下植物的抗逆性。
3.3AsA参与微生物胁迫 植物在生长过程中会受到许多微生物的干扰与影响,某些微生物可对植物造成致命胁迫。Barth等[57]用两种不同的致病真菌侵染拟南芥抗AsA缺失突变体vtc1和vtc2来研究AsA缺失对生物胁迫的作用,结果表明,vtc1被感染后,细菌和菌丝的生长明显受到抑制;而vtc2被感染后,真菌的生长也受到抑制,这表明AsA缺失对病原有一定的抗性。
3.4AsA参与的其它过程 AsA作为抗氧化剂,对逆境条件下植物所受的自由基侵害有一定的缓解作用。外源AsA处理逆境胁迫下的植株幼苗,幼苗细胞内SOD和POD的活性升高,GSH和AsA的含量增加,MDA含量和膜透性增加的幅度减小,外源AsA能够缓解植株生长所受的抑制作用[58-59]。分离的沙打旺(Astragalusadsurgens)悬浮细胞液中不添加和添加AsA时,MDA含量比分离前分别增加1.8倍和0.8倍,AsA对膜质的过氧化具有抑制作用,能够降低脂质过氧化作用产物MDA的含量,延缓细胞衰老,起到稳定细胞膜结构、保护细胞的作用[60]。另外,研究报道[61-62],AsA还可以抑制多酚氧化酶(PPO)的活性,防止果品加工过程中由于PPO而导致的果实褐变,对果品加工保存起到至关重要的作用。相似的结果在黄瓜[63]和闽楠(Phoebebournei)[64]种子研究中也有发现。
适宜浓度的AsA浸泡老化小麦种子后,种子发芽率、发芽力明显增加,幼苗电解质渗漏降低,MDA含量明显减少,其中500 mg·L-1AsA处理效果最为显著[65],这说明AsA对老化后小麦种子脂质过氧化有缓解作用。AsA还能够使老化的辣椒(Capsicumannuum)等种子活力指数得到显著提高[66]。
另外,AsA还能起到保护DNA,缓解大分子受伤的作用,如马爱国和刘四朝[67]在用0.10和0.25 mmol·L-1AsA溶液培养Hela细胞41 h后,发现细胞抗氧化系统清除ROS的能力增强,细胞中DNA表现出较强的抗氧化损伤能力。
4 小结与展望
AsA作为植物细胞中存在的重要抗氧化物质,研究者对其在植物体内的合成途径虽然有了很深的研究,并形成了几种不同的AsA合成途径论,但是究竟哪一种才是正确途径还有待进一步研究。
AsA作为APx的辅酶,在植物抵抗逆境胁迫方面起着重要的抗氧化作用,有关其清除自由基的机理研究较多,主要集中在叶黄素循环和AsA-GSH循环上。同时,有关AsA在植物正常生长代谢过程包括细胞的分裂生长、细胞壁的伸长、参与光合作用和参与信号传导等方面的研究也较为深入。
然而,有关AsA对植物抗氧化功能影响方面的研究多数集中在其对作物和蔬菜幼苗逆境胁迫下酶系统变化的作用上,而在牧草作物特别是牧草种子方面的研究较少。最新研究发现,抗坏血酸过氧化物酶(APx)某个或某些基因的表达与AsA在植物抵抗逆境胁迫中的作用有关,若牧草或作物种子中也能够找到某个基因来调控或缓解种子自然老化或劣变的过程,这将对种子贮藏、保存活力和延长寿命有很大的意义。因此,有关AsA在其他作物,包括饲料作物及牧草中的应用以及种子劣变过程中的生理机制还有待于进一步深入研究和探讨。
[1] 沈文飚,徐朗莱,叶茂炳.外源抗坏血酸和过氧化氢对小麦离体叶片衰老的调节[J].植物生理学通讯,1997,33(5):338-340.
[2] 李胜元,谷向春.抗坏血酸对玫瑰香干白葡萄酒的抗氧化作用[J].酿酒科技,2006(6):65-66.
[3] 邹礼平,陈锦华.植物抗坏血酸的合成和代谢以及相关酶基因的调控[J].植物生理学通讯,2009,45(9):925.
[4] Smirnoff N,Wheeler G L.Ascorbic acid in plants:Biosynthesis and function[J].Critical Reviews in Biochemistry and Molecular Biology,2000,35(4):291-314.
[5] Davey M W,Gilot C,Persiau G,etal.Ascorbate biosynthesis inArabidopsiscell suspension culture[J].Plant Physiology,1999,121(2):535-543.
[6] Wheeler G L,Jones M A,Smirnoff N.The biosynthetic pathway of vitamin C in higher plants[J].Nature,1998,393:365-369.
[7] Agius F,Gonzalez-Lamothe R,Caballero J L,etal.Engineering increased vitamin C levels in plants by over-expression of a D-galacturonic acid reductase[J].Nature Biotechnology,2003,21(2):177-181.
[8] Lorence A,Chevone B I,Mendes P,etal.Myo-Inositol oxygenase offers a possible entry point into plant vitamin C biosynthesis[J].Plant Physiology,2004,134(3):1200-1205.
[9] Jain A K,Nessler C L.Metabolic engineering of an alternative pathway for ascorbic acid biosynthesis in plants[J].Molecular Breeding,2000,6(1):73-78.
[10] Smirnoff N.The function and metabolism of ascorbic acid in plant[J].Annals of Botany,1996,78:661-669.
[11] Kato N,Esaka M.Changes in ascorbate oxidase gene expression and ascorbate levels in cell division and cell elongation in tobacco cells[J].Physiologia Plantarum,1999,105(2):321-329.
[12] De Tullio M C,Paciolla C,Vecchia F D,etal.Changes in onion root development induced by the inhibition of peptidyl-prolyl hydroxylase and influence of the ascorbate system on cell division and elongation[J].Planta,1999,209(4):424-434.
[13] 黄文敏,邢伟,李敦海,等.外源抗坏血酸对烟草细胞生长及衰老的影响[J].农业环境科学学报,2006,25(5):1157-1161.
[14] Barth C,De Tullio M,Conklin P L.The role of ascorbic acid in the control of flowering time and the onset of senescence[J].Journal of Experimental Botany,2006,57(8):1657-1665.
[15] Rayle D L,Cleland R E.The acid growth theory of auxin-induced cell elongation is alive and well[J].Plant Physiology,1992,99(4):1271-1274.
[16] Pastori G M,Kiddle G,Antoniw J,etal.Leaf vitamin C contents modulate plant defense transcripts and regulate genes that control development through hormone signaling[J].Plant Cell,2003,15(4):939-951.
[17] Sommer-Knudsen J,Bacic A,Clarke A E.Hydroxyproline-rich plant glycoproteins[J].Phytochemistry,1998,47(4):483-497.
[18] Garcia-Muniz N,Martinez-Izquierdo J A,Puigdomenech P.Induction of mRNA accumulation corresponding to a gene encoding a cell wall hydroxyproline-rich glycoprotein by fungal elicitors[J].Plant Molecular Biology,1998,38(4):623-632.
[19] Ioannidi E,Kalamaki M S,Engineer C,etal.Expression profiling of ascorbic acid-related genes during tomato fruit development and ripening and in response to stress conditions[J].Journal of Experimental Botany,2009,60(2):663-678.
[20] Asada K.The water-water cycle in chloroplast:Scavenging of active oxygen and dissipation of excess photons[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:601-639.
[21] Foyer C H,Halliwell B.The presence of glutathione and glutathione reductase in chloroplast:A proposed role in ascorbic acid metabolism[J].Planta,1976,133:21-25.
[22] Muller-Moule P,Conklin P L,Niyogi K K.Ascorbate deficiency can limit violaxanthin de-epoxidase activity in vivo[J].Plant Physiology,2002,128(3):970-977.
[23] 王慧,毕玉蓉.干旱胁迫对大豆叶片叶黄素循环的影响[J].中央民族大学学报,2011,20(1):20-26.
[24] 商志伟,尹赜鹏,孙孟超,等.叶黄素循环的启动:外源AsA对欧李幼苗干旱胁迫的缓解[J].经济林研究,2012,30(1):28-32.
[25] 张洪涛,安旺盛,曾福礼.维生素C对黄瓜叶绿体膜脂过氧化的影响[J].西北植物学报,1999,19(2):321-324.
[26] 朱世东.自由基清除剂处理蔬菜衰老种子的生理效应[J].安徽农业大学学报,2001,28(4):390-394.
[27] Packer J E,Slater T F,Wilson R L.Direct observation of a free radical interaction between vitamin E and vitamin C[J].Nature,1979,278:737-738.
[28] Noctor G,Veljovic-Jovanovic S,Foryer C H.Peroxide processing in photosynthesis:Antioxidant coupling and redox signaling[J].Philosophical Transactions of the Royal Society of London.Series B.Biological sciences,2000,355(1042):1465-1475.
[29] McCarrell E M,Gould S W,Fielder M D,etal.Antimicrobial activities of pomegranate rind extracts:Enhancement by addition of metal salts and vitamin C[J].BMC Complementary & Alternative Medicine,2008,8:64.
[30] 刘拥海,俞乐,王若仲,等.抗坏血酸对植物生长发育的作用及其缺失突变体的研究进展[J].植物生理学报,2011,47(9):847-854.
[31] 单长卷.干旱胁迫下冰草AsA、GSH代谢及茉莉酸的信号调控作用[D].杨凌:西北农林科技大学,2010.
[32] Sairam R K,Srivastava G C.Changes in antioxidant activity in sub-cellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress[J].Plant Science,2002,162(6):897-904.
[33] Shalata A,Mittova V,Volokita M,etal.Response of the cultivated tomato and its wild salt-tolerant relativeLycopersiconpennelliito salt-dependent oxidative stress:The root antioxidative system[J].Physiologia Plantarum,2001,112(4):487-494.
[34] 马春花,张敏,李明军,等.外源AsA对苹果果实采后衰老及AsA-GSH循环的影响[J].云南农业大学学报,2012,27(3):384-390.
[35] Mahajan S,Pandey G K,Tuteja N.Calcium- and salt-stress signaling in plants:Shedding light on SOS pathway[J].Archives of Biochemistry Biophysics,2008,471(2):146-158.
[36] 郭新波,唐岳立,孙小芬,等.高等植物维生素C和维生素E代谢调控[J].植物生理学报,2011,47(8):731-744.
[37] 范邓鹏.脱氢抗坏血酸在低温诱导烟草早花过程中的作用及其信号途径分析[D].郑州:河南农业大学,2010.
[38] Burkey K O,Eason G,Fiscus E L.Factors that affect leaf extracellular ascorbic acid content and redox status[J].Physiologia Plantarum,2003,117(1):51-57.
[39] 马玉华,马锋旺,马小卫,等.干旱胁迫对苹果叶片抗坏血酸含量及其代谢相关酶活性的影响[J].西北农林科技大学学报,2008,36(3):150-155.
[40] 马春花.干旱胁迫和衰老过程中苹果抗坏血酸代谢的研究[D].杨凌:西北农林科技大学,2007.
[41] 钱鑫萍,杨雪飞,潘利华,等.热激和储藏温度对果蔬中抗坏血酸含量与相关酶活性的影响[J].安徽农业科学,2011,39(22):13513-13515.
[42] 赵云霞,于贤昌,李超汉,等.高低温胁迫对番茄叶片抗坏血酸代谢系统的影响[J].山东农业科学,2010(4):22-26.
[43] 马玉华,王永红,王荔,等.高温胁迫对苹果叶片膜脂过氧化及抗坏血酸的影响[J].贵州农业科学,2010,38(8):176-178.
[44] 田婧,郭世荣.黄瓜的高温胁迫伤害及其耐热性研究进展[J].中国蔬菜,2012(18):43-52.
[45] 马德华,孙其信.温度逆境对不同品种黄瓜幼苗膜保护系统的影响[J].西北植物学报,2001,21(4):656-661.
[46] 庞勇,马锋旺,徐凌飞.抗坏血酸对苹果组培苗耐热性的生理效应[J].果树学报,2005,22(2):160-162.
[47] Guo Z,Tan H,Zhu Z,etal.Effect of intermediates on ascorbic acid and oxalate biosynthesis of rice and in relation to its stress resistance[J].Plant Physiology and Biochemistry,2005,43(10-11):955-962.
[48] 段明.低温胁迫下番茄类囊体膜抗坏血酸过氧化物酶基因的表达和功能研究[D].泰安:山东农业大学,2012.
[49] 刘建新,王金成,王瑞娟,等.燕麦幼苗活性氧代谢和渗透调节物质积累对NaCl胁迫的响应[J].生态学杂志,2012,31(9):2255-2260.
[50] 韩志平,郭世荣,尤秀娜,等.盐胁迫对西瓜幼苗活性氧代谢和渗透调节物质含量的影响[J].西北植物学报,2010,30(11):2210-2218.
[51] 何文亮,黄承红,杨颖丽,等.盐胁迫过程中抗坏血酸对植物的保护功能[J].西北植物学报,2004,24(12):2196-2201.
[52] 常云霞,徐克东,周琳,等.抗坏血酸对盐胁迫下小麦幼苗生长抑制的缓解效应[J].麦类作物学报,2013,33(1):151-155.
[53] Chen Q,Zhang W,Liu Y L.Effect of NaCl glutathione and ascorbic acid on function of tonoplast vesicles isolated form barley leaves[J].Journal of Plant Physiology,1999,155(12):685-690.
[54] 华春,王仁雷,刘友良.外源AsA对盐胁迫下水稻叶绿体活性氧清除系统的影响[J].作物学报,2004,30(7):692-696.
[55] Shalata A,Meumann P M.Exogenous ascorbic acid (vitamin C) increases resistance to salt stress and reduces lipid peroxidation[J].Journal of Experimental Botany,2001,52:2207-2211.
[56] 唐瑞,吴瑜.维生素浸种对盐胁迫下小麦发芽及幼苗生长的影响[J].种子,2007,26(5):44-47.
[57] Barth C,Moeder W,Klessig D F,etal.The timing of senescence and response to pathogens is altered in the ascorbate-deficientArabidopsismutant vitamin c-1[J].Plant Physiology,2004,134(4):1784-1792.
[58] 谭新中,曹赐生,肖用森.维生素C对渗透胁迫下杂交稻幼苗膜脂过氧化作用的影响[J].杂交水稻,2003,18(3):59-61.
[59] 张跃群,陆德祥,闫生荣,等.外源抗坏血酸对小麦萌发过程中镉胁迫效应的影响[J].安徽农业科学,2009,37(34):17274-17276.
[60] 耶兴元,何晖,仝胜利.抗坏血酸与植物抗氧化性的关系[J].信阳农业高等专科学校学报,2009,19(1):123-124.
[61] 李粉玲,蔡汉权,江海涛,等.番石榴果肉的酶促褐变及其抑制措施[J].食品工业科技,2008,29(2):149-151.
[62] 张兰,郑永华,苏新国,等.抗坏血酸处理对蚕豆保鲜的效果[J].南京农业大学学报,2006,35(3):83-87.
[63] 何丽烂,区炳庆,王艳.抗坏血酸和亚硒酸钠浸种对黄瓜幼苗抗氧化功能的影响[J].河北农业科学,2004(6):56-58.
[64] 李铁华,文仕知,彭险峰,等.维生素溶液对闽楠种子活力的影响[J].中南林业科技大学学报,2010,30(10):51-54.
[65] 李珍珍,韩阳.抗坏血酸对小麦种子老化及幼苗脂质过氧化的影响[J].辽宁大学学报自然科学版,2000,27(2):170-172.
[66] 李雪峰,邹学校,刘志敏,等.提高老化辣椒种子活力的研究[J].辣椒杂志,2005(1):36-39.
[67] 马爱国,刘四朝.不同剂量维生素C对DNA氧化损伤影响的研究[J].营养学报,2001,23(1):13.

