肾移植后复发的单克隆IgG沉积肾小球肾炎
病例摘要
现病史41岁男性,因“肾移植术后2年余,尿检异常1年余”于2012-10-09入院。
2010-09-17因慢性肾功能不全于外院行同种异体尸体肾移植术,手术顺利,术后以吗替麦考酚酯(MMF)+环孢素A(CsA)+泼尼松联合免疫抑制治疗。术后5d血清肌酐(SCr)降至正常。此后定期随访,CsA浓度维持在150 ng/ml左右, SCr正常,尿检阴性。2011年10月复查尿蛋白阳性,隐血不详。当地医院予甲泼尼龙冲击治疗(500 mg/d,×3d),并将CsA切换为他克莫司(FK506)(1 mg,2次/d,血药浓度不详)。切换后移植肾功能稳定,但尿蛋白仍持续阳性。2012年4月复查尿蛋白定量 2.55 g/24h,尿沉渣红细胞计数(RBC) 280万/ml(多形型),SCr 68.07 μmol/L,BUN 6.21 mmol/L,血清白蛋白(Alb) 34.5 g/L,总胆固醇(TC) 6.94 mmol/L,三酰甘油 (TG) 1.4 mmol/L,血红蛋白(Hb)136 g/L。病程中无皮疹、关节疼痛,精神饮食良好,体重无明显变化。
追溯病史,患者2007年9月体检时发现血压130/100 mmHg,尿蛋白3+,尿RBC 5~10个/HP。2008年5月出现高度水肿,Alb 26.5 g/L,TC 10.52 mmol/L,TG 1.96 mmol/L,肾功能正常,诊断为肾病综合征,予泼尼松(60 mg/d)、氯沙坦、阿托伐他汀钙等治疗,但效果不佳。同年8月尿蛋白定量达7.37 g/24h,行自体肾肾活检,组织学改变符合肾小球弥漫内皮系膜增生性病变,予泼尼松+雷公藤多苷(60 mg/d)治疗,尿蛋白定量最低降至1.53 g/24h。然而,2009年2月复查发现SCr升至134.37 μmol/L,尿蛋白定量6.04 g/24h,此后患者未规律随访。期间外院曾予MMF+FK506联合治疗,2009年8月发生重症肺部感染,予抗感染、Bipa呼吸机辅助呼吸及CRRT等治疗,肺部感染控制,但尿蛋白定量达5.02 g/24h,SCr 196.25 μmol/L,BUN 27.24 mmol/L。由于患者病情进展迅速,肾功能逐渐减退,2009-08-29再次行自体肾肾活检,同时对本次和首次自体肾肾活检病理切片行IgG亚型及重复肾组织轻链染色,证实两次肾活检病理诊断均符合单克隆IgG沉积的肾小球肾炎(IgG3κ型)。发病后2年即2009年9月开始行腹膜透析(PD)治疗。
既往史:无特殊,否认肝炎、肺结核、疟疾、菌痢等传染病史。
个人史、家族史无特殊。
体格检查体温37.3 ℃,血压140/90 mmHg,体质量指数23.3 kg/m2。鼻腔及口腔黏膜破溃,左锁骨上窝皮肤一处破溃、少许脓性分泌物。心肺检查无异常。双下肢重度水肿。
实验室检查
尿液 蛋白定量4.05 g/24h,RBC 330万/ml(多形型),N-乙酰-β-D-氨基葡萄糖苷酶43.9 U/(g·cr),视黄醇结合蛋白0.6 mg/L。
血常规 Hb 108 g/L,白细胞计数6.8×109/L,中性粒细胞/淋巴细胞81/15,血小板284×109/L。
血生化 Alb 25.6 g/L,球蛋白12.1 g/L,SCr 84 μmol/L,BUN 10.71 mmol/L,TC 8.7 mmol/L,TG 2.57 mmol/L,血糖8.06 mmol/L。
免疫学检查 补体C3、C4正常。C3肾炎因子、抗补体H因子抗体、ANA、ds-DNA、AECA、ANCA均阴性。血栓调节蛋白、血尿κ、λ链及循环内皮细胞均正常。
血药浓度 FK506药物浓度5.96 ng/ml,MMF 22.25 mg·h/L;肾素活性(PRA) Ⅰ类4.5%,Ⅱ类6.9%(2012-04-20),术前PRA正常水平;
移植肾B超 移植肾:130 mm×66 mm×66 mm,肾窦回声未见分离,皮质回声增强。肾内各级血管树显示清晰,血流色彩充填丰富。移植肾各级动脉阻力指数偏高。
其他 心电图、胸片未见异常。骨髓活检未见异常。
肾活检
第一次肾活检(2008-08-24)
光镜 8个肾小球中1个球性废弃,2个节段废弃的肾小球残存袢见透明滴。余正切肾小球体积增大;毛细血管袢开放尚好,弥漫系膜及内皮细胞增生,袢腔内中性粒细胞及单个核细胞浸润(>5个/球),囊壁增厚、节段分层。PASM-Masson:肾小球系膜区较多、内皮下大量、偶见上皮侧嗜复红物沉积(图1A),节段外周袢分层。肾小管间质慢性病变轻~中度。多灶性肾小管萎缩、基膜增厚,未萎缩小管代偿性肥大,管腔扩张,腔内蛋白及红细胞管型;肾小管上皮细胞空泡变性,基膜增厚。肾间质单个核细胞浸润,多处小灶性泡沫细胞。小动脉弹力层分层,内膜增厚,节段透明变性。
免疫荧光 IgG++(图1B)、C3++、C4+、C1q+,呈颗粒状弥漫沿肾小球毛细血管袢分布。IgA及IgM阴性。肾小管基膜、球门区血管、管间毛细血管和间质血管均未见免疫球蛋白和补体沉积。
电镜 观察2个病变重的肾小球。肾小球系膜区增宽,基膜样物质增多,见中等电子密度的致密物。肾小球内皮细胞肿胀、成对,袢腔内见浆细胞及红细胞,节段袢腔内可见含脂质空泡的栓子。肾小球毛细血管袢基膜内皮下、膜上及膜内中等电子密度的致密物,有的溶解,形成透亮区(图1E),基膜厚薄不一,电子致密物沉积处基膜厚约1142~2944 nm,最厚处达3030 nm,未见电子致密物沉积处基膜约358~394 nm。肾小球足细胞足突广泛融合(>80%),大量微绒毛化,胞质内可见溶酶体。
小结:肾小球弥漫内皮系膜增生性病变,电子致密物分布广泛。
第二次肾活检(2009-08-26)
光镜 21个肾小球中5个球性废弃,1个细胞纤维性、4个纤维细胞性新月体。余正切肾小球体积明显增大,系膜区重度增宽,系膜细胞及基质增多(图1F),致肾小球呈分叶状,见系膜溶解;毛细血管袢开放欠好,节段内皮细胞增生,见单个核及中性粒细胞浸润(5~10个/球),壁层上皮细胞增生,囊壁增厚分层。PASM-Masson:肾小球系膜区、毛细血管袢内皮下嗜复红物沉积,节段外周袢分层。肾小管间质慢性病变中度,灶性肾小管萎缩、基膜增厚,未萎缩小管代偿性肥大,见小灶性小管上皮细胞刷状缘脱落及细小空泡变性,偶见小管炎,管腔内见少量蛋白管型,偶见管腔中嗜碱性物质。肾间质纤维化+~++,散在单个核及浆细胞浸润,泡沫细胞散在分布。小动脉节段透明变性。
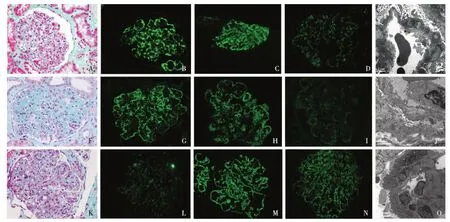
图1 自体肾及移植肾活检病理
免疫荧光 IgG++(图1G)、IgM+、C3++、C4+、C1q++,呈颗粒状弥漫分布于系膜区及外周袢。IgA阴性。肾小管基膜、球门区血管、管间毛细血管和间质血管均未见免疫球蛋白和补体沉积。IgG亚型染色:IgG3++,呈颗粒状沉积于血管袢(图1H),IgG1、IgG2、IgG4阴性;肾组织链染色κ轻链+,呈颗粒状沉积于血管袢(图1I)、λ轻链阴性。HBsAg、HBcAg、HBeAg染色均阴性。
电镜 肾小球系膜区重度增宽,基膜样物质增多,可见中等电子密度的致密物,增宽的系膜区与扭曲、塌陷的外周袢连接成片,形成塌陷区,肾小球毛细血管袢基膜厚820~2238 nm,节段基膜溶解,内皮下区域中见细胞碎屑、红细胞及密度不一的致密物,节段内皮下亦见电子致密物沉积(图1J)。尚开放的肾小球毛细血管袢腔内见富胞质的内皮细胞,胞质内见变形的线粒体。肾小球足细胞广泛足突融合,大量微绒毛化,胞质内见扩张的内质网。
对首次自体肾肾活检行免疫荧光IgG亚型及重复轻链染色
免疫荧光 IgG亚型染色见IgG3++,呈颗粒状沉积于血管袢(图1C),IgG1、IgG2、IgG4阴性。肾组织链染色κ轻链++,呈颗粒状沉积于血管袢(图1D),λ轻链阴性。
小结:结合临床及两次自体肾活检病理诊断为单克隆IgG沉积肾小球肾炎(IgG3κ型)。
移植肾活检(2012-4-17):
光镜 6个肾小球中1个细胞性新月体,正切球体积增大,呈分叶状,肾小球系膜区中~重度增宽,毛细血管袢开放尚好,节段内皮细胞成对,单个核细胞浸润(10~25个/球),偶见浸润的中性粒细胞,节段袢与囊壁粘连,囊壁节段增厚。PASM-Masson:肾小球系膜区、内皮下、上皮侧少量嗜复红物沉积(图1K),节段外周袢分层。肾间质小灶性单个核细胞聚集,少量中性粒细胞。髓质区间质增宽纤维化++~+++。小叶间动脉内膜增厚、分层,偶见静脉炎。
免疫荧光 IgG+(图1L)、C3++、C1q+,呈颗粒状弥漫分布于血管袢。IgA、IgM阴性。肾小管基膜、球门区血管、管间毛细血管和间质血管均未见免疫球蛋白及补体沉积。C4d染色阴性。IgG亚型染色IgG3++,呈颗粒状沉积于血管袢(图1M),IgG1、IgG2、IgG4阴性。肾组织链染色κ轻链++,呈颗粒状弥漫分布于血管袢(图1N),λ轻链阴性。
电镜 肾小球系膜区增宽,系膜细胞及基膜样物质均增多,节段系膜区与扭曲、塌陷的外周袢连接形成塌陷区。肾小球系膜区、毛细血管袢基膜膜上、膜内及内皮下均见中等电子密度的致密物,但致密物大小、分布不规则。节段肾小球毛细血管袢开放差,被增生的内皮细胞堵塞,节段袢开放尚好,节段系膜基质插入至内皮下并见新形成的基膜(图1O);肾小球基膜厚薄不一,约445~640 nm,节段增厚处达>1964 nm。肾小球足细胞足突广泛融合,少量微绒毛化。肾间质区域大量浸润细胞,间质血管见浸润的中性粒细胞。
诊疗分析中年男性患者,起病隐匿,但病情进展迅速,主要临床特点:(1)肾病综合征起病,超大量蛋白尿;(2)肾功能进行性恶化,起病至开始腹膜透析时间短,仅2年;(3)肾移植后1年再次出现蛋白尿。
患者在我院接受首次自体肾肾活检时组织学以肾小球内皮系膜增生性病变为主,但系膜插入不明显,仅见节段肾小球外周袢分层,免疫荧光染色IgG、C3、C4、C1q阳性,当时尚未建立IgG亚型检查、电镜检查肾小球毛细血管袢基膜内皮下膜上及膜内见电子致密物沉积,虽高度疑及继发性肾脏病变,但终未明确诊断。由于患者病情进展迅速,首次自体肾肾活检1年后再次行自体肾活检,组织学改变符合肾小球膜增生样病变,免疫荧光染色IgG、C3、C4、C1q阳性,行IgG亚型及轻链染色见IgG3及κ轻链呈颗粒状沿肾小球毛细血管袢沉积(λ轻链阴性),电镜观察与前次变化不大。此时对患者首次自体肾肾活检组织行IgG亚型并重复轻链染色,结果与第2次自体肾肾活检的结果一致。因此明确该患者诊断:增生性肾小球肾炎伴单克隆IgG沉积病(PGNMID)。患者虽行肾移植术,但术后仅1年蛋白尿再现;行移植肾活检证实患者移植后肾脏病变符合肾移植后复发的PGNMID。
治疗及转归患者入院后加强免疫抑制治疗,加雷公藤多苷片及环磷酰胺,但效果不佳,蛋白尿不缓解,后予双重血浆滤过治疗,补充血浆及给予免疫球蛋白治疗,尿蛋白降至1.33 g/24h后予患者出院。
最后诊断肾移植后复发的PGNMID。
讨 论
肾移植为治疗终末期肾病(ESRD)的主要手段之一。然而,引起ESRD的各种肾小球肾炎在移植后几乎均有复发可能。据统计肾移植术后10年内约有10%~20%的患者出现原发病复发,其中近50%的患者因此丢失移植肾[1]。
原发病在肾移植术后复发的概率不同,复发后对移植肾存活的影响也有差异。肾移植术后原发病复发的诊断需要患者有完整的术前、术后资料,除临床资料外,肾活检病理尤其重要;此外,供肾资料也应包括肾脏病理检查,以澄清移植肾是复发性疾病、新生的疾病,还是携入的病变,如无这些资料则难以明确肾移植后重新出现的疾病属于哪类。
不同中心报道的肾移植后原发病复发率不一。其中肾移植术后IgA肾病复发最为常见,约20%~60%[2],文献报道不同免疫抑制方案中IgA肾病的复发也不同,以霉酚酸酯为基础的免疫抑制方案中IgA肾病复发率较以硫唑嘌啉为基础的免疫抑制方案人群低[3];致密物沉积病(DDD)的复发率几乎为100%,且复发的DDD尚无有效的干预措施[4]。局灶节段性肾小球硬化在肾移植术后复发率为20%~30%[1],首次移植即出现复发者极易引起移植肾丢失,再次移植后的复发率仍高达80%[5]。有些移植中心已经将术后复发风险极高且对移植肾存活有重大影响的原发病作为接受肾移植手术的禁忌。一些近年来才被认识的疾病,术后复发的风险及对移植肾存活的影响尚不清楚,PGNMID就是其中之一。
PGNMID作为一类较罕见的疾病直到近年才被人们所认识。2004年Nasr等[6]首次报道了一组患者,自体肾肾活检光镜下肾小球增生性病变突出,免疫荧光为单一IgG亚型及单一轻链沉积,电镜观察电子致密物呈颗粒状在系膜区和(或)毛细血管袢基膜内皮下沉积。其中IgG亚型以IgG3最为常见,而轻链则以κ链最多。此后,有关PGNMID的研究也陆续发表,但仅限于小样本的临床观察,最多的一组患者也仅37例[7]。PGNMID患者约50%出现肾病范围蛋白尿,血尿发生率高达77%,2/3的患者在诊断PGNMID时已出现肾功能不全。该类患者的预后较,约1/4的患者在诊断后3年内进入ESRD[7]。PGNMID的诊断主要依据免疫荧光染色。
该患者以超大量的蛋白尿及血尿起病,尿蛋白定量最高达7.37g/24h,且病情进展迅速,仅24月即进展至ESRD。患者2008年8月第一次来我院就诊肾活检组织学特点符合肾小球弥漫内皮系膜增生性病变,提示继发性肾脏病可能,最终经肾组织免疫荧光IgG亚型和轻链染色证实诊断单克隆IgG沉积肾小球肾炎(IgG3κ型)。
光镜表现为膜增生性肾小球肾炎的疾病种类很多,对于此类疾病的应予以进行相应的鉴别,鉴别诊断离不开免疫荧光及电镜检查(表1)。
目前,PGNMID患者接受肾移植后患者重新出现肾病复发的报道共7例[8-10]。Nasr等[8]报道一组4例患者在接受肾移植后疾病复发,平均复发的时间为3.8月。复发后3例患者接受激素冲击联合利妥昔单抗治疗,1例患者口服CTX治疗。4例患者治疗后蛋白尿均缓解,利妥昔单抗治疗的3例患者中,2例移植肾功能恢复至发病前的基线水平。另2例则在治疗后移植肾功能未恢复且较基线水平上升。文献也报道对PGNMID复发的患者予血浆置换治疗,但最后效果不佳(表2)。由于PGNMID相对少见,尚无对其治疗令人满意的措施,仍需进一步观察证实利妥昔单抗的疗效。但应切记使用该药后存在增加感染的风险。
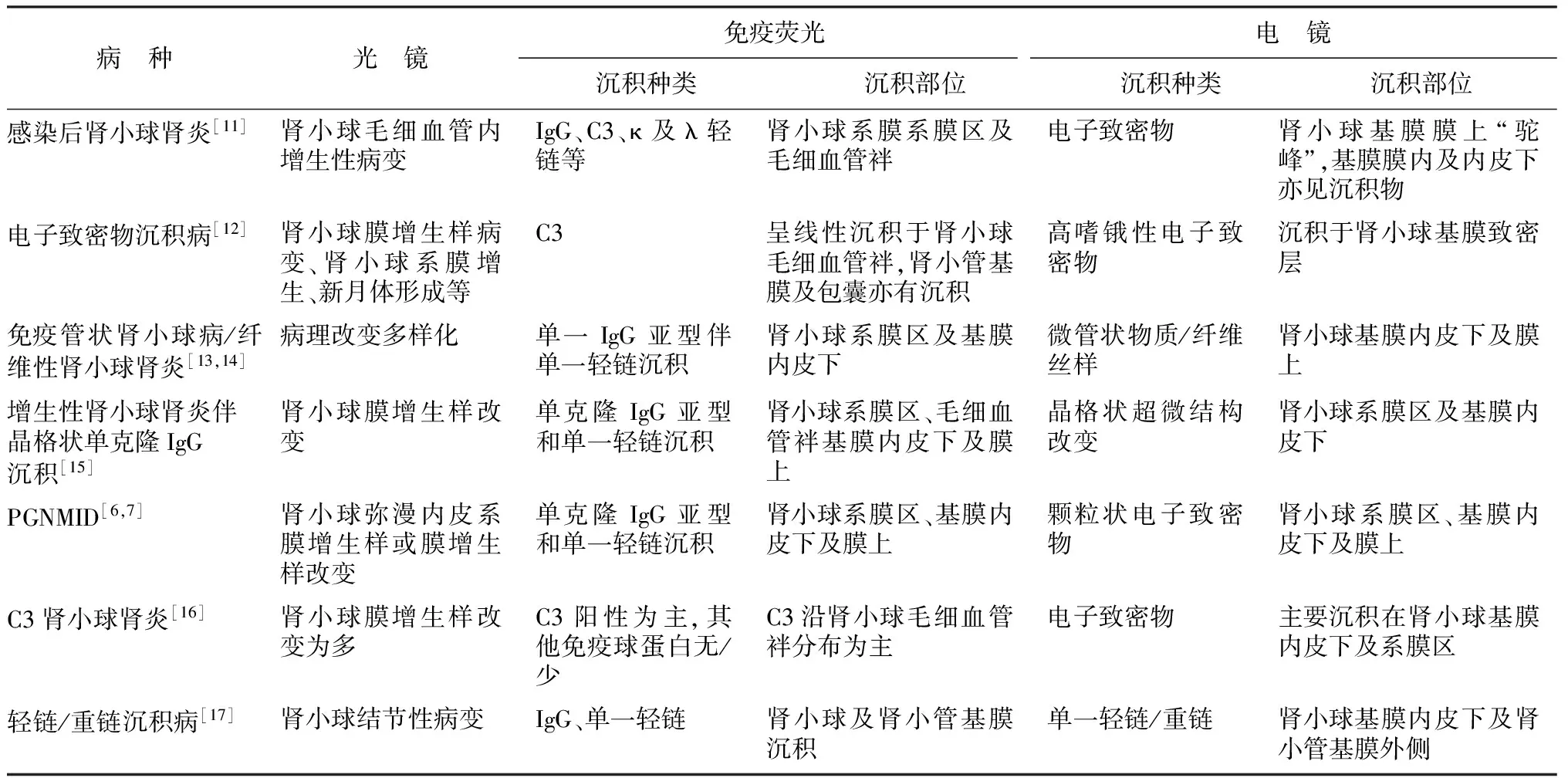
表1 增生性肾小球肾炎伴单克隆IgG沉积病(PGNMID)鉴别要点

表2 移植后PGNMID复发患者情况
小结:PGNMID的诊断思路应注意(1)若肾小球组织学特点符合弥漫内皮系膜增生性病变或膜增生样改变,应注意分析免疫荧光检查特点;(2)肾小球仅见单一免疫球蛋白IgG沉积,需进一步分析IgG亚型;(3)此类患者需行肾组织轻链染色;(4)电镜观察电子致密物沉积广泛,高度提示继发性肾脏病,且应结合临床表现及实验室检查结果明确诊断。
如同所有肾脏疾病一样,PGNMID的患者在接受肾移植后复发风险很大,且平均复发时间短。
(程东瑞 陈惠萍 刘志红 整理)
1 Golgert WA,Appel GB,Hariharan S.Recurrent Glomerulonephritis after Renal Transplantation:an unsolved problem.Clin J Am Soc Nephrol,2008,3(3):800-807.
2 Briganti EM,Russ GR,McNeil JJ,et al.Risk of renal allograft loss from recurrent glomerulonephritis.N Engl J Med,2002,347(2):103-109.
3 Chandrakantan A,Ratanapanichkich P,Said M,et al.Recurrent IgA nephropathy after renal transplantation despite immunosuppressive regimens with mycophenolate mofetil.Nephrol Dial Transplant,2005,20(6):1214-1221.
4 文吉秋,陈惠萍.肾移植术后常见的复发性肾小球疾病(一).肾脏病透析与肾移植,2012,21(4):384-389.
5 Artero M,Biava C,Amend W,et al.Recurrent focal glomerulosclerosis:Natural history and response to therapy.Am J Med,1992,92(4):375-383.
6 Nasr SH,Markowitz GS,Stokes BS,et al.Proliferative glomerulonephritis with monoclonal IgG deposits:A distinct entity mimicking immune-complex glomerulonephritis.Kidney Int,2004,65(1):85-96.
7 Nasr SH,Satoskar A,Markowitz GS,et al.Proliferative Glomerulonephritis with Monoclonal IgG Deposits.J Am Soc Nephrol,2009,20(9):2055-2064.
8 Nasr SH,Sethi S,Comell LD,et al.Proliferative glomerulonephritis with monoclonal igg deposits recurs in the allograft.Clin J Am Soc Nephrol,2011,6(1):122-132.
9 Albawardi A,Satoskar A,Von Visger J,et al.Proliferative glomerulonephritis with monoclonal igg deposits recurs or may develop de novo in kidney allografts.Am J Kidney Dis,2011,58(2):276-281.
10 Ranghino A,Tamagnone M,Messina M,et al.A Case of Recurrent Proliferative Glomerulonephritis with Monoclonal IgG Deposits after Kidney Transplant Treated with Plasmapheresis.Case Rep Nephrol Urol,2012,2(1):46-52.
11 Sotsiou F.Postinfectious glomerulonephritis. Nephrol Dial Transplant,2001,16( Suppl 6) :68-70.
12 Walker PD,Ferrario F,Joh K,et al.Dense deposit disease is not a membranoproliferative glomerulonephritis.Mod Pathol,2007,20(6):605-616.
13 Ivanyi B,Degrell P.Fibrillary glomerulonephritis and immunotactoid glomerulopathy. Nephrol Dial Transplant,2004,19(9):2166-2170.
14 Bridoux F,Hugue V,Coldefy O,et al.Fibrillary glomerulonephritis and immunotactoid (microtubular) glomerulopathy are associated with distinct immunologic features.Kidney Int,2002,62(5):1764-1775.
15 曾彩虹,朱小东.增生性肾小球肾炎伴晶格状结构的单克隆IgG沉积.肾脏病透析与肾移植,2011,20(4):384-390.
16 Bridoux F,Desport E,Frémeaux-Bacchi V,et al.Glomerulonephritis With Isolated C3 Deposits and Monoclonal Gammopathy:A Fortuitous Association? Clin J Am Soc Nephrol,2011,6(9):2165-2174.
17 Herlitz LC,Roglieri J,Resta R,et al.Light chain proximal tubulopathy.Kidney Int,2009,76(7):792-797.

