N-mPEG-O-季铵化壳聚糖微球的制备及其载药性能
王 军,李明春,辛梅华,张晓林,毛扬帆
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程研究中心,福建 厦门 361021)
壳聚糖具有良好的生物降解性、生物相容性和低毒等优点,因此改性壳聚糖衍生物作为药物载体成为研究的热点。Wan等[1]合成了O-季铵化壳聚糖并以三聚磷酸钠(TPP)为交联剂制备纳米微粒,研究其对牛血清蛋白的载药结果表明O-季铵化壳聚糖纳米粒比壳聚糖纳米粒突释小。Zhang等[2]以TPP交联制备CS-mPEG纳米粒,对胰岛素的载药结果表明微粒具有壳聚糖的核心和聚乙二醇(PEG)的外壳;PEG取代度增加载药率增加,并且 PEG的引入使CS-mPEG微粒的释放率增大并具有缓释效果。Qu等[3]制备了N-mPEG-N-辛基-O-磺化壳聚糖载紫杉醇胶束,体内外评价结果表明PEG基团的引入使胶束在静脉注射时更稳定,具有缓释效果。Liang等[4]合成PEG接枝季铵盐壳聚糖并和胆固醇制备脂质体,对紫杉醇的载药研究表明其对紫杉醇具有较好的包封率和载药量,载药脂质体在PBS7.4的缓冲溶液中有较好的缓释效果,两周后累积释放率为80%~86%。综上可见,季铵化改性壳聚糖具有减小突释和弱碱性介质中缓释的性能,而mPEG改性壳聚糖能提高载药率、使药物具有缓释效果等功能,将两者结合在一起有望制备载药性能更优的壳聚糖衍生物。
载药微球具有延长药物在体内的半衰期、保护药物和控制药物释放等特点。Guerrero等[5]制备戊二醛交联壳聚糖微球,对酮替芬的载药量为 92 μg/mg,在 pH 值 7.4下能缓释 50~100 h。Shavi等[6]制备交联壳聚糖微球,对阿纳托唑的载药结果表明其具有缓释效果,48 h后小鼠血药浓度依然可检测。但是目前报道的载药壳聚糖微球,大多以TPP和戊二醛为交联剂存在着微球稳定性和细胞毒性等问题[7]。本文以反应条件温和、反应效率高的水溶性二乙烯基砜为交联剂[8]制备N-mPEG -O-季铵化壳聚糖微球(合成路线见图 1),以酮洛芬为模型药物研究引入mPEG和季铵盐基团对改性壳聚糖微球载药和释放行为的影响,为PEG进一步改性的季铵化壳聚糖微球在药物缓控释中的应用提供依据。
1 实验部分
1.1 主要仪器和试剂
FD-1B-50冷冻干燥机(北京博医康实验仪器公司);UV-3100PC紫外可见分光光度计(上海美谱达仪器有限公司); NEXUSU 470型傅里叶变换红外光谱仪(美国Nicolet公司);AvanceⅡ型核磁共振分析仪(瑞士Bruker公司);VARIO EL Ⅲ元素分析仪(德国 Elementa 公司);S-4800型场发射扫描电子显微镜(日本日立公司)。
壳聚糖(CS,DD%=92.85%,=3×105)浙江金壳生物化学有限公司;聚乙二醇单甲醚(mPEG,=1000),上海晶纯实业有限公司;3-氯-2-羟丙基三甲基氯化铵(CTA),实验室自制[9];二甲基亚砜(DMSO),上海国药集团化学试剂公司;二乙烯基砜(DVS),上海海曲化工有限公司;酮洛芬(KP),武穴市迅达药业;其它试剂均为市售分析纯。
1.2 mPEG-CHO的合成
[10]并作适当的修改,具体如下:将4g mPEG溶解于9 mL DMSO/CHCl3(体积比5/1)混合溶液中,在N2保护下滴入10 mL DMSO/乙酸酐(体积比4/1)混合液, 室温反应10h。冰乙醚中沉淀,抽滤,产物用少量CHCl3溶解后再用冰乙醚沉淀,反复3次抽滤得醛化的mPEG。30℃真空干燥得mPEG-CHO。
1.3 N-mPEG-O-季铵化壳聚糖的合成
按照文献[9]制备O-2-羟丙基三甲基氯化铵壳聚糖(QACS),然后将2 g QACS分散于50%甲醇/水溶液中, 加入mPEG-CHO的甲醇溶液,室温反应4 h,NaBH4还原。产物用蒸馏水透析3天,冷冻干燥得QACS-mPEG。
1.4 N-mPEG-O-季铵化壳聚糖微球的制备
参考文献[11]制备 DVS交联微球,将 2 g QACS-mPEG溶于水后,倒入液体石蜡中,加入Span80 乳化30 min,滴入 0.97%的DVS-NaOH溶液,常温反应2 h后升温至40 ℃反应2 h。离心,取下层沉淀分别用石油醚、乙醇和水洗涤,40 ℃真空干燥得二乙烯基砜交联QACS-mPEG微球。
CS和QACS分别溶于2%HAc和水中,按照上述步骤制备CS和QACS微球。
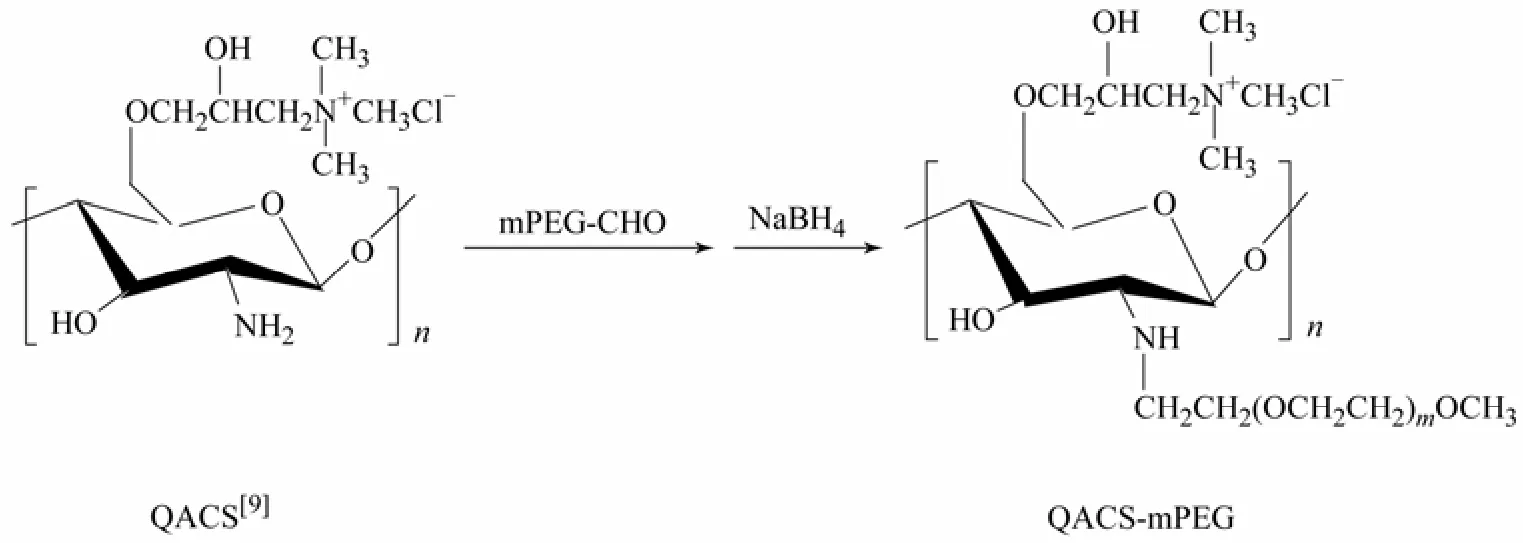
图1 N-mPEG-O-季铵化壳聚糖的合成路线
1.5 产物的载药性能
1.5.1 QACS-mPEG微球的载药性能
取 50 mg QACS-mPEG微球加入 10 mL 60 mg/mL酮洛芬-乙醇溶液中,30 ℃恒温水浴振荡1 h(120 r/min),过滤,测定滤液在UV260 nm处的吸光值,由线性方程计算微球对酮洛芬的载药量Qe如下:
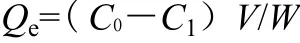
式中V和W分别为溶液的体积(mL)和微球的质量(mg);C0和C1分别表示酮洛芬的初始浓度和载药后溶液中剩余酮洛芬的浓度(mg/mL);Qe为载药量(mg/mg)。
同样方法测定CS和QACS交联微球的Qe值。
1.5.2 载药QACS-mPEG微球的药物释放行为
将上述载药微球过滤,40 ℃真空干燥。分别取50 mg载药QACS-mPEG微球加入装有30 mL模拟肠液和模拟胃液[9]的锥形瓶中,37 ℃恒温水浴振荡(120 r/min)。每隔一定时间取5 mL释放液并补充5 mL相应的释放介质,在UV260 nm测定吸光值,由相应的标准曲线计算释放液中酮洛芬的浓度并绘制释放曲线。
同样方法测定CS和QACS微球的释放曲线。
2 结果与讨论
2.1 产物的结构与表征
2.1.1 产物的红外光谱分析
采用KBr 压片法,测得N-mPEG-O-QACS微球制备过程中各产物的红外光谱如图2所示。
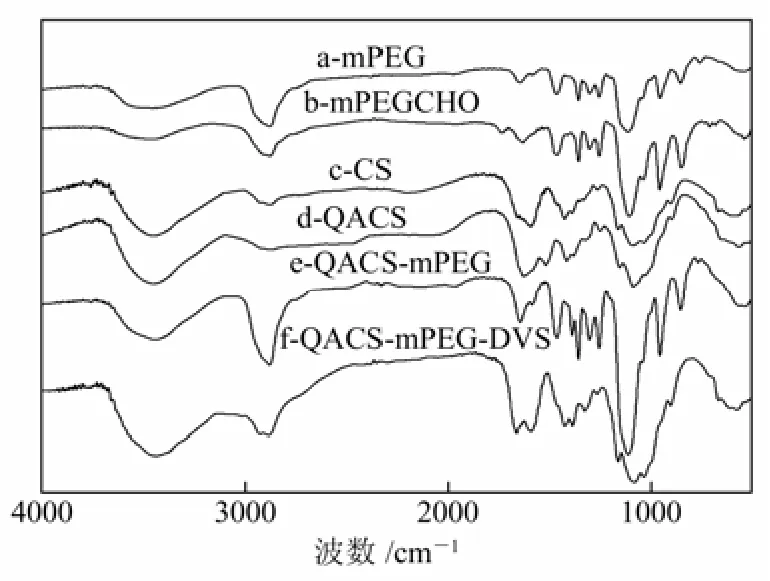
图2 合成产物的FTIR图
图2中a、b分别为mPEG和mPEG-CHO的FTIR谱图,2868 cm-1附近的吸收峰为聚乙二醇重复单元(—CH2—CH2—O—)中C—H的伸缩振动峰,1100 cm−1处为mPEG-CHO中醚键C—O—C的伸缩振动峰,b与a相比,1725 cm−1处出现了醛基的C=O伸缩振动吸收峰,证明mPEG已醛化[10]。c和d分别为CS和QACS的FTIR谱图,d与c相比较,在1484 cm−1出现季铵盐中甲基、亚甲基的C—H弯曲振动峰,1631 cm−1处出现季铵盐的反对称伸缩振动峰,991 cm−1处为季铵盐的吸收峰,证明在分子中季铵盐侧链的引入[9]。e为QACS-mPEG的FTIR谱图,与d相比较,1106 cm−1附近为mPEG的C—O—C伸缩振动吸收峰,1579 cm−1处—NH2吸收峰的减弱说明mPEG 被引入QACS的氨基上[10]。谱线f为二乙烯基砜交联的QACS-mPEG微球的FTIR谱图,与e相比,f 在1318 cm−1处为二乙烯砜中—SO2—的反对称伸缩振动峰,说明产物为DVS交联的QACS-mPEG。
2.1.2 产物的核磁共振分析
以D2O为溶剂,测得产物的1H NMR谱图如图3所示。其中δ4.76处是D2O的溶剂峰,δ3.41~3.44是—CH2(7)CH(8)(OH)CH2(9)N+(CH3)3(10)中H7、H8、H9位的质子峰,δ3.14是—N+(CH3)3(10)中H10的质子峰,说明季铵基团已被引入到壳聚糖的C6—OH上[12]。δ3.3是—NHCH2(e)CH2(d)中H(d)的质子峰,δ3.46~3.56是—OCH2CH2(c)和壳聚糖糖环残基上H3、H4、H5、H6位的质子峰,δ3.71是—CH2CH2(b)OCH3中H(b)的质子峰,δ3.16是—OCH3(a)中H(a)的质子峰,δ2.97是壳聚糖糖环残基上H2的质子峰,δ2.51是—NHCH2(e) CH2(d)—中H(e)的质子峰,δ1.97是壳聚糖中乙酰氨基(—NHCOCH3)中N上H的质子峰[10]。由FTIR和1H NMR说明产物为mPEG接枝季铵化壳聚糖衍生物。
2.1.3 产物的元素分析及取代度
N-mPEG-O-季铵化壳聚糖合成过程中各产物的元素分析结果见表1,表中CS(BA)和QACS(BA)分别为N-苯甲基壳聚糖和O-季铵化-N-苯甲基壳聚糖。用C/N计算各产物的取代度[12],可见QACS、QACS-mPEG的取代度分别为59.20%和17.27%。
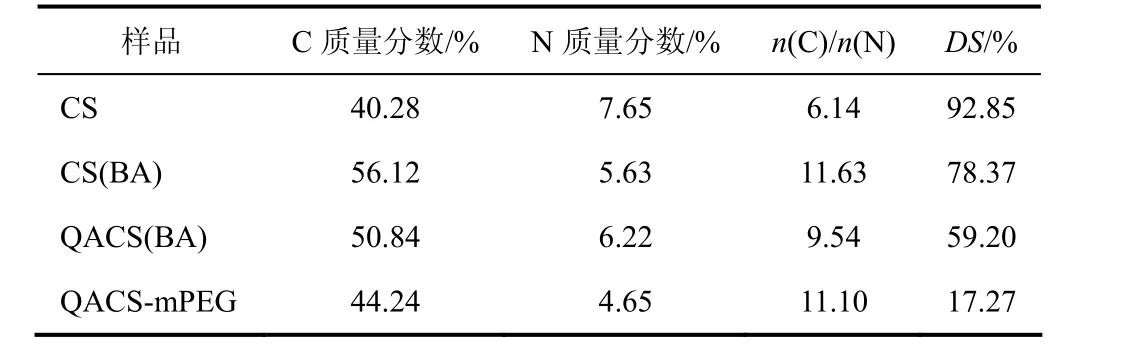
表1 合成产物的元素分析及取代度
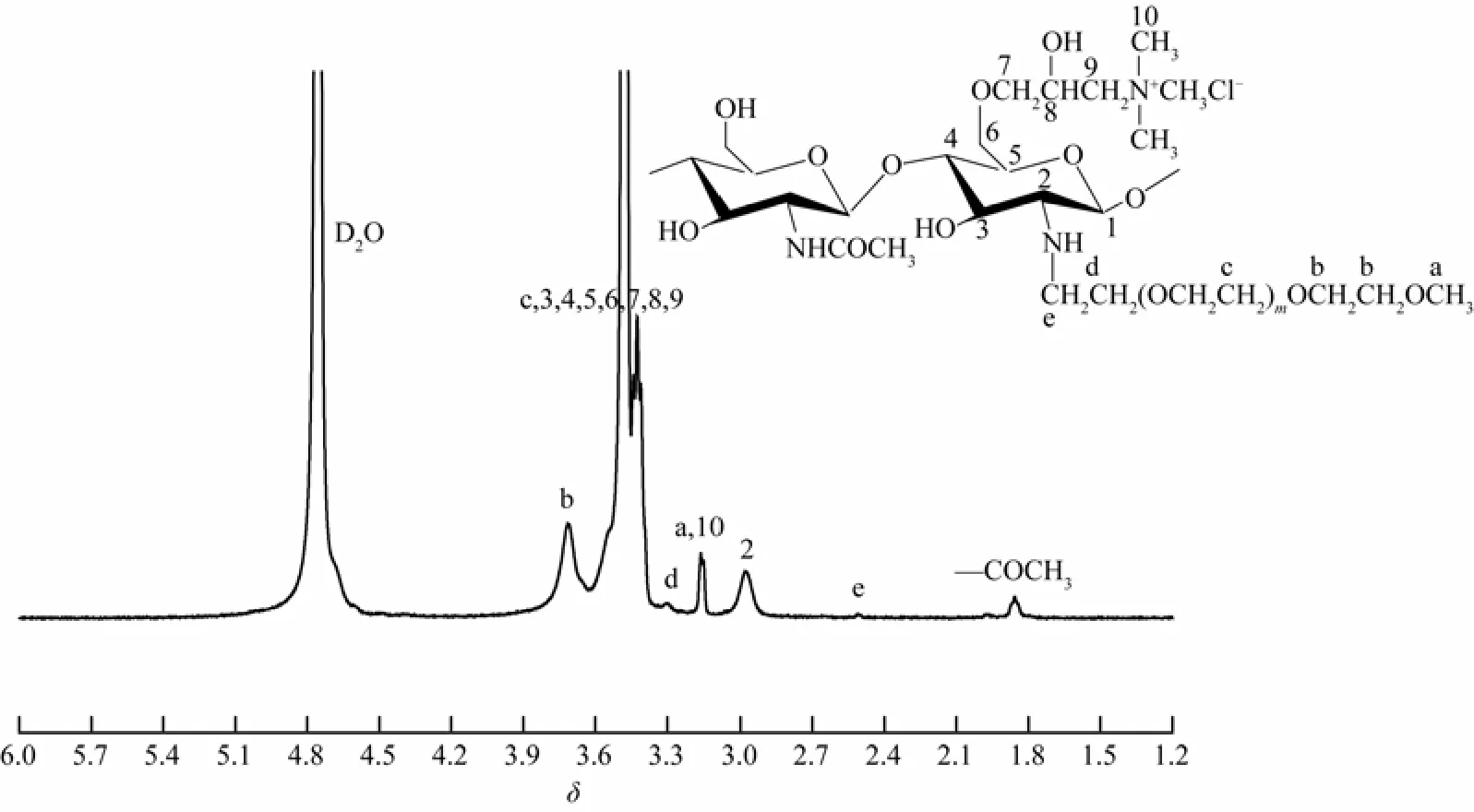
图3 合成产物的1H NMR谱图
2.1.4 产物的溶解性试验
分别称取0.1 g样品于100 mL溶剂中,观察其溶解情况,结果见表2。
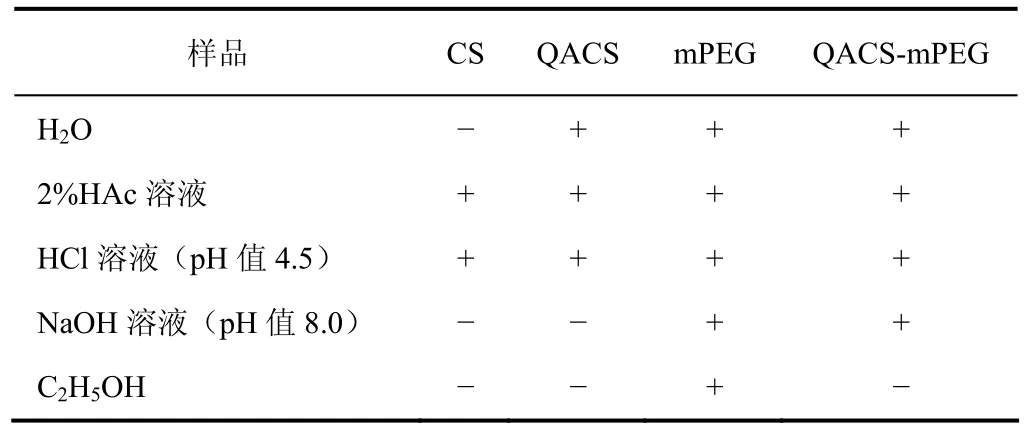
表2 产物的溶解性
由表2可以看出,CS只有在弱酸性条件下可以溶解,这是由于壳聚糖分子内和分子间的氢键作用。引入季铵基团后产物的水溶性明显变好,O-季铵化壳聚糖(QACS)可以溶解在水和弱酸性溶液中,而N-mPEG接枝O-季铵化壳聚糖可以溶解在水、弱酸和弱碱性介质中,拓宽了应用范围。
2.1.5 QACS-mPEG微球的SEM分析
用SEM观察微球的外观形貌,结果见图4,可见乙烯基砜交联QACS-mPEG微球球形较为完整,微球粒径范围在1~5 μm。
2.2 微球的载药性能
称取 60 ℃真空干燥至恒重的酮洛芬10 mg,乙醇溶解后转入100 mL容量瓶定容得浓度为0.1 mg/mL的酮洛芬-乙醇溶液,稀释得一系列浓度的标准溶液,在260 nm处测定吸光值,求得线性回归方程为A=0.0693C+0.0034(R2=0.9998),C为μg/mL,线性范围在0~30 μg/mL。

图4 QACS-mPEG微球的SEM图
分别称取CS、QACS和QACS-mPEG微球各50 mg,置于10 mL 60 mg/mL的酮洛芬-乙醇溶液中,30 ℃恒温水浴振荡1 h(120 r/min),过滤,测定滤液在UV260 nm处的吸光值,由酮洛芬-乙醇溶液的线性方程,计算各微球的载药量如表3所示。
由表3可见,在载药条件相同的情况下QACS微球的载药量优于CS微球,这是因为季铵化壳聚糖的—N+(CH3)3基团具有较高的正电性,与含有负电性基团的酮洛芬之间的静电缔合作用增强,载药量增加。而QACS-mPEG微球中除了季铵化壳聚糖和酮洛芬之间的静电缔合作用外,聚乙二醇基团与酮洛芬的氢键作用使载药量进一步提高[13]。

表3 微球的载药性能比较
2.3 载药微球的药物释放性能
按照上述同样方法配置一系列浓度的酮洛芬-模拟胃液和酮洛芬-模拟肠液溶液,在260 nm处测定吸光值,求得线性回归方程分别为A=0.0611C+0.0101(R2=0.9998)和A=0.0681C-0.007(R2=0.9999),C为μg/mL,线性范围0~30 μg/mL。
根据实验部分1.5.3节的操作,测得载药CS、QACS和QACS-mPEG微球在模拟胃液和肠液中的药物释放曲线如图5。
从图5中可以看出,CS微球在胃液和肠液中6~7 h药物的释放率达到90%以上。与CS微球不同,QACS微球在肠液中的释放较为缓慢,35 h后累积释放率为57%;而在胃液中,前7 h释放较快,35 h后释放平衡,累积释放为75.6 %。这可能是因为季铵盐基团和酮洛芬在不同pH值下存在形式不同,酮洛芬是一种酸性药物,在pH=7.4的模拟肠液中电离成负离子,而季铵盐基团在模拟肠液中以—N+(CH3)3的形式存在,与酮洛芬的静电吸引和缔合作用较强,释放缓慢;在pH=1.2的模拟胃液中酮洛芬主要以分子形式存在,季铵盐基团以N+(CH3)3Cl−形式存在,两者之间的静电吸引和缔合作用减弱,释放加快[14]。载药QACS-mPEG微球与载药QACS微球有相似的释放规律,即在模拟胃液中的释放速率大于在模拟肠液的释放速率,在胃液和肠液中35h后的累积释放率分别为81.4%和70.1%,且在肠液的缓释效果优于胃液,这可能是因为引入的mPEG含有—C—O—C—结构,能够与酮洛芬形成氢键,带正电的季铵盐基团能够与酮洛芬产生静电缔合作用,两者的共同作用使得QACS-mPEG微球在模拟肠液中有较好的缓释效果[15]。
3 结 论
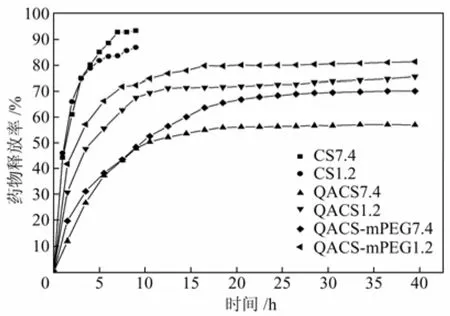
图5 载药微球的药物释放曲线
将聚乙二醇单甲醚(mPEG)醛化改性后,通过西佛碱反应接枝到O-季铵化壳聚糖的NH2上,硼氢化钠还原制得N-mPEG接枝O-季铵化壳聚糖。用反相悬浮法制备二乙烯基砜交联QACS-mPEG微球。以酮洛芬为模型药物,研究微球的载药性能及释放行为。结果表明,QACS-mPEG微球对酮洛芬的载药量高于QACS微球和CS微球;载药QACS-mPEG微球的累积释放率大于QACS微球,并且在肠液的缓释效果优于胃液及载药QACS微球,在药物控释领域具有一定的应用前景。
参 考 文 献
[1]Wan Ajun,Sun Yan,Li Huili.Characterization of novel quaternary chitosan derivative nanoparticles loaded with protein[J].Journal of Applied Polymer Science,2009,114:2639–2647.
[2]Zhang X G,Teng D Y,Wu Z M,et al.PEG-grafted chitosan nanoparticles as an injectable carrier for sustained protein release[J].Journal of Material Science:Material in Medicine,2008,19:3525-3533.
[3]Qu Guowei,Yao Zhong,Zhang Can,et al.PEG conjugatedN-octyl-O-sulfate chitosan micelles for delivery of paclitaxel:In vitrocharacterization and in vivo evaluation[J].European Journal of Pharmaceutical Sciences,2009,37:98-105.
[4]Liang Xiaofei,Sun Yanming,Duan Yourong,et al.Synthesis and characterization of PEG-graft-quaternized chitosan and cationic polymeric liposomes for drug delivery[J].Journal of Applied Polymer Science,2012,125(2):1302-1309.
[5]Guerrero Sandra,Teijón César,Muniz Enriqueta,et al.Characterization andin vivoevaluation of ketotifen-loaded chitosan microspheres[J].Carbohydrate Polymers,2010,79:1006-1013.
[6]Gopal V Shavi,Usha Y Nayak M,Sreenivasa Reddy,et al.Sustained release optimized formulation of anastrozole-loaded chitosan microspheres:In vitroand in vivoevaluation[J].Journal of Material Science:Material in Medicine,2011,22:865-878.
[7]Dasha M,Chiellini F,Ottenbriteb R M,et al.Chitosan-A versatile semi-synthetic polymer in biomedical applications[J].Progress in Polymer Science,2011,36:981-1014.
[8]Yu Yu,Chau Ying.One-step “click” method for generating vinyl sulfone groups on hydroxyl-containing water-soluble polymers[J].Biomacromolecules,2012,13:937−942.
[9]毛扬帆,李明春,辛梅华,等.O-季铵化改性壳聚糖固载环糊精的制备及其载药性能[J].化工进展,2010,29(9):1705-1709.
[10]Zheng J,Xie H,Yu W,et al.Chitosan-g-MPEG-modified alginate/chitosan hydrogel microcapsules:A quantitative study of the effect of polymer architecture on the resistanceto protein adsorption[J].Langmuir,2010,26(22):17156–17164.
[11]谢峰.壳聚糖固载阳离子环糊精聚合物微球的制备及载药性能[D].福建:华侨大学,2011.
[12]Tao Xu,Xin Meihua,Li Mingchun,et al.Synthesis,characterization,and antibacterial activity ofN,O-quaernary ammonium chitosan[J]Carbohydrate Research,2011,346:2445-2450.
[13]Ermis Dilek,Tarlmcl Niliifer.Ketoprofen sustained-release suppositories containing hydroxypropylmethylcellulose phthalate in polyethylene glycol bases[J].International Journal of Pharmaceutics,1995,113:65-71.
[14]Hu Hebing,Yu Lin,Tan Songwei,et al.Novel complex hydrogels based onN-carboxyetheyl chitosan and quaternized chitosan and their controlledin vitroprotein release property[J].Carbohydrate Research,2010,345:462-468.
[15]Kuntal Ganguly,Tejraj M Aminabhavi,Anandrao R Kulkarni,et al.Colon targeting of 5-fluorouracil using polyethylene glycol cross-linked chitosan microspheres enteric coated with cellulose acetate phthalate[J].Ind.Eng.Chem.Res.,2011,50:11797-11807.

