温度对β-甘露聚糖酶在毕赤酵母中表达的影响
周洪波,林福来,郑 甲,郭 宁,吴俊子,吴丽双,邱冠周
(1. 中南大学 资源加工与生物工程学院, 湖南 长沙 410083; 2. 生物冶金教育部重点实验室, 湖南 长沙 410083)
β-1,4-D-甘露聚糖酶(endo-1,4-D-mannanase,EC 3.2.1.78) 能够随机催化水解甘露聚糖、半乳甘露聚糖、葡甘露聚糖和半乳葡甘露聚糖等中的β-1,4-甘露糖苷键,属于半纤维素酶类[1],它有着许多广泛的应用前景,例如纸浆漂白,降低咖啡提取物的粘度,提高饲料的营养价值和用于石油开采等[2]。随着β-甘露聚糖酶的应用越来越广泛,其需求量也越来越大,为了提高β-甘露聚糖酶的产量,目前β-甘露聚糖酶已经成功地在原核和真核表达系统中进行异源表达。
巴斯德毕赤酵母表达系统是目前研究比较清楚、应用最广、最有效的外源蛋白表达系统之一。目前β-甘露聚糖酶已经在毕赤酵母中获得了成功表达,例如李松瑜[3]等构建的β-甘露聚糖酶工程菌在毕赤酵母中获得了成功表达,摇瓶发酵24 h,发酵上清液酶活可以达到343 U·mL-1,产酶蛋白量约为 1.0 mg·mL-1。
蛋白的降解是高密度发酵培养的一个主要问题[4]。许多报道表明通过降低温度可以有效减少外源重组蛋白的降解,温度控制策略能有效防止外源蛋白的降解[5-7]。温度对毕赤酵母的影响主要是影响酵母细胞的生长速率,温度过低抑制生长,毕赤酵母最适生长温度为 28~30 ℃,但是对于外源蛋白的表达而言,温度的影响是各种因素综合表现的结果。越来越多的研究报道表明降低培养温度可以提高外源重组蛋白的表达量,例如,Jin等[8]利用毕赤酵母表达系统表达外源猪干扰素-α,其表达产量在 20℃下可以达到5 g/L,是30 ℃培养下的1.6倍。
本文通过观察不同温度下β-甘露聚糖酶活力,并通过SDS-PAGA图谱验证了低温有利于外源蛋白在发酵液中的积累。并且从不同温度下的菌体活性,发酵液中蛋白酶活力,mRNA表达水平来解释了温度对于β-甘露聚糖酶在毕赤酵母中表达的影响机制。
1 实验部分
1.1 实验材料与设备
菌种:β-甘露聚糖酶重组毕赤酵母菌株。
培养基:YPD 液体培养基:蛋白胨 2%,酵母粉1%,葡萄糖 2%。
仪器与设备:恒温培养箱(GHP-9050),荧光定量PCR仪(ABI 7000), 垂直电泳槽(DYCZ-30)。
1.2 实验方法
1.2.1 培养方法
一级种子摇瓶培养:从平板菌落中挑取菌落,于50 mL摇瓶中培养,摇瓶装液量为10%,28 ℃,250 r/min条件下培养24 h达到菌体生长对数期。
摇瓶培养:按 1%的接种量,从一级摇瓶种子中,用移液枪吸取0.5 mL菌液,加入装有50 mL YPD液体培养基的250 mL锥形瓶中,平行三份,分别于30、26、22 ℃,250 r/min条件下培养。
1.2.2 测定方法
β-甘露聚糖酶酶活测定: 采用DNS法检测β-甘露聚糖酶酶活[9]。细胞活性:采用亚甲基蓝染色法[10]分析细胞活性。总蛋白浓度测定:利用考马斯亮蓝染色法测定总蛋白浓度。
SDS-PAGE检测目的蛋白:通过聚丙烯酰胺凝胶电泳(SDS-PAGE)的方法来检测发酵液中的目的蛋白。
β-甘露聚糖酶基因mRNA表达水平检测:利用实时荧光定量PCR技术检测β-甘露聚糖酶基因mRNA表达水平。
2 结果与分析
2.1 温度对β-甘露聚糖酶重组毕赤酵母菌株生理特性的影响
2.1.1 温度对重组菌株生长的影响
选取β-甘露聚糖酶重组毕赤酵母菌株先在 30℃下培养24 h,使得菌浓度迅速达到一定浓度,这是因为外源蛋白的表达量与菌体的生物量存在着正相关关系而且低温菌体生长慢。然后再改变温度为30、26、22 ℃这 3种培养条件下进行外源β-mannanase蛋白的表达,考察温度对β-甘露聚糖酶重组毕赤酵母菌株生长的影响。实验结果(图1)显示:重组毕赤酵母预先30 ℃培养24 h之后,再分别在30、26、22 ℃这3种条件下继续培养其表现出温度越低生长会稍微慢些,但区别不是很大,而且在不同温度下最终达到的菌浓度都差不多一致。说明了当重组菌株培养24 h之后进入生长对数中期后温度的降低对生长的影响不大。
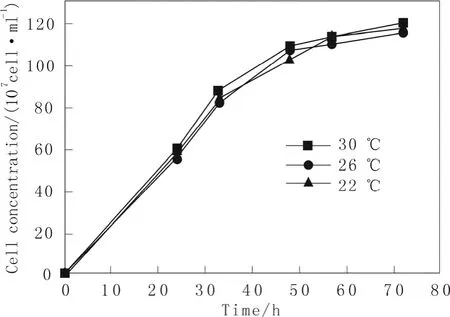
图1 重组菌株分别在30、26、22 ℃培养条件下的生长曲线Fig.1 The growth curve of recombinant stain respectively at 30,26,22 ℃
2.1.2 温度对毕赤酵母重组菌株存活率的影响
选取了培养 80 h的样品通过亚甲基蓝染色法来测定细胞的活性,考察不同培养温度对毕赤酵母重组菌株存活率的影响,结果如图2所示:随着温度的降低,重组菌株细胞存活率不断提高,重组菌株的细胞存活率从 30 ℃下的 40%增加到了 22 ℃下的90%。
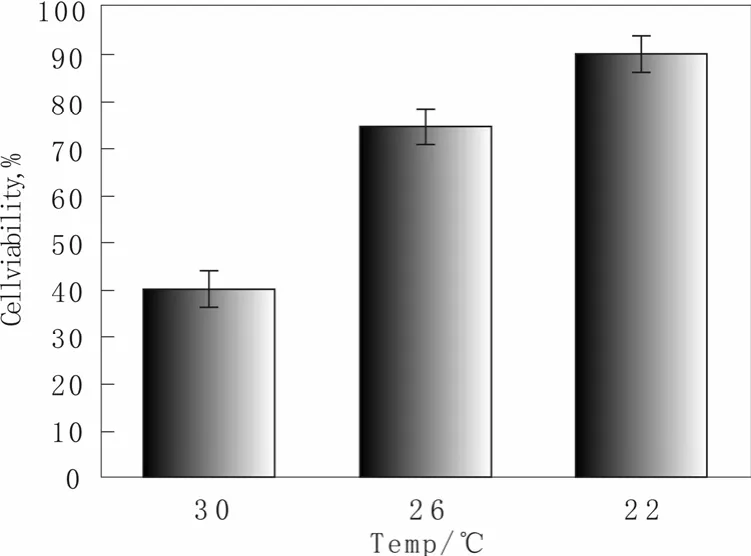
图2 不同温度下重组毕赤酵母细胞存活率Fig.2 Cell activity of recombinant Pichia pastoris at different culture temperatures
这一结果表明了温度的降低可以很大程度上减少了细胞的死亡,从而减少死亡细胞的裂解导致胞内蛋白酶的释放到发酵液中,最终减少外源β-mannanase蛋白的降解,使得目的蛋白β-mannanase酶活在低温下后期发酵过程中得到积累提高。这与很多文献报道相符,例如 Wang等[7]报道降低诱导温度可以提高聚半乳糖醛酸裂解酶在毕赤酵母中的表达量。温度控制策略是高密度发酵培养时有效防止外源目的蛋白降解的策略之一。
2.2 温度对β-甘露聚糖酶重组毕赤酵母菌株表达β-mannanase的影响
2.2.1 温度对重组菌株生长的影响
通过检测β-mannanase酶活变化曲线来表征温度对β-mannanase表达的影响。结果如图3所示:在培养至33 h之前,重组毕赤酵母菌株在不同培养温度下所表达出的酶活水平都差不多一致;当继33 h之后继续培养可以发现重组毕赤酵母菌株其β-mannanase酶活水平随着温度的降低而得到提高;从图3中可清楚的发现在30 ℃下重组菌株在后期发酵过程中酶活水平有显著降低,从最高134 U/mL下降到61 U/mL;而在26 ℃的条件下重组菌株在后期发酵过程中酶活水平几乎没有降低;当培养温度降低至 22℃的时候重组菌株在后期发酵过程中酶活水平有着显著的继续积累增加,从 33 h的 123 U/mL增加到307 U/mL。这些结果说明了温度的降低可以减少后期发酵过程中外源蛋白的降解,使得外源蛋白表达量得到继续积累。温度不仅影响着外源蛋白的降解,还影响着外源蛋白的合成等。
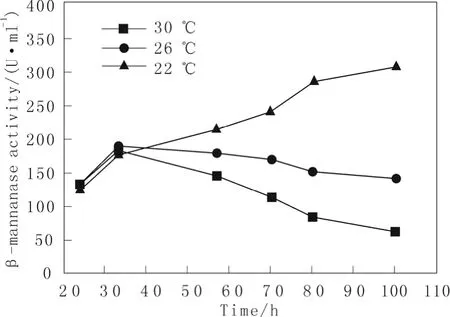
图3 不同温度对重组菌株β-mannanase酶活的影响。Fig.3 The effect of temperature on β-mannanase activity in recombinant strain
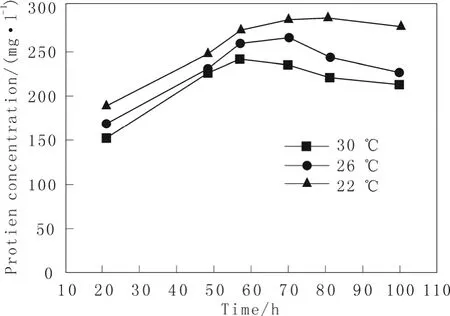
图4 不同温度下重组菌株总蛋白表达情况Fig.4 The effect of temperature on the expression of total protein in recombinant strain
2.2.2 温度对重组菌株总蛋白表达量的影响
由于毕赤酵母宿主分泌到发酵液中的自身蛋白质的量很少,发酵液中的蛋白质绝大部分是外源蛋白,所以通过检测发酵上清液中的总蛋白含量可以初步表征目的蛋白的产量。通过测定重组菌株在不同培养温度下发酵上清液中的总蛋白变化曲线,结果如图4所示重组毕赤酵母菌株总蛋白的含量随着培养温度的降低而显著增加,重组菌株总蛋白量从30 ℃下的 187 mg·L-1增加到 22 ℃下的 277 mg·L-1。
2.2.3 SDS-PAGE分析不同温度下重组菌株目的蛋白的表达情况
通过SDS-PAGE我们直接从目的蛋白的含量来表明温度对外源重组蛋白表达的影响。结果如图 5所示:在图5(A)中30 ℃培养条件下发酵后期如60、72、84 h即5、6、7号泳道可以清楚发现β-mannanase目的蛋白被降解的很严重,SDS-PAGE几乎检测不到β-mannanase目的蛋白,这与图3中30 ℃下酶活的变化趋势一致;在图 5(B)中 26 ℃培养条件下发酵后期如60、72、84 h即5、6、7号泳道 SDS-PAGE仍能检测到目的蛋白, β-mannanase目的蛋白存在着稍微降解的现象,这与图3中26 ℃培养下酶活的变化曲线相一致;在图 5(C)中 22 ℃培养条件下发酵后期如 60、72、84 h即 5、6、7号泳道SDS-PAGE检测到目的蛋白仍有少量增加,这与图3中22 ℃培养下酶活的变化曲线相一致。
图5的结果说明了随着温度的降低发酵液中目的蛋白量的降解减少使得目的蛋白可以继续积累增加,酶活得以继续提高。
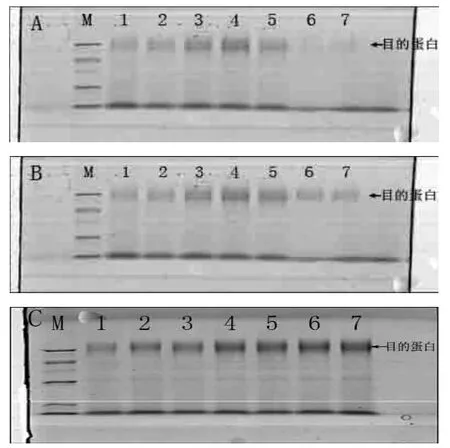
图5 不同温度下β-mannanase目的蛋白表达情况Fig.5 The effect of temperature on the expression of β-mannanase protein
这里主要可能是因为随着温度的降低,减少了外源目的蛋白的在发酵液中被降解的现象[6]。另外可能也是因为温度的降低导致转录水平的降低从而导致合成速率的降低,使得蛋白合成速率与分泌速率相协调,从而减少 ER Stress、UPR,protein degradation 等[11,12]。
2.2 温度对重组菌株发酵液中蛋白酶活力的影响
从 2.2.3小节结果说明了温度的降低使得目的蛋白在发酵后期降解减少,为了具体说明温度的变化,是改变了发酵液中蛋白酶活力,我们通过紫外光谱法[13]测定了80 h样品的发酵液中的蛋白酶活力在不同温度下的差别,酶活定义为1 min水解酪素产生1 μg酪氨酸为1个酶活力单位,以U·mL-1表示,结果如图6所示:随着温度的降低,发酵上清液中的蛋白酶活力也随着显著降低,如 30 ℃时候蛋白酶活力为405 U·mL-1而26 ℃和22 ℃的蛋白酶活力则分别降至210和66 U·mL-1。从这结果我们可以明显发现温度的降低有利于蛋白酶活力的显著降低,这可能主要是因为:随着温度的降低,细胞存活率越高(图2),减少了细胞死亡后内源性蛋白酶的释放;温度的降低同时也降低了内源性蛋白酶的合成速率;温度的降低同时较少了目的蛋白过量表达导致ER Stress、UPR等造成内源蛋白酶合成的增加以降解胞内错误折叠或者未分泌的蛋白;另外温度的降低也有可能降低了发酵液酶活的比活力,使得降解目的蛋白的现象得到减轻。
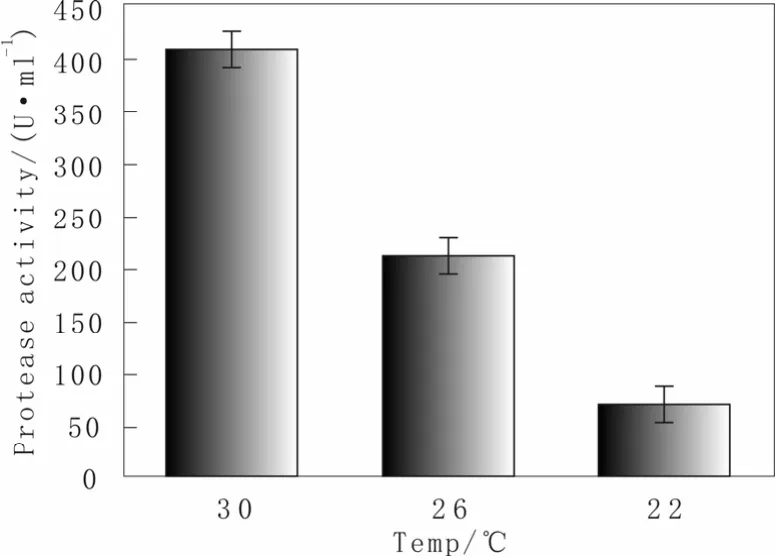
图6 不同温度下蛋白酶活力差异:横坐标表示为不同的培养温度分别为30、26、22 ℃。Fig.6 The effect of temperature on the protease,X-axis respectively representing culture temperature of 30, 26, 22℃
2.2 real-time qPCR分析不同温度下重组菌株β-mannanase mRNA表达情况
有文献报道温度的降低可以降低蛋白的合成速率,从而降低外源蛋白的折叠负担、减少ER Stress和UPR反应等[14],为了分析温度的作用机制,我们分析其不同温度下的β-mannanase mRNA表达差异,结果如图 7所示:随着表达温度的降低,β-mannanase mRNA表达量也随着降低,而且温度越低,β-mannanase mRNA表达量降低得越多,例如β-mannanase mRNA表达量从培养温度30 ℃变为26 ℃和22 ℃后分别降低了0.44和1.58。这个结果说明了温度的降低通过减少目的基因的转录水平,使得外源β-mannanase蛋白合成速率得以降低从而使得蛋白能够来得及正确折叠并与蛋白分泌速率协调;减少蛋白正确折叠和分泌的负担,随着错误折叠、未折叠、未释放的胞内蛋白的减少,ER Stress,UPR等反应也随着减少;最后使得外源目的蛋白的表达量得以增加。
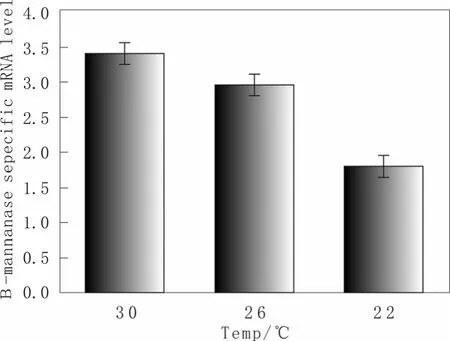
图7 不同温度下重组毕赤酵母菌株β-mannanase mRNA表达差异Fig.7 The effect of temperature on the expression of β-mannanase mRNA
3 结 论
在培养温度分别为 30、26、22 ℃这三种不同温度下进行培养,考察了温度对β-甘露聚糖酶重组毕赤酵母菌株生理及目的蛋白表达的影响,并初步研究了温度的作用机制得到了以下结论:
(1)当重组菌株培养24 h进入生长对数中期后,温度的降低对菌体的生长速率影响不大,且最终菌浓度也差异不大。
(2)温度的降低显著的提高了重组菌株的细胞存活率:较高培养温度下发酵后期的细胞存活率显著降低,而在低温培养下发酵后期细胞仍能保持很高的存活率。
(3)发酵液中的总蛋白含量都随着温度的降低而增加。在温度较高的培养条件下,重组菌株其β-mannanase酶活力在发酵后期有显著降低,而在低温培养下重组菌株β-mannanase酶活力在发酵后期能继续增加;通过SDS-PAGE分析表明了较高温度培养下目的蛋白在发酵后期被降解严重,而在低温培养下目的蛋白在后期仍能继续积累。
(4)温度的降低是通过降低了发酵液中的蛋白酶活力的作用机制使得目的蛋白的降解减少。
(5)温度的降低减少了目的蛋白 mRNA转录水平,使得外源蛋白合成速率得以降低从而与蛋白分泌速率相协调等;最后使得外源目的蛋白的表达量得以增加。
[1]吴襟,何秉旺. 微生物β-甘露聚糖酶[J]. 微生物学通报, 1999,26(2):134-136.
[2]Dhawan S KJ. Microbial mannanases:an overview of production and applications[J]. Crit Rev Biotechnol Lett, 2007, 27(2):197-216.
[3]李松瑜,陈小玲,王军军,曹云鹤,董冰.硫色曲霉β甘露聚糖酶在毕赤酵母中的组成型分泌表达[J]. 生物技术通讯, 2009, 20:12-14.
[4]Cereghino J L, Cregg J M. Heterologous protein expression in the methylotrophicyeastPichia pastoris[J]. FEMS Microbiology Reviews,2000, 24(1):45-66.
[5]Zhu T, You L, Gong F ,et al. Combinatorial strategy of sorbitol feeding and low-temperature induction leads to high-level production of alkaline β-mannanase inPichia pastoris[J]. Enzyme and Microbial Technology, 2011, 49(23):407-412.
[6]Li Z. Low-Temperature Increases the Yield of Biologically Active Herring Antifreeze Protein inPichia pastoris[J]. Protein Expression and Purification, 2001, 21(3):438-445.
[7]Wang Y, Wang Z, Xu Q ,et al. Lowering induction temperature for enhanced production of polygalacturonate lyase in recombinantPichia pastoris[J]. Process Biochemistry, 2009, 44(9):949-954.
[8]Jin H, Liu G, Dai K ,et al. Improvement of porcine interferon-alpha production by recombinantPichia pastorisvia induction at low methanol concentration and low temperature[J]. Appl Biochem Biotechnol, 2011,165(2):559-571.
[9]Yang P, Li Y, Wang Y ,et al. A Novel β-mannanase with High Specific ActivityfromBacillus circulansCGMCC1554: Gene Cloning,Expression and Enzymatic Characterization[J]. Applied Biochemistry and Biotechnology, 2009, 159(1):85-94.
[10]Wu J-M, Fu W-C. Intracellular co-expression of Vitreoscilla hemoglobin enhances cell performance and β-galactosidase production inPichia pastoris[J]. Journal of Bioscience and Bioengineering, 2012,113(3):332-337.
[11]Yoshida H. ER stress response, peroxisome proliferation, mitochondrial unfolded protein response and Golgi stress response[J]. IUBMB Life,2009, 61(9):871-879.
[12]Resina D, Bollok M, Khatri NK ,et al. Transcriptional response ofP.pastorisin fed-batch cultivations to Rhizopus oryzae lipase production reveals UPR induction[J]. Microb Cell Fact, 2007, 6(1):21.
[13]张寒俊, 杨国燕. 紫外光谱法定量测定不同种蛋白酶活性的研究[J]. 粮食与饲料工业, 2004(9):44-45.
[14]Dragosits M, Stadlmann J, Albiol J ,et al. The Effect of Temperature on the Proteome of RecombinantPichia pastoris[J]. Journal of Proteome Research, 2009, 8(3):1380-1392.

