EGCG对糖尿病肾病模型大鼠肾小管间质性损害的治疗作用及机制
马祖等
(广州医学院附属沙井医院,广东深圳518104)
糖尿病肾病是糖尿病微血管病变的并发症,也是糖尿病患者最常见的死亡原因之一。30%~45%的2型糖尿病患者可发展为糖尿病肾病[1]。近年来人们认识到糖尿病肾小管病变是糖尿病肾病发生、发展的独立因素[2],糖尿病状态下肾小管病变的程度与蛋白尿排泄量和肾功能进行性下降密切相关并直接影响预后。(-)-Epigallocatechin 3-O-Gallate(EGCG)具有强大的抗氧化应激作用,其作用是维生素C的100倍、维生素E的25倍。EGCG对毒物、药物等诱导的肝损害模型的抗氧化应激、纤维化作用已有多篇报道[3~5],但其对肾脏疾病的作用鲜有报道。2012年6~10月,我们观察了EGCG对糖尿病肾病模型肾小管间质性病变的干预作用,现报告如下。
1 材料与方法
1.1 材料 健康雄性8~10周Wistar大鼠60只,体质量210~230 g,平均219 g,由南华大学动物实验室提供[许可证号:SYXK(湘)2010-0006]。EGCG购自江西绿康天然产物有限公司。链脲佐菌素(STZ)购自Sigma公司。VEGF抗体(单克隆兔抗鼠抗体)、TGF-β1抗体(多克隆抗体)、RAGE 抗体(多克隆抗体)购自Santa Cruz生物技术公司。
1.2 实验方法
1.2.1 模型制作及分组 参照郭啸华等[6]以及李莉等[7]的制模方法,60只大鼠高糖高脂饲料(含猪油10%,蔗糖20%,胆固醇2.5,胆酸钠1%,基础饲料66.5%)喂养4周。取16只作为正常对照组(对照组),另44只制作糖尿病肾病模型:大鼠禁食12 h(不禁饮),一次性腹腔注射STZ 30 mg/kg(溶解于0.01 mol/L 枸椽酸缓冲液中,pH 4.5),同时腹腔注射50%葡萄糖5 mL。对照组腹腔内注射等量枸缘酸缓冲液。注射后48 h尾静脉采血,采用血糖仪测定全血血糖(BG),BG>16.7 mmol/L为糖尿病模型制作成功。本研究制作成功糖尿病肾病模型共39只。
1.2.2 干预方法 参照张孝林等[8]的干预方法将39只模型大鼠随机分为模型组及治疗组,均皮下注射甘精胰岛素2 U,每日1次,对照组皮下注射等量生理盐水。三组均予高蛋白(酪蛋白20%,基础饲料80%)饲喂。参照郑子新等[9]方法,治疗组每日以EGCE 1 g溶于生理盐水10 mL中,每天分2次灌胃;对照组、模型组同样方法予等量生理盐水灌胃。保证入选大鼠足量饮水。
1.2.3 观察指标 干预第12周测定各组血糖、糖化血红蛋白(HbA1c)、Cr、BUN及尿 β2微球蛋白(β2-MG)及尿微量蛋白(ULA);ELISA法测定血清TGF-β1水平;荧光分光光度法测定血清血管收缩素转换酶(AGEs)水平;取肾组织行病理检查,免疫组化或免疫荧光法测定肾小管间质组织TGF-β1、晚期糖基化终产物受体(RAGE)、VEGF表达。
1.3 统计学方法 采用SPSS11.5统计软件。计量资料比较采用One-Way ANOVA检验,组间比较采用t检验。对观察组与治疗组观察指标行Post Hoc检验。P≤0.05为差异有统计学意义。
2 结果
2.1 观察指标 各组观察指标检测结果见表1。ANOVA分析见表2,由表2可见,三组各项指标之间均存在显著差异,特别是AGEs、ULA、血糖、TGF-β1差异更明显。模型组与治疗组观察指标间的Post Hoc检验结果见表3,由表3可见,治疗组与模型组各指标间均存在显著差异,以 AGEs、BUN、ULA更为显著。2.2 肾组织病理检查 ①HE染色:见图1。由图1可见,与治疗组比较,模型组肾小球、肾小管结构损害以及肾小管间质细胞数量减少更为明显,炎症细胞浸润更为明显。②PAS染色:见图2。由图2可见,模型组肾小球、肾小管结构损害明显重于治疗组,肾小球基底膜、肾小管基膜损害亦明显重于治疗组。
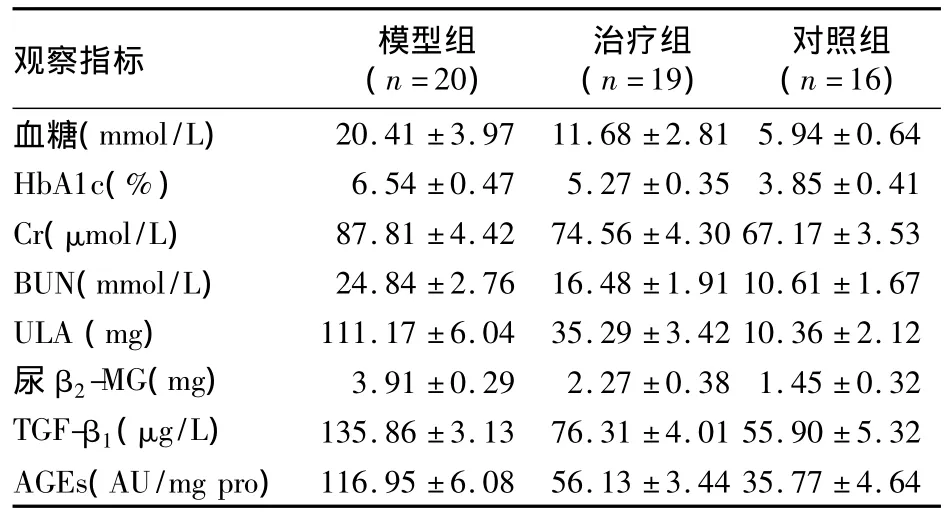
表1 各组观察指标检测结果(¯x±s)

表2 各组观察指标ANOVA分析

表3 模型组与治疗组观察指标的Post Hoc检验结果
2.3 肾组织TGF-β1表达 见图3。由图3可见,模型组肾小管间质损害明显重于治疗组。
2.4 肾组织RAGE表达 见图4。由图4可见,模型组肾小管间质表达明显重于治疗组。
2.5 肾组织VEGF表达 见图5。由图5可见,模型组肾小管间质表达明显重于治疗组。
3 讨论
肾脏小管间质包括肾小管上皮细胞、血管和间质成分,占肾脏体积的90%以上。病变初期表现为肾小管基底膜增厚、小管数目增加及小管肥大,后期发生肾小管萎缩及间质纤维化。肾间质纤维化是所有慢性肾脏疾病进行性发展的重要病理基础,比肾小球硬化更能反映肾脏受损伤的程度。

图1 肾脏病理变化(HE染色)

图2 肾脏病理变化(PAS染色)
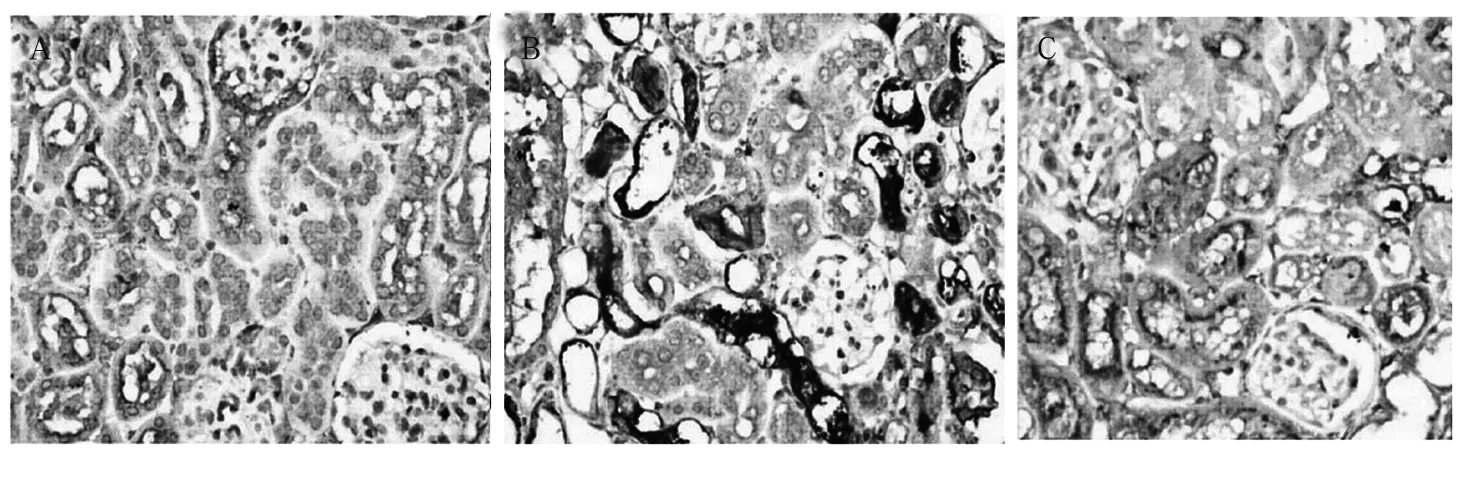
图3 肾组织TGF-β1表达(免疫组化法)

图4 肾组织RAGE表达(免疫组化法)

图5 肾组织VEGF表达(免疫荧光法)
本研究肾脏病理检查显示实验第12周大鼠糖尿病肾病造模成功。肾组织HE染色显示B、C组大鼠肾小球结构异常改变,特别是B组大鼠不仅肾小球结构异常更为明显,肾小管上皮细胞减少、炎症细胞浸润也更为严重。肾组织PAS染色显示,肾小球、肾小管结构性损害,基底膜破坏。特别是B组,病变明显较C组加重。实验数据显示,B组BG、HbA1c明显高于C组。反映肾功能和肾脏损害的指标Cr、BUN、ULA、β2-MG B组也明显高于C组。
AGEs与肾组织中的RAGE结合而激活第二信号系统,产生大量的细胞因子包括 TGF-α、PDGF、IL-1等,激活核转录因子NF-κB进而转录靶基因(如内皮缩血管肽、血管细胞黏附分子等),参与糖尿病血管并发症的发生与发展,对肾小球及小管间质造成不可逆转的损伤[10]。本研究结果显示,C组血AGEs水平低于B组,肾组织中RAGE表达亦明显低于B组。
VEGF通过改变肾小管上皮细胞结构与功能、增加上皮细胞通透性、促进细胞外基质(ECM)等作用参与糖尿病肾病进展[11,12]。糖尿病肾病早期时血清VEGF显著升高,血清VEGF与尿白蛋白排泄率之间呈明显正相关,在糖尿病肾病的发生、发展,尤其是尿蛋白的形成中起重要作用。本研究肾组织免疫荧光显示,B组肾小管以及间质VEGF表达明显高于C组。TGF-β1是一种强力致纤维化因子,其重要的作用是调节细胞外基质的形成,使肾细胞等合成胶原蛋白、纤维连接蛋白、蛋白多糖增加从而促进细胞肥大、细胞外基质增多,结果导致肾小球、小管间质硬化纤维化。氧化应激、VEGF、MCP-1等多种因素能促进TGF-β1合成和表达。本研究结果显示,C组血TGF-β1明显低于B组,TGF-β1在肾组织中表达也明显低于B组。
糖尿病肾病的发生与多种因素有关,氧化应激在糖尿病肾病的发生、发展过程中无疑起重要作用。已经证实,糖基化终产物是糖尿病肾病的主要发生因素之一[13],减少糖基化终产物能延缓糖尿病肾病的发生和发展[14]。EGCG可能是通过抗氧化应激、抗炎等作用减少大鼠氧化应激产物AGEs-RAGE及VEGF、MCP-1等炎性介质的产生并直接或间接影响TGF-β1的表达实现保护肾脏、延缓肾病进展。
[1]贾俊亚、林珊.糖尿病肾病患者血管钙化的临床病理特征及防治进展[J].中华内科杂志,2012,51(5):407-409.
[2]贾汝汉,高苹.糖尿病肾病肾小管间质病变研究进展[J].中国中西医结合肾病杂志,2005,6(6):311-313.
[3]Yao K,Ye PP,Zhang L,et al.Epigallocatechin gallate protects against oxidative stress-induced mitochondria-dependent apoptosis in human lens epithelial cells[J].Mol Vision,2008,14(1):217-223.
[4]Intra J,Kuo SM.Physiological levels of tea catechins increase cellular lipid antioxidant activity of vitamin C and vitamin E in human intestinal caco-2 cells[J].Chem Biol Interact,2007,169(2):91-99.
[5]Maet K,Nomura W,Takutsme Y,et al.Green Tea Polyphenols Function as Prooxidants To Activate Oxidative-Stress-Responsive Transcription Factors in Yeasts[J].App Envirn Microbiol,2007,73(2):572-580.
[6]郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-294.
[7]李莉,陈光亮,韩茹,等.多次低剂量链脲佐菌素诱导大鼠糖尿病模型的方法学研究[J].安徽医药,2012,16(7):888-890.
[8]张孝林,朱华庆.胰岛素对糖尿病模型大鼠肾脏病肌球蛋白轻链激酶表达的影响[J].中国药理学通报,2005,21(11):1407-1408.
[9]郑子新,宋瑞霞,邱继红,等.绿茶提取物的安全性分析评价[J].中国公共卫生,2005,21(5):583-584.
[10]陈永对.糖尿病肾病与糖基化终产物受体基因相关性的研究[J].中国中西医结合肾病杂志,2005,6(12):742-744.
[11]黄颂敏,陈泽君,杨亦彬,等.血管生成素及其受体血管内皮生长因子与糖尿病肾脏微血管病变的关系[J].中华肾脏病杂志,2006,22(9):521-527.
[12]毕春花,王艳.血管内皮生长因子和内抑素在STZ大鼠肾脏中的表达及意义[J].中国中西医结合肾病杂志,2008,9(4):335-339.
[13]Katerina K,Stejkalová A,Hertlova M,et al.Haplotype a nalysis of the RAGE gene:identification of a haplotype marker for diabetic nephropathy in type 2 diabetes mellitus[J].Nephrol Dial Transplant,2005,20(3):1093-1102.
[14]Sourris KC,Harcourt BE,Penfdd SA,et al.Modulation of the cellar expression of circulating advanced glycation end-product receptors in type 2 diabetic nephropathy[J].Experimental Diabetes Research,2010,2010(10):1-9.

