海洋胶原低聚肽的血管舒张和降胆固醇作用*
刘文颖,林峰,谷瑞增,鲁军,林单,蔡木易
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京,100015)
血管内皮细胞舒张功能损伤是动脉粥样硬化、血栓性疾病及高血压等的早期病变,以内皮细胞所分泌的一氧化氮(NO)减少而致血管舒张功能降低为其主要特征[1-2]。NO 是目前所知最强的内源性血管舒张因子,血管内皮细胞可通过释放NO 松弛血管平滑肌[3-4]。因此,通过提高NO 的分泌量,可以起到促进血管舒张的作用。体内过多的胆固醇会引起血脂偏高,进而诱发心脑血管疾病、老年痴呆症、胆结石等疾病[5-6]。低密度脂蛋白受体(LDLR)和3-羟基-3-甲基戊二酸单酰辅酶A 还原酶(HMGCR)是胆固醇合成及转运过程中的重要调控因子。通过提高LDLR 基因的表达、降低HMGCR 基因的表达,可以抑制胆固醇的合成[7-9]。治疗血管内皮细胞舒张功能损伤或高胆固醇症的药物虽然效果显著,但是长期服用具有一定的副作用。例如,临床治疗高胆固醇症的药物能够降低胆固醇的合成速率,达到降低血脂的目的,但也具有肝、肾功能损害等毒副作用[3]。因此,寻找天然安全、具有生理活性的物质已成为当今研发的一大热点。
海洋胶原低聚肽是以深海鲑鱼的鱼皮为主要原料,采用生物酶解方法生产的低聚肽混合物。本中心前期的研究结果表明,海洋胶原低聚肽具有较高的蛋白质含量(91.2%),分子质量大多为1 000 Da 以下(90.8%),主要集中在132 ~576 Da(69.3%)[10]。目前,对海洋胶原低聚肽的血管舒张和降胆固醇作用方面的研究尚未见报道。本实验以人脐静脉内皮细胞(HUVEC)和人肝癌细胞株HepG2 为模型,探讨海洋胶原低聚肽对HUVEC 细胞中NO 分泌量以及对HepG2 细胞内LDLR 及HMGCR 基因表达的影响,旨在阐明海洋胶原低聚肽的血管舒张活性和降胆固醇作用,为其开发和利用提供实验依据。
1 材料和方法
1.1 材料与仪器
1.1.1 材料
海洋胶原低聚肽(以深海鲑鱼的鱼皮为原料,采用生物酶解方法制得的小分子肽类物质),由北京中食海氏生物技术有限公司提供。
人脐静脉内皮细胞(HUVEC)、内皮细胞专用培养基,北京清源浩生物科技有限公司;人肝癌HepG2细胞,由北京师范大学细胞增殖与调控教育部重点实验室提供;DMEM 培养基,美国GIBCO 公司;胎牛血清,杭州四季青公司;总一氧化氮检测试剂盒,碧云天生物技术研究所;Trizol,美国Invitrogen 公司;反转录试剂盒,日本Takara 公司;Taq PCR StarMix 试剂盒,北京GenStar Biosolutions 公司。
1.1.2 仪器
CO2恒温培养箱,德国Heraeus 公司;CKX41 倒置相差显微镜,日本Olympus 公司;iMark 酶标仪,美国Bio-Rad 公司;SmartSpec plus 核酸蛋白测定仪、MyCycler PCR 扩增仪、Gel Doc XR 凝胶成像系统,美国BIO-RAD 公司。
1.2 方法
1.2.1 细胞培养
HUVEC 细胞培养于含2%胎牛血清的内皮细胞专用培养基中,HepG2 细胞培养于含10%胎牛血清的DMEM 培养基中,在37℃、5%CO2培养箱中静置培养。待细胞融合至培养皿的80%左右时,弃去培养液,用PBS 冲洗,加入适量0.25%胰蛋白酶消化,进行传代。取处于对数期、生长状态良好的细胞用于实验。
1.2.2 海洋胶原低聚肽溶液制备及实验分组
用PBS 溶液将海洋胶原低聚肽干粉配制成浓度为100 g/L 的母液,经0.22 μm 的微孔滤膜过滤后,放入-20℃冰箱中保存备用。用于血管舒张活性测定的细胞分组为:(1)对照组;(2)3g/L 海洋胶原低聚肽实验组;(3)6 g/L 海洋胶原低聚肽实验组;(4)9 g/L 海洋胶原低聚肽实验组;(5)12 g/L 海洋胶原低聚肽实验组。用于降胆固醇活性测定的细胞分组为:(1)对照组;(2)2 g/L 海洋胶原低聚肽实验组;(3)4 g/L 海洋胶原低聚肽实验组;(4)6 g/L 海洋胶原低聚肽实验组;(5)8 g/L 海洋胶原低聚肽实验组。
1.2.3 NO 含量的检测
将HUVEC 接种于96 孔板中,细胞浓度为2.5 ×104个/mL,每孔100 μL。待细胞融合后,吸除培养液,加入100 μL 无血清的内皮细胞专用培养基,培养4 h 后,用不同浓度的海洋胶原低聚肽培养液处理细胞,同时设不加低聚肽的对照孔,每组6 个平行。分别于0、1 和2h 吸取培养液,使用总一氧化氮检测试剂盒测定NO 含量。以KNO2为标准品,利用HUVEC细胞培养液将试剂盒中的10 mmol/L KNO2稀释成2、5、10、20、50 μmol/L,制作标准曲线,参照试剂盒说明书测定培养液中的NO 含量。
1.2.4 反转录-聚合酶链反应(RT-PCR)分析LDLR、HMGCR 基因表达的变化
1.2.4.1 引物设计
利用Primer Premier 5.0 软件设计PCR 引物,引物均由美国Invitrogen 公司合成。PCR 上下游引物见表1,以甘油醛-3-磷酸脱氢酶(GADPH)为内参基因。
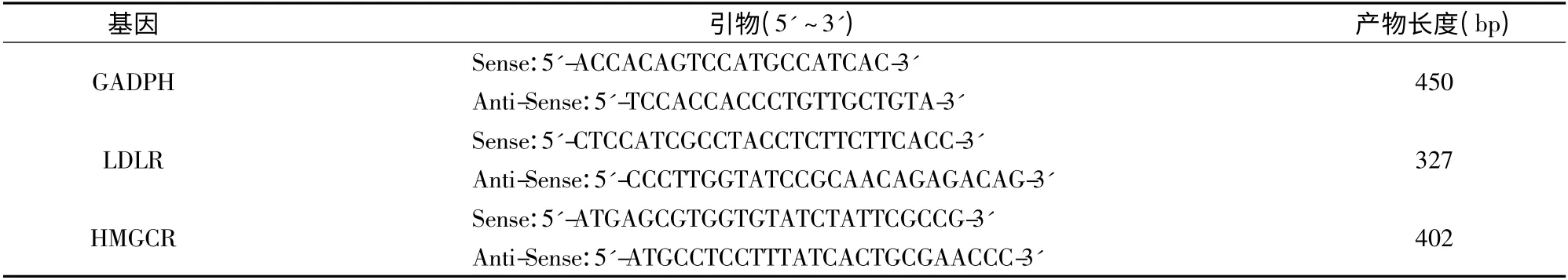
表1 PCR 引物Table 1 Primers used in PCR analysis
1.2.4.2 细胞总RNA 提取
将HepG2 细胞接种于6 孔板中,细胞浓度为约5 ×104个/mL,每孔3 mL。待细胞融合至60%后,吸除培养液,用PBS 冲洗,加入3 mL 不含血清的DMEM 培养基,用不同浓度的海洋胶原低聚肽培养液处理细胞,同时设不加低聚肽的对照孔,每组6 个平行。培养24h 后,用胰酶消化,3 000 g 离心2 min收集细胞,弃上清液。加入1 mL DEPC 水溶解,3 000 g 离心2 min,加入1 mL Trizol 裂解细胞,转移到1.5 mL 离心管中,充分裂解后,加入0.2 mL 氯仿,12 000 g 离心15 s,取上清液,加入0.5 mL 异丙醇,室温静置20 min 后,12 000g 离心10 min,弃上清液,缓慢加入1 mL 75%乙醇洗涤,7 500 g 离心5 min,弃上清液,空气风干后加入20 μL DEPC H2O 溶解。利用核酸蛋白测定仪测定RNA 的浓度,取0.5 μg RNA 溶液用于RT-PCR 反应,剩余RNA 溶液置于-80℃冰箱中保存。
1.2.4.3 cDNA 合成
20 μL 体系中含有5 × Prime Script® Butter 4 μL,Oligo dT Primer 1 μL,Random Primer 5 μL,dNTP Mixture 2 μL,RNase Inhibitor 0.5 μL,PrimeScript®RTase 2 μL,DEPC 水以及RNA 溶液共5.5 μL。反应条件:25℃,10 min;42℃,60 min;4℃,∞。按反转录试剂盒说明书进行cDNA 合成,合成好的cDNA 置于4℃冰箱中保存待测。
1.2.4.4 RT-PCR 分析
20 μL 体系中含有重蒸水7 μL、2 × Taq PCR StarMix 10 μL、PCR 上游引物和下游引物混合溶液2 μL、反转录产物1 μL,充分混匀。反应条件为94℃预变性5 min,94℃变性30s,退火温度53℃,30 s,72℃延伸30s 进行35 个循环,72℃延伸10 min 后4℃保存。取10 μL PCR 扩增产物进行琼脂糖凝胶电泳,在凝胶成像系统上进行分析,以目的基因条带与GADPH 条带密度比值表示相应基因mRNA 的相对表达水平,实验重复3 次。
1.2.5 统计学处理
实验数据用¯x±s 表示,采用SPSS 13.0 软件进行统计学分析,组间比较采用t 检验,P <0.05,两者有显著性差异;P <0.01,两者有极显著性差异。
2 结果与讨论
2.1 海洋胶原低聚肽的血管舒张作用
2.1.1 NO 检测的标准曲线
NO 是由血管内皮细胞产生的内皮衍生因子,是目前所知最强的内源性血管舒张因子,具有明显广泛的扩张血管作用,其生成减少或生物利用度的降低将导致血管阻力增加。血管舒张能力与产生NO 能力具有很强的相关性,一定量的NO 水平是重要的内源性细胞保护物质[1-4]。因此通过测定细胞培养液中NO 的浓度即可表征样品的血管舒张活性[11-12]。NO检测的标准曲线如图1 所示,标准品的吸光值随着浓度的增大而增大,成正比关系,拟合曲线为y =0.004x-0.009 3(R2=0.998 8)。
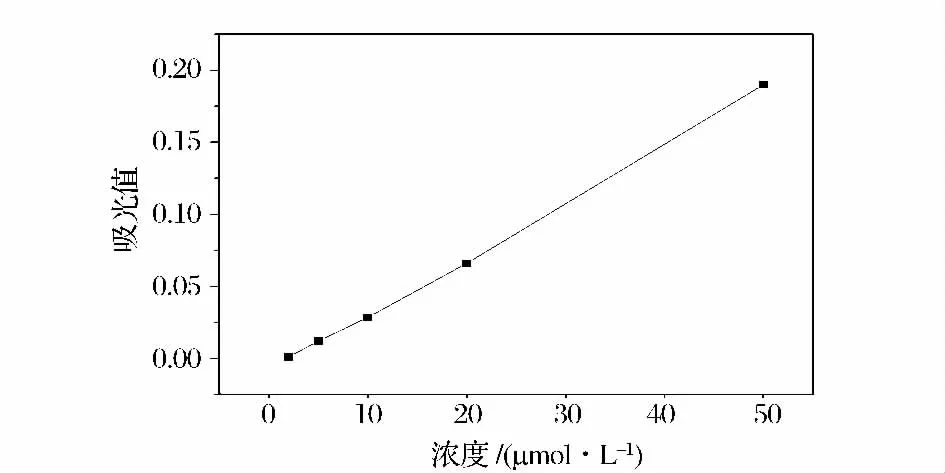
图1 NO 检测的标准曲线Fig.1 Standard curve of determination of NO
2.1.2 海洋胶原低聚肽对HUVEC 分泌NO 的影响
结果见图2。与对照组相比,各实验组细胞在海洋胶原低聚肽的作用下,NO 分泌量均有所增加,并且呈明显的量效关系。海洋胶原低聚肽浓度为6 g/L时,NO 分泌量显著性增加(P <0.05),浓度为9 g/L、12 g/L 时,NO 分泌量极显著性增加(P <0.01)。浓度为12 g/L 时,NO 含量增加最多。此外,由图2 可知,不同浓度海洋胶原低聚肽作用2 h 后,NO 分泌量均比作用1h 有所降低。本项研究结果表明,海洋胶原低聚肽能显著提高NO 含量,提示其具有调节血管舒缩功能、保护血管内皮细胞的作用。
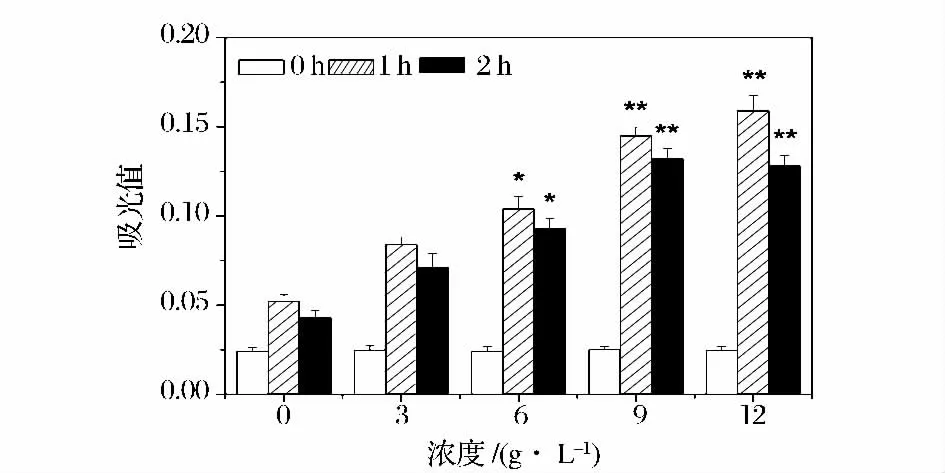
图2 不同浓度海洋胶原低聚肽作用下HUVEC 的NO分泌量,与对照组相比,* P <0.05,** P <0.01Fig.2 The secretion of NO in HUVEC treated by different concentration of MCOP. Compared with the control,* P <0.05,** P <0.01
Hirota 等[13]对2 种三肽VPP(Val-Pro-Pro)和IPP(Ile-Pro-Pro)的血管舒张作用进行了研究,结果表明2 种肽段在浓度为0.01 mmol/L 时,能显著促进NO 分泌,提高NO 含量。本研究中的海洋胶原低聚肽是小分子肽的混合物,经分离纯化后,可富集血管舒张活性高的肽段,明确对海洋胶原低聚肽的血管舒张活性起主要作用的肽段。
研究表明,肽的血管舒张活性与其ACE(血管紧张素转化酶)抑制活性有一定的相关性,肽可通过辅助血管舒缓激肽起到ACE 抑制作用,通过B2 受体促进血管内皮细胞中NO 的分泌,从而起到舒张血管的作用[13]。Hirota 等的研究中便对VPP 和IPP 的两种活性之间的相关性进行了探讨。本中心前期已对海洋胶原低聚肽的ACE 抑制活性进行了研究,证实了其具有较强的ACE 抑制活性(半抑制浓度IC50值=1.165 ±0.087 mg/mL)[10]。关于海洋胶原低聚肽的血管舒张活性的作用机制需要进一步的研究。
2.2 海洋胶原低聚肽的降胆固醇作用
低密度脂蛋白受体(LDLR)和3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGCR)是胆固醇合成及转运过程中的重要调控因子。LDLR 是一种跨膜糖蛋白,具有维持血浆胆固醇水平恒定的作用。LDLR 减少,会导致血浆中低密度脂蛋白(LDL)摄取减少,进而导致血浆中LDLR 水平升高,使血胆固醇水平升高[14-15]。HMGCR 是胆固醇合成的限速酶,是胆固醇代谢的最重要的酶之一,能够催化3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原生成甲羟戊酸,是整个胆固醇合成过程中的限速步骤[16]。因此,可通过增强LDLR 基因表达和降低HMGCR 基因表达,降低血胆固醇水平[17-18]。
本研究结果显示,对HepG2 细胞分别加入2、4、6、8 g/L 海洋胶原低聚肽培养24h 后,与对照组比较,除2 g/L 海洋胶原低聚肽组外,其他实验组的LDLR表达量均有上调(图3 和图4)。
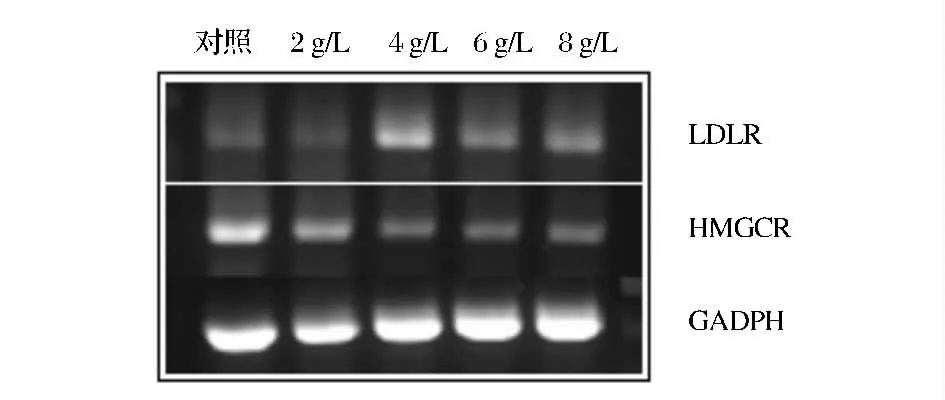
图3 海洋胶原低聚肽对HepG2 细胞LDLR、HMGCR mRNA 水平的影响Fig.3 The influence of MCOP on LDLR and HMGCR mRNA levels in HepG2 cells
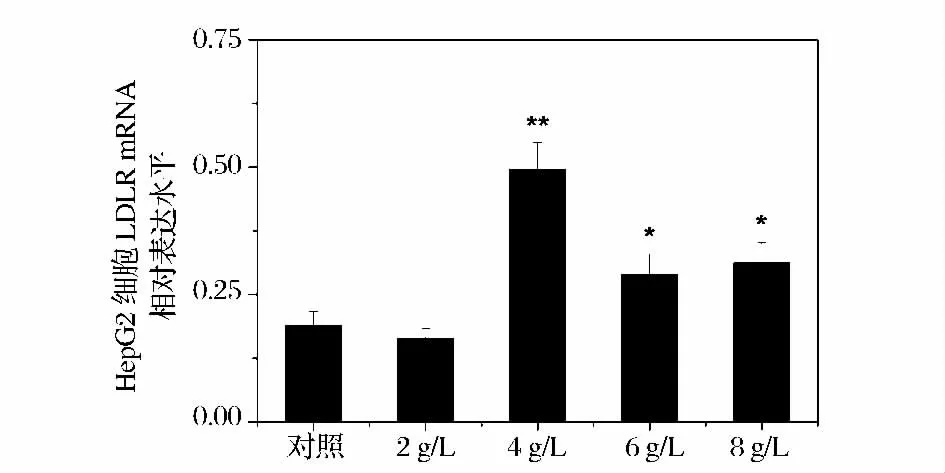
图4 海洋胶原低聚肽对HepG2 细胞LDLR mRNA相对表达水平的影响,与对照组相比,* P <0.05,** P <0.01Fig.4 The influence of MCOP on the relative expression level of LDLR mRNA in HepG2 cells. Compared with the control,* P <0.05,** P <0.01
4 g/L 海洋胶原低聚肽组的LDLR mRNA 表达增加最多,呈极显著性差异(P <0.01),是对照组的2.6倍。6 g/L、8 g/L 海洋胶原低聚肽组的LDLR mRNA表达显著性增加(P <0.05),分别是对照组的1.5、1.7 倍。各浓度海洋胶原低聚肽培养24 h 后,与对照组比较,HMGCR 的表达量均有下调,并有统计学差异(图3、图5)。2 g/L 海洋胶原低聚肽组的HMGCR mRNA 表达显著性降低(P <0.05),其余3 组的HMGCR mRNA 表达极显著性降低(P <0.01),其中6 g/L 海洋胶原低聚肽组的HMGCR mRNA 表达最低,大约降低了3/5。本研究结果表明,海洋胶原低聚肽能上调HepG2 细胞内LDLR mRNA 水平,下调HMGCR mRNA 水平,提示海洋胶原低聚肽可通过增强LDLR 的表达、抑制HMGCR 酶活性来降低细胞胆固醇合成。
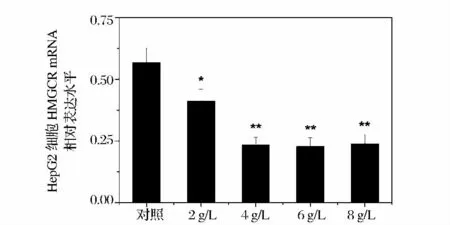
图5 海洋胶原低聚肽对HepG2 细胞HMGCR mRNA相对表达水平的影响,与对照组相比,* P <0.05,** P <0.01Fig.5 The influence of MCOP on the relative expression level of HMGCR mRNA in HepG2 cells. Compared with the control,* P <0.05,** P <0.01
近年的研究表明,LDLR 和HMGCR 的表达是通过固醇调节元件结合蛋白(SREBP)途径调节的。在此途径中,包括多个影响LDLR 和HMGCR 表达的因子和调控环节[19]。因此,海洋胶原低聚肽很可能通过SREBP 通路调控系统诱导LDLR 和HMGCR 基因表达,具体通过哪个因子、哪个环节进行调控,还有待进一步研究。
目前,关于肽类物质对胆固醇代谢影响的研究较少,现有的报道中大多是对植物提取物的相关研究,如Salleh 等[20]研究了多种从食用植物中提取的多酚物质对HepG2 细胞胆固醇代谢的影响,发现12 种多酚物质具有调节LDLR 表达的作用。本研究明确了海洋胶原低聚肽在调节胆固醇代谢方面的影响,为其开发利用提供了一定的理论依据。
3 结论
通过测定HUVEC 细胞培养液中NO 含量的变化,对海洋胶原低聚肽的血管舒张活性进行了研究。结果显示,各实验组细胞在海洋胶原低聚肽的作用下,NO 分泌量均有所增加,并且呈明显的量效关系。浓度为12 g/L 时,NO 含量增加最多。不同浓度海洋胶原低聚肽作用2 h 后,NO 分泌量均比作用1h 有所降低。结果表明,海洋胶原低聚肽能显著提高NO 含量,提示其具有调节血管舒缩功能、保护血管内皮细胞的作用。
通过观察HepG2 细胞中LDLR 和HMGCR 表达的变化,对海洋胶原低聚肽的降胆固醇作用进行了研究。结果显示,海洋胶原低聚肽培养24 h 后,除2 g/L 海洋胶原低聚肽组外,其他实验组的LDLR 表达量均有上调,其中4 g/L 海洋胶原低聚肽组的LDLR 表达量增加最多;各实验组HMGCR 的表达量均有下调,其中6 g/L 海洋胶原低聚肽组的HMGCR 表达量最低。结果表明,海洋胶原低聚肽能上调HepG2 细胞内LDLR mRNA 水平,下调HMGCR mRNA 水平,提示海洋胶原低聚肽具有降低细胞胆固醇合成的作用。
通过对海洋胶原低聚肽的血管舒张活性和降胆固醇活性的研究,为其开发利用提供了理论依据,但关于海洋胶原低聚肽中特征性活性肽段的进一步分离纯化、鉴定以及促进血管舒张和降胆固醇的作用机制还有待于进一步研究。
[1] 杨菊红,王楠,李京艳,等. 白藜芦醇对高脂处理人脐静脉内皮细胞SIRT1 表达、eNOS 活性及NO 分泌的影响[J]. 中国药房,2009,20(13):981 -983.
[2] Lüscher T F.Imbalance of endothelium-derived relaxing and contracting factors:A new concept in hypertension[J].Am J Hypertens,1990,3(4):317 -330.
[3] Huang P L,Huang Z,Mashimo H,et al. Hypertension in mice lacking the gene for endothelial nitric oxide synthase[J]. Nature,1995,377:239 -242.
[4] Vanhoutte P M. Endothelium and control of vascular function. state of the art lecture[J]. Hypertension,1989,13(6):658 -667.
[5] 贾连群,杨关林,罗莹,等. 化淤祛痰方及其拆方对HepG2 细胞胆固醇代谢的影响及其机制研究[J]. 中国实验方剂学杂志,2012,18(16):158 -162.
[6] 贾连群,杨关林,罗莹,等. 化淤祛痰方药含药血清对HepG2 细胞胆固醇代谢相关基因表达的影响[J]. 时珍国医国药,2012,23(1):127 -129.
[7] 吴琼,王世聪,马俊锋,等. 超高效液相色谱串联质谱联用法快速筛选3-羟基-3-甲基戊二酰辅酶A 还原酶抑制剂[J]. 化学分析,2013,41(7):1 013 -1 018.
[8] 汤世国,李伶,杨刚毅,等. 高脂诱导胰岛素抵抗apoE-/-小鼠HMGCR、SREBP-2 和LDLr 基因表达的变化[J]. 中国糖尿病杂志,2009,20(4):292 -294.
[9] 汪晓红,范竹萍,邱德凯,等. 脂肪变性肝细胞胆固醇代谢及合成相关基因的表达[J]. 上海交通大学学报,2007,27(9):1 111 -1 114.
[10] Gu R Z,Li C Y,Liu W Y,et al. Angiotensin I-converting enzyme inhibitory activity of low -molecular -weight peptides from Atlantic salmon (Salmo salar L. )skin[J].Food Res Int,2011,44(5):1 536 -1 540.
[11] Lekakis J,Papamicheal C,Stamatelopoulos K,et al. Hemochromatosis associatet with endothelial dysfunction:evidence for the role of iron stores in early atherogenesis[J]. Vasc Med,1999,4(3):147 -148.
[12] Heitzer T,Schlinzig T,Krohn K,et al.Endothelial dysfunction,oxidative stress,and risk of cardiovascular events in patients with coronary artery disease[J]. Circulation,2001,104:2 673 -2 678.
[13] Hirota T,Nonaka A,Matsushita A,et al.Milk casein-derived tripeptides,VPP and IPP induced NO production in cultured endothelial cells and endothelium-dependent relaxation of isolated aortic rings[J]. Heart Vessels,2011,26(5):549 -556.
[14] Benn M,Nordestgaard B G,Jensen J S,et al.Mutation in apolipoprotein B associated with hypobetalipoproteinemia despite decreased binding to the LDL receptor[J].J Biol Chem,2005,280(22):21 052 -21 060.
[15] Yu-Poth S,Yin D,Zhao G,et al.Conjugated linoleic acid upregulates LDL receptor gene expression in HepG2 cells[J].J Nutr,2004,134(1):68 -71.
[16] 汤世国,李伶,杨刚毅,等. 高脂诱导胰岛素抵抗apoE-/-小鼠HMGCR、SREBP-2 和LDLr 基因表达的变化[J]. 中国糖尿病杂志,2009,20(4):292 -294.
[17] 吴琼,王世聪,马俊锋,等. 超高效液相色谱串联质谱联用法快速筛选3-羟基-3-甲基戊二酰辅酶A 还原酶抑制剂[J]. 化学分析,2013,41(7):1 013 -1 018.
[18] 汪晓红,范竹萍,邱德凯,等. 脂肪变性肝细胞胆固醇代谢及合成相关基因的表达[J]. 上海交通大学学报,2007,27(9):1 111 -1 114.
[19] 窦晓兵,沃兴德,范春雷,等. 姜黄素对人肝细胞HepG2 中低密度脂蛋白受体基因表达影响的研究[J]. 中国药学杂志,2007,42(8):572 -575.
[20] Salleh M N. Inhibition of low-density lipoprotein oxidation and up-regulation of low-density lipoprotein receptor in HepG2 cells by tropical plant extracts[J].J Agric Food Chem,2002,50(13):3 693 -3 697.

