马兜铃酸Ⅰ-DNA加合物合成条件优选
刘 倩, 陈龙龙, 张祖艳, 李云华, 谢天培*
(1.上海沪丰生物科技有限公司,上海 200433;2.上海诗丹德生物技术有限公司,上海 201203)
马兜铃酸 (aristolochic acid)为硝基菲类化合物,主要存在于马兜铃属和细辛属植物中。这两属植物在中药中应用广泛。近年来,大量文献报道了马兜铃酸的肾毒性及致癌致突变作用,引起国内外学者的广泛重视[1-4]。但含马兜铃酸的中药近年来在某些地区临床上仍然大量使用[5-6]。研究发现,马兜铃酸-DNA加合物的形成是马兜铃酸致癌及致突变的重要原因[7-9],可能也参与了马兜铃酸肾病的发病过程[10]。Chen等[11]通过在台湾进行的以马兜铃酸-DNA加合物和TP53突变谱为生物标志物的分子流行病学调查认为马兜铃酸暴露是导致上尿路上皮癌发生的重要原因。马兜铃酸-DNA加合物现已被用作检测马兜铃酸中毒的生物标记物。马兜铃酸-DNA加合物对于深入研究马兜铃酸的致癌及致突变性具有重要作用。对于临床疾病的防治工作具有重要意义。
马兜铃酸-DNA加合物在体内含有量极微,体外制备反应产率低,纯化困难[12]。马兜铃酸-DNA加合物的检测方法有32P-后标记法及质谱法等。32P-后标记法步骤较繁琐,不能提供加合物结构信息,稳定性差,不同实验室检测结果差异很大。而液相色谱串联质谱法 (LC-MS)既能够检测加合物,还能提供结构信息,已被用于马兜铃酸-DNA加合物分析中[12-14]。Yun 等[15]指出 UPLC-ESI/MS 法是一种灵敏度高,特异性强,稳健的分析方法,可以替代现行的对人体组织中DNA加合物进行生物监测的32P后标记技术。马兜铃酸Ⅰ和马兜铃酸Ⅱ是马兜铃酸类化合物的主要毒性成分。本研究通过体外合成马兜铃酸Ⅰ-DNA加合物,优化反应条件,UPLC-ESI/MS法对马兜铃酸Ⅰ-DNA加合物进行分析研究。
1 仪器与试剂
1.1 仪器 Agilent 1290超高效液相-G6460三重串联四极杆质谱联用仪;涡旋振荡器 (Vortex-5,江苏海门其林贝尔仪器制造有限公司);恒温振荡培养箱 (HZQ-X100,太仓华美);离心机 (TGL-16C,上海安亭科学仪器厂);超声波清洗仪(KQ5200DB,昆山市超声仪器有限公司)。
1.2 试药 马兜铃酸Ⅰ (上海诗丹德生物技术有限公司,批号:191/120416);脱氧鸟苷 (dG)、脱氧腺苷 (dA)、磷酸二氢钾、磷酸氢二钾、N,N-二甲基甲酰胺、锌粉均购于美国 sigma公司;cleanert C18固相萃取柱;甲醇、乙酸为色谱纯;水为超纯水。
2 试验方法
2.1 马兜铃酸Ⅰ-DNA加合物的合成 取1 mg马兜铃酸Ⅰ,用50 μL N,N-二甲基甲酰胺 (DMF)溶解,超声促溶,加入1 mL质量浓度为1 mg/mL的脱氧鸟苷 (dG)/脱氧腺苷 (dA)磷酸钾缓冲液及10 mg锌粉,涡旋混匀,于37℃ 恒温振荡16 h[10],反应产物离心 (12 000g×10 min)以除去未反应的锌粉。其反应过程见图1。反应后上层清液过固相萃取柱,上样后以2 mL水淋洗 (弃去),1 mL甲醇洗脱,洗脱液过0.45 μm微孔滤膜,LCMS分析。两个反应均设两个阴性对照组,即分别不添加dG/dA,同法操作。
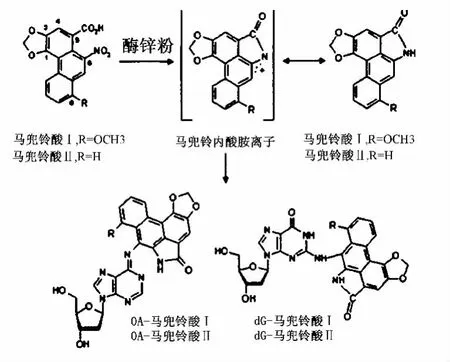
图1 马兜铃酸-DNA加合物生成过程Fig.1 Synthesis pathway of aristolochic acid-DNA adducts
2.2 不同pH值缓冲液对马兜铃酸Ⅰ-DNA加合物的影响
2.2.1 不同pH值磷酸钾缓冲液的配制 称取磷酸二氢钾,倒入烧杯中,加入超纯水溶解,移入量瓶中,定容至刻度,用50 mmol/L的磷酸氢二钾调整pH值分别为6.4、5.8、5.2,即可。
2.2.2 马兜铃酸Ⅰ-dA加合物合成 按2.1顶方法。
2.3 分析条件
2.3.1 色谱条件 Agilent Zorbax Extend C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相为0.2%乙酸-乙腈 (70∶30);体积流量0.4 mL/min;柱温30 ℃;进样量2 μL。
2.3.2 质谱条件 电喷雾离子源 (ESI),正离子扫描;根据需要分别采用全扫描、产物离子扫描及MRM检测方式 ([dG-马兜铃酸Ⅰ:(m/z)558.4→442.6。dA-马兜铃酸Ⅰ:(m/z)542.8→ 426.8];干燥气温度350℃;干燥气体积流量5 L/min;雾化器压力45psi(1psi=6.895 kPa);鞘气温度400℃;鞘气体积流量11 L/min。
2.4 正交试验 选择dG或dA摩尔浓度倍数(A)、加入锌粉量 (B)、时间 (C)为考察因素,每个因素设3个水平,以质谱MRM模式下dG-马兜铃酸Ⅰ/dA-马兜铃酸Ⅰ峰面积为指标,用L9(34)正交表安排试验。正交试验因素水平见表1。
2.5 马兜铃、青木香药材提取物与dG或dA反应及检测 马兜铃、青木香药材分别用甲醇提取3次,浓缩至干。按正交试验优选的方法将提取物与dG或dA反应,LC-MS检测。

表1 正交试验因素水平Tab.1 Factors and levels of orthogonal test
2.6 形成DNA加合物的最低马兜铃酸浓度检测将不同浓度的马兜铃酸按正交试验优选的方法与dG/dA反应,LC-MS检测,确定能够检测到加合物的最低马兜铃酸浓度。
3 结果
3.1 dG-马兜铃酸Ⅰ、dA-马兜铃酸Ⅰ的质谱行为在正离子模式下,马兜铃酸Ⅰ-dG、马兜铃酸Ⅰ-dA全扫描一级质谱的准分子离子分别为m/z558.9、542.8,与 [M+H]+吻合。阴性对照组中未检测到相应加合物。
在马兜铃酸Ⅰ与dA的反应体系中发现两个m/z为542.8的质谱峰,在0.2%乙酸-乙腈(70∶25)条件下,保留时间分别为0.977 min、3.448 min(马兜铃酸Ⅰ-dAI、马兜铃酸Ⅰ-dAⅡ)。对其进行二级质谱扫描,在10、20、30、40 ev的碰撞能量 (CE)下,其质谱行为相似 (结果见图2-a1、a2),推测马兜铃酸Ⅰ与dA反应生成了两种不同的加合物。二级质谱中m/z426.3的离子为[M+H]+离子从糖苷键处断裂失去脱氧核糖形成。当CE为40 ev时m/z291.4的碎片离子为马兜铃内酰胺Ⅰ与dA共价键连接处断裂后马兜铃内酰胺Ⅰ的碎片离子峰。其可能的碎裂方式见图3-a。

图2 dG-马兜铃酸Ⅰ、dA-马兜铃酸Ⅰ二级质谱图Fig.2 Product ion of dG-aristolochic acidⅠ,dA-aristolochic acidⅠ

图3 dG-马兜铃酸Ⅰ、dA-马兜铃酸Ⅰ二级质谱碎裂方式Fig.3 Fragmentation pattern of dG-aristolochic acidⅠand dA-aristolochic acidⅠ
对马兜铃酸Ⅰ与dG的反应体系中的m/z558.9准分子离子峰进行二级质谱扫描 (见图2-b),CE为20 ev时m/z442.6的碎片离子为 [M+H]+离子从糖苷键处断裂丢失脱氧核糖形成。CE为40 ev时m/z291.4的碎片离子为马兜铃内酰胺Ⅰ与dA共价键连接处断裂后马兜铃内酰胺Ⅰ的碎片离子峰。m/z397.7为准分子离子丢失脱氧核糖后丢失-NHCO-形成。m/z410.2为准分子离子丢失脱氧核糖后脱去马兜铃内酰胺Ⅰ上的甲氧基形成。其可能的碎裂方式见图3-b。
3.2 不同pH值缓冲液对马兜铃酸Ⅰ-DNA加合物的影响 质谱检测模式:MRM。结果见表2。
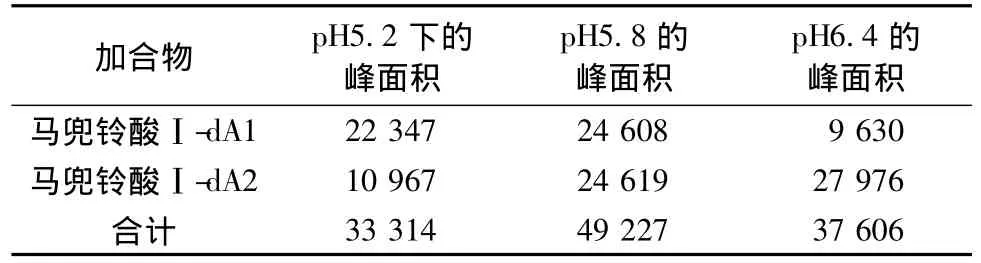
表2 不同pH值条件下马兜铃酸Ⅰ-dA1、马兜铃酸Ⅰ-dA2峰面积Tab.2 Aera of aristolochic acidⅠ-dA1,aristolochic acidⅠ-dA2 under different pH conditions
由表1可见,pH值不同,马兜铃酸Ⅰ-dA1、马兜铃酸Ⅰ-dA2的相对峰面积也发生变化。当pH为5.8时,两种加合物的峰面积之和最大,因此确定反应pH值为5.8。
3.3 正交试验设计及结果 见表3~6。对表3~4数据进行分析。直观分析表明,以马兜铃酸Ⅰ-dG峰面积为指标,最佳条件为A3B1C3,极差分析表明,各因素的影响从大到小依次为为A、C、B。方差分析表明,三个因素对结果均无显著性影响,综合上述分析及经济成本,确定方案A3B1C3为最佳条件,即用相当于马兜铃酸Ⅰ3倍量的脱氧鸟苷,10倍锌粉,反应时间为24 h。

表3 马兜铃酸Ⅰ与脱氧鸟苷加合L9(34)正交试验设计与结果Tab.3 Aristolochic acidⅠ-dG L9(34)design and results of orthogonal test
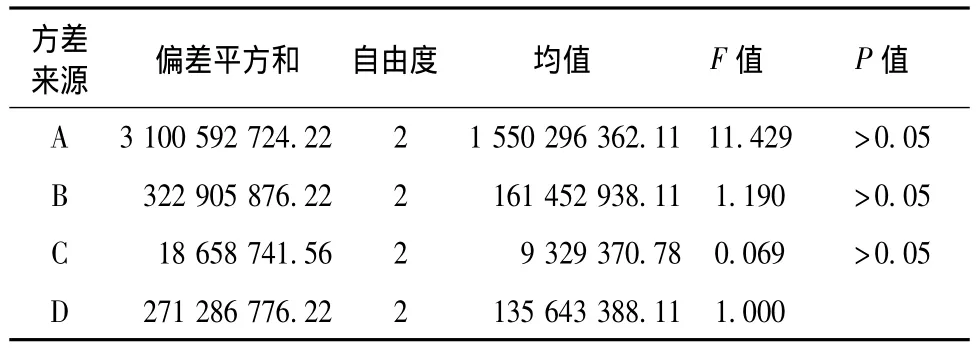
表4 马兜铃酸Ⅰ-脱氧鸟苷峰面积方差分析Tab.4 Aera variance analysis of aristolochic acidⅠ-dG

表5 马兜铃酸Ⅰ与脱氧腺苷加合L9(34)正交试验设计与结果Tab.5 Aristolochic acidⅠ-dA L9(34)design and results of orthogonal test

表6 马兜铃酸Ⅰ-脱氧腺苷峰面积之和的方差分析Tab.6 Aera variance analysis of aristolochic acidⅠ-dA
对表5~6数据进行分析。直观分析表明,以马兜铃酸Ⅰ-dA峰面积之和为指标,最佳条件为A3B2C1,极差分析表明,各因素的影响从大到小依次为为A、C、B。方差分析表明,A因素即脱氧腺苷的加入量对结果有显著性影响,因此确定方案A3B2C1为最佳条件,即用相当于马兜铃酸Ⅰ3倍量的脱氧腺苷,20倍锌粉,反应时间为16 h。
3.4 马兜铃、青木香药材提取物加合物检测 在马兜铃、青木香药材提取物与dG/dA的反应体系中分别检测到马兜铃酸Ⅰ-dG及马兜铃酸Ⅰ-dA加合物。另外还分别检测到m/z528.6、512.4的离子。对其进行产物离子扫描。结果见图4。其质谱行为与文献 [10-11]相似,推测分别为马兜铃酸Ⅱ-dG及马兜铃酸Ⅱ-dA。
3.5 最低马兜铃酸质量浓度检测 能够检测到马兜铃酸Ⅰ-dA加合物的参加反应的马兜铃酸最低质量浓度为40 μg/mL,能够检测到马兜铃酸Ⅰ-dG,加合物的参加反应的马兜铃酸最低质量浓度为300 μg/mL。
4 讨论
在马兜铃酸Ⅰ与dA的反应体系中发现两个m/z为542.8的质谱峰,质谱行为相同,保留时间不同,推测马兜铃酸Ⅰ与dA、锌粉反应生成两种加合物。目前未见相关文献报道。
用不同pH值缓冲液配制dA、dG对马兜铃酸Ⅰ-dA加合物生成情况有比较明显的影响。而且pH值不同,生成的马兜铃酸Ⅰ-dA1、马兜铃酸Ⅰ-dA2的相对量也不同。其原因尚待进一步分析。
在反应体系中检测到m/z为294.0、309.9的离子。m/z294.0离子的产物离子为m/z279.0、251.0、221.0,m/z309.9离子的产物离子为m/z294.6、238.9、210.8,推测分别为反应的两个副产物:马兜铃内酰胺Ⅰ及7-羟基马兜铃内酰胺I的准分子离子。
马兜铃酸Ⅰ、Ⅱ要先被酶或锌粉还原成马兜铃内酰胺鎓离子才能与dG或dA反应形成加合物。正交试验选择了可能影响反应的3个主要因素即dG或dA浓度、加入锌粉量、时间为考察因素,据此来优选反应条件。
在正交试验中曾以马兜铃酸Ⅰ-dG或dA与主要副产物—马兜铃内酰胺Ⅰ峰面积 (MRM模式)之比为指标进行考察,其结果与单纯用马兜铃酸Ⅰ-dG或dA峰面积相比趋势相同。
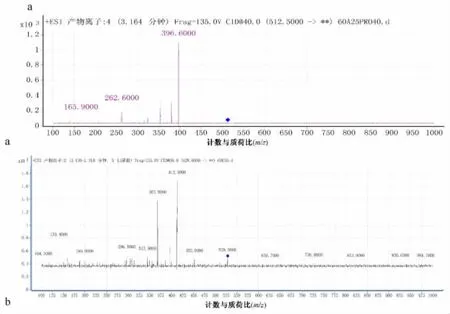
图4 马兜铃酸Ⅱ-dG、马兜铃酸Ⅱ-dA的产物离子扫描图Fig.4 Product ion of aristolochic acidⅡ-dG,aristolochic acidⅡ-dA
能够检测到马兜铃酸Ⅰ-dA加合物的参加反应的马兜铃酸最低质量浓度比能够检测到马兜铃酸Ⅰ-dG加合物的参加反应的马兜铃酸最低质量浓度低很多,说明前者反应体系更易生成加合物。
按照优选的条件将马兜铃、青木香药材提取物与dG或dA加合,能够检测到马兜铃酸Ⅰ-dA1、马兜铃酸Ⅰ-dA2、马兜铃酸Ⅰ-dG、马兜铃酸Ⅱ-dA、马兜铃酸Ⅱ-dG等加合物。目前未见相关报道。马兜铃酸-DNA加合物的合成及纯化将在以后的工作中继续进行。
[1]姜廷良.关于马兜铃属某些植物和马兜铃酸的致癌性问题[J].中国中医药信息杂志,2002,9(7):73-75.
[2]Cosyns J P.Aristolochic acid and‘Chinese herbs nephropathy’:a review of the evidence to date[J].Drug Saf,2003,26(1):33-48.
[3]Arlt V M,Stiborova M,Schmeiser H H.Aristolochic acid as a probable human cancer hazard in herbal remedies:a review[J].Mutagenesis,2002 ,17(4):265-277.
[4]Frédéric D,Debelle Joëlle L Nortier,et al.Aristolochic acids induce chronic renal failure with interstitial fibrosis in salt-depleted rats[J].J Am Soc Nephrol,2002,13(2):431-436.
[5]陈文革.含马兜铃酸的中药临床应用状况分析[J].中国医药指南,2011,9(31):183-184.
[6]李玉霞,师金芳.含马兜铃酸的中药临床应用状况分析[J].中国中西医结合儿科学,2009,1(6):562-564.
[7]Meinl W,Pabel U,Osterloh-Quiroz M,et al.Human sulphotransferases are involved in the activation of aristolochic acids and are expressed in renal target tissue [J].Int J Cancer,2006,118(5):1090-1097.
[8]Arlt V M,Alunni-Perret V,Quatrehomme G,et al.Aristolochic acid(AA)-DNA adduct as marker of AA exposure and risk factor for AA nephropathy-associated cancer[J].Int J Cancer,2004,111(6):977-980.
[9]Stiborova M,Sopkoa B,Hodeka P,et al.The binding of aristolochic acid I to the active site ofhuman cytochromes P450 1A1 and 1A2 explains their potential to reductively activate this human carcinogen[J].Cancer Lett,2005,229(2):193-204.
[10]Lebeau C,Debelle F D,Arlt V M,et al.Early proximal tubule injury in experimental aristolochic acid nephropathy:functional and histological studies[J].Nephrol Dial Transplant,2005,20(11):2321-2332.
[11]Chen C H,Dickman K G,Moriya M,et al.Aristolochic acidassociated urothelial cancer in Taiwan[J].Proc Natl Acad Sci USA,2012,109(21):8241-8246.
[12]季文萱,杨成对,刘密新.马兜铃酸-脱氧核糖核酸加合物的质谱分析[J].分析化学研究报告,2008,36(7):930-934.
[13]高海燕.马兜铃酸与DNA相互作用的研究[D].广州:中南大学,2009.
[14]Chan Wan,Zheng Yufang,Cai Zongwei.Liquid chromatography-tandem mass spectrometry analysis of the DNA adducts of aristolochic acids[J].J Am Soc Mass Spectrom,2007,18(4):642-650.
[15]Yun B H,Rosenquist T A,Sidorenko V,et al.Biomonitoring of aristolactam-DNA adducts in human tissues using ultra-performanceliquid chromatography/ion-trap massspectrometry[J].Chem Res Toxicol,2012,25(5):1119-1131.doi:10.1021/tx3000889.

