紫芝胞外多糖分离纯化及抗氧化性的研究
戚跃明,陈 涛
(安徽工程大学生物与化学工程学院,安徽芜湖241000)
紫芝是我国中药学上的著名药用真菌[1]。在《中华人民共和国药典》中规定:紫芝(Ganoderma Sinense)和赤芝(Ganodema lucidum)为灵芝正品[2]。紫芝通常含有多种有效生物化学成分,如三萜类化合物、甾体、生物碱、多糖等[3]。据报道:紫芝或灵芝类多糖中的有效成分具有抗氧化、免疫调节和抗癌等功效[4-6]。机体新陈代谢或外部条件刺激下机体会产生大量超氧化物阴离子、羟基自由基、过氧化氢(H2O2)和活性氧化物(ROS)。这些物质的积累会导致许多相关疾病,如哮喘、风湿性关节炎、心血管疾病和癌症等[7]。紫芝和灵芝类多糖的抗氧化活性已经被大量研究证实,但以往大量的研究都集中在子实体中多糖的研究,对其液体发酵产物中的多糖研究较少。该研究在研究紫芝深层发酵的基础上,对发酵上清液中胞外多糖组分进行了分离纯化,并对其抗氧化活性作了初步的研究,为寻找一种天然且具较强抗氧化活性的物质,预防人体内因自由基过度积累导致的各种疾病,以及紫芝多糖的综合开发提供了一定的借鉴。
1 材料与方法
1.1 材料与仪器
紫芝(Ganoderma Sinense)菌 微生物发酵安徽省工程技术研究中心筛选保存;葡聚糖标准品 日和光公司;DEAE-52、1,1-二苯基苦基苯肼(DPPH)中国医药集团上海化学试剂公司;无水乙醇、丙酮、氯仿、正丁醇、三氟乙酸、过氧化氢、Tirs试剂、盐酸等 国药集团化学试剂有限公司。
BSZ-100自动部分收集器 上海琪特分析仪器有限公司;BHL-B恒流泵 上海青浦沪西仪器厂;HD-5紫外检测仪 上海沪西分析仪器厂;722光栅分光光度计 无锡科达智能仪器厂;雷磁PHS-25 pH计、微量分析天平 上海精密科学仪器有限公司;Sunrise酶标仪 奥地利Tecan公司。
1.2 实验方法
1.2.1 紫芝胞外多糖的制备[8]发酵物3500r/min离心去除菌体,发酵液浓缩后用4倍体积酒精沉淀,4℃静置24h,最后离心、冷冻干燥得到粗多糖,作为实验样品。
1.2.2 脱蛋白 本实验比较了Sevage法、聚酰胺法和活性炭法对紫芝多糖提取的影响。Sevage法[9]:2%粗多糖溶液(20mL)以体积比1∶4加入Svegae试剂(氯仿∶正丁醇=5∶1),混合振荡30min,静止20min,除去水层与溶剂层交界处的变性蛋白质,在水层取样测定蛋白质含量及多糖含量。
聚酰胺(PA)法[10]:2%粗多糖溶液20mL,分别加入0.5、1.0、1.5、2.0、2.5g聚酰胺粉,搅匀,室温摇床振荡3h后抽滤,分别测定滤液中蛋白质含量及多糖含量。
活性炭(Active Carbon)法[10]:2%粗多糖溶液20mL,分别加入0.5、1.0、1.5、2.0、2.5g的活性炭粉,搅匀,室温摇床振荡3h后抽滤,分别测定滤液蛋白质含量及多糖含量。
1.2.3 测定方法
1.2.3.1 多糖含量测定 多糖=总糖-还原糖,多糖损失率为多糖溶液经工艺处理后多糖的变化量与原溶液中多糖含量的比值;测定总糖采用苯酚-硫酸法[11],测定还原糖采用DNS光度法[12]。
1.2.3.2 蛋白测定方法 测定蛋白含量采用考马斯亮蓝G-250法[13];蛋白去除率为粗糖溶液脱蛋白处理后蛋白的变化量与原溶液中蛋白含量的比值。
1.2.4 DEAE-52离子交换色谱柱分级[14]将脱蛋白后冷冻干燥的粗多糖样品100mg溶于3mL Tirs-HCl(pH6.5 50mmol/L)缓冲液后,利用DEAE-52离子交换柱(2.6cm×40cm),以Tirs-HCl(pH6.5 50mmol/L)为缓冲体系,Tirs-HCl缓冲液、0.1mol/L NaCl、0.2mol/L NaCl、0.3mol/L NaCl进行梯度洗脱,其中NaCl均用Tirs-HCl(pH6.5 50mmol/L)缓冲液配制。自动部分收集器收集洗脱液,流速为1mL/min、5mL/管,以苯酚硫酸法跟踪检测每管洗脱液A490值,以A490对洗脱管数做洗脱曲线图。
1.2.5 紫外光谱分析[15]取紫芝多糖GSP1、GSP2、GSP3,用双重蒸馏水配成质量浓度为1mg/mL的多糖溶液,以双重蒸馏水作为对照,置于紫外—可见分光光度计下,在200~550nm波长下进行紫外扫描。
1.2.6 多糖抗氧化性的研究
1.2.6.1 清除DPPH自由基能力的测定 以对DPPH自由基的清除能力[16]来衡量紫芝多糖的抗氧化能力。反应体系为100μL多糖溶液,100μL现用现配制的0.2mg/mL DPPH乙醇溶液和100μL 95%乙醇充分混匀,黑暗反应30min,用酶标仪于波长517nm处测定吸光度。空白组用100μL 95%乙醇代替DPPH溶液,对照组为100μL DPPH溶液与200μL 95%乙醇混合。反应体系吸光度越低,说明清除DPPH自由基的能力越强,DPPH自由基清除率的计算公式为:
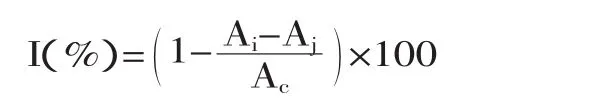
式中,I表示DPPH·清除率;Ai表示样品组吸光度;Aj为空白组吸光度;Ac为对照组吸光度。
1.2.6.2 清除·OH能力的测定 ·OH的清除率的测定用Fenton法(Fe2++H2O2→Fe3++OH-+·OH)[17]:反应体系(3mL)包括1mL 1.5mmol/L的FeSO4,0.7mL 6mmol/L H2O2,0.3mmol/L 20mmol/L水杨酸钠和样品(0~10mg/mL),37℃孵育1h,562nm下测定吸光度确定羟基含量。用VC替换样品作为对照组,自由基去除率可用以下公式计算:
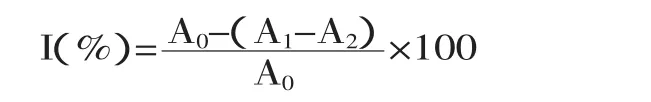
式中,I表示·OH清除率;A0为对照组吸光度;A1为样品组吸光度;A2为空白组吸光度(不加反应液)。
1.2.6.3 清除过氧化氢能力的测定 过氧化氢清除率的测定方法[18]为:混合H2O2(1.0mL,0.1mmol/L)和不同浓度浓缩后的样品,再添加100μL 3%的钼酸铵,10mL H2SO4(2mol/L)和7.0mL KI(1.8mol/L),用Na2S2O3硫代硫酸钠(5mmol/L)滴定混合物至黄色消失。过氧化氢清除率计算公式如下:
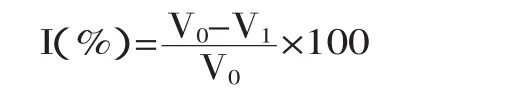
式中,I表示过氧化氢清除率;V0为Na2S2O3滴定不添加样品的混合物后的消耗量;V1为Na2S2O3添加样品后的滴定量。
1.2.6.4 清除超氧化物阴离子自由基能力的测定[18]超氧自由基在PMS-NADH系统中引发,PMS-NADH体系包括10mol/L PMS,100μmol/L NADH和600μmol/L NBT(由pH7.8的0.1mol/L PBS配制)。560nm下混合体系室温孵育5min后作为空白组,在添加PMS之前加入不同浓度的样品,对照组中用Tirs-HCl缓冲液代替样品。抗超氧化物阴离子自由基能力由以下公式计算得出:
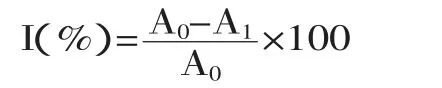
式中,I表示超氧阴离子清除率;A0为空白对照组吸光度;A1为样品组吸光度。
2 结果与分析
2.1 发酵液多糖得率
通过方法1.2.3.1和1.2.1确定发酵液中粗多糖含量为3.03g/L,醇沉后冷冻干燥后得到粗多糖含量为2.89g/L,醇沉的得率为95.4%。
2.2 三种试剂的脱蛋白效果
2.2.1 Sevag法脱蛋白测定结果 由图1可知,Sevag脱蛋白随着处理次数的增加,蛋白的去除率逐渐增加,当处理5次以上时蛋白去除率基本保持在76.3%左右,而处理2次以上时多糖损失率基本保持在28.9%左右。由此得较佳的处理次数为5次。
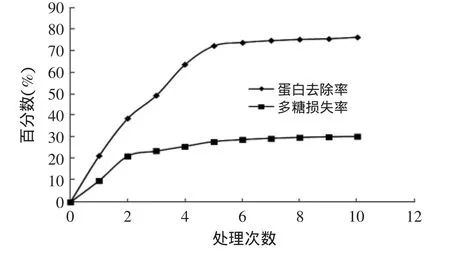
图1 Sevag法脱蛋白结果Fig.1 Result of removing protein by sevag method
2.2.2 活性炭脱蛋白法测定结果 由图2可知,活性炭的最佳添加量为0.5g,蛋白去除率可达到70.3%,随着活性炭添加量的增加,蛋白去除率增加非常缓慢,而多糖损失率却陡然增加。说明此法对多糖的最终得率影响比较大。
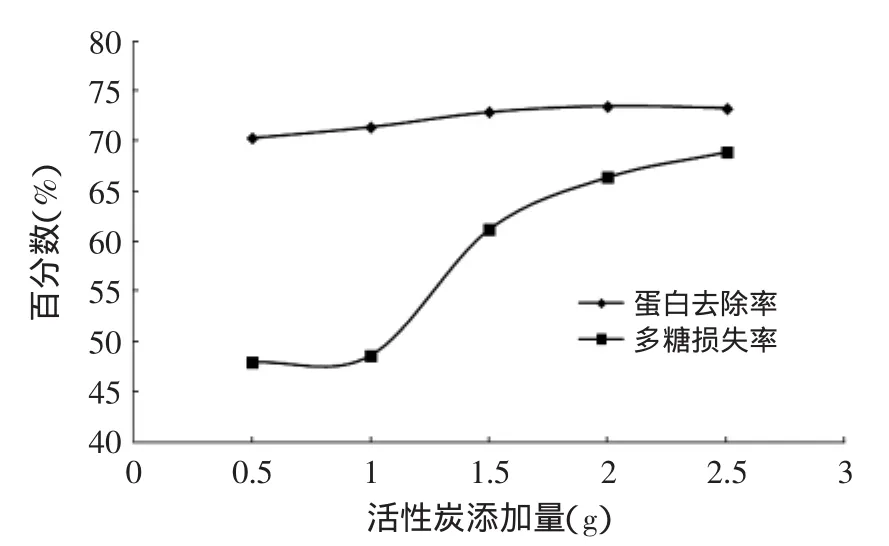
图2 活性炭脱蛋白的结果Fig.2 Result of removing protein by active carbon method
2.2.3 聚酰胺(PA)脱蛋白法测定结果 由图3可知,聚酰胺相对于前两者的脱蛋白的效果更佳,在添加量达到1.5g时,蛋白去除率已达到86.3%,而多糖的损失率仅为25.6%。而后随着聚酰胺的添加量的增加,蛋白去除率增加缓慢,基本维持不变,而多糖损失率却呈缓慢增加趋势。因此采用聚酰胺法脱蛋白较为合理。
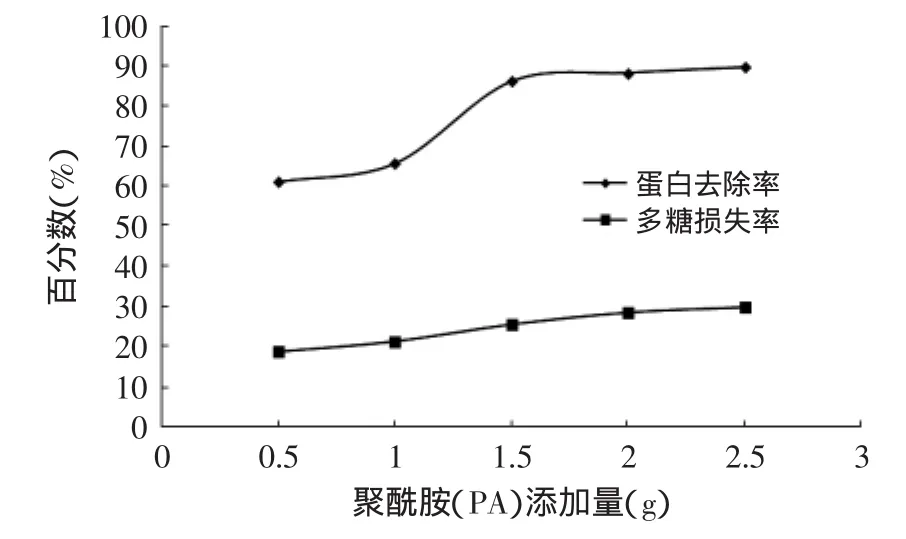
图3 聚酰胺(PA)脱蛋白的结果Fig.3 Result of removing protein by polyamide method
2.3 紫芝胞外多糖的分离纯化结果
紫芝胞外粗多糖通过去除杂质、复溶,DEAE-52离子交换柱层析,缓冲液和含0.1、0.2mol/L NaCl的缓冲溶液阶段洗脱,分别得到三个多糖组分GSP1、GSP2、GSP3(见图4)。
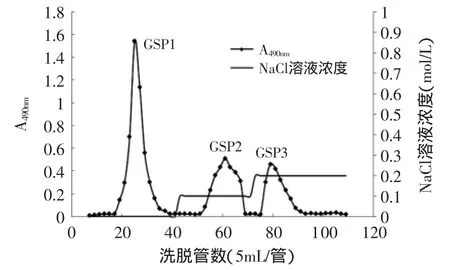
图4 紫芝胞外多糖DEAE-52层析柱洗脱曲线Fig.4 Result of anion-exchange elution curve showinng the separation of GSP1,GSP2,GSP3 on DEAE-52
图4表明紫芝胞外多糖洗脱曲线含有三个洗脱峰(由于洗脱液NaCl浓度达到0.3mol/L后就无明显特征洗脱峰出现,所以图4中省略了该部分洗脱曲线图),根据其洗脱曲线图可以计算出GSP1、GSP2、GSP3的分别占总糖的67.7%、18.1%、14.1%。
2.4 紫外全波长扫描结果
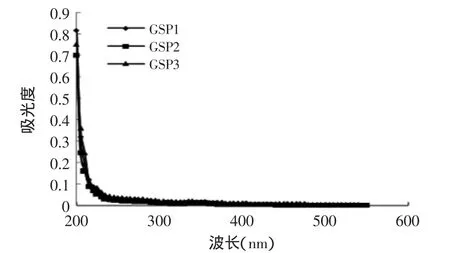
图5 三种多糖GSP1、GSP2、GSP3全波长扫描结果Fig.5 Result of absorption spectrum of GSP1,GSP2 and GSP3
由图5可知,多糖GSP1、GSP2、GSP3样品在260~280nm处均无吸收峰,确定样品不含蛋白质。三种多糖在517、562nm等波长附近吸光度接近零,因此对多糖抗氧化性的测定不形成干扰。
2.5 多糖抗氧化性结果
2.5.1 清除DPPH自由基能力的测定结果 图6表明紫芝发酵液中分离得到的三种多糖均具有清除DPPH自由基的能力,其中GSP2的清除效果最佳,当样品中含量达到1.6mg/mL时,DPPH自由基清除率达到了76.3%,且呈现一定的量效关系;而GSP1和GSP3的DPPH自由基去除能力相对较弱。该多糖对DPPH自由基有清除能力可能是由于多糖中的羟基具有供氢质体能力的结果。
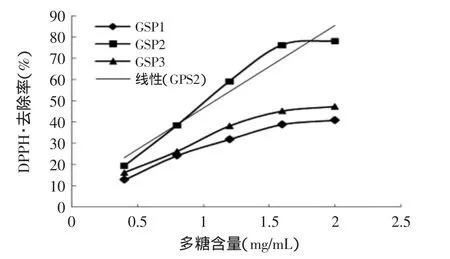
图6 清除DPPH自由基能力测定结果Fig.6 DPPH radical-scavenging activity of GSP1,GSP2 and GSP3
2.5.2 清除·OH能力的测定结果 羟自由基清除能力是抗氧化剂抗氧化活性的指标之一。图7表明三种多糖均具有清除·OH的能力,其中当GSP2的量达到5mg/mL以上时,·OH清除率达到了81.5%以上,此时GSP3的羟基自由基清除率也达到了39.46%。GSP1的·OH清除率较前两者显弱。
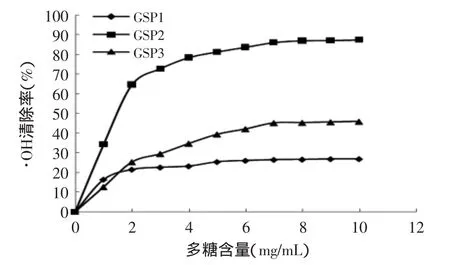
图7 清除·OH能力测定结果Fig.7 Hydroxyl radical scavenging activities of GSP1,GSP2 and GSP3
2.5.3 清除过氧化氢能力的测定结果 由图8得到,紫芝多糖GSP2的过氧化氢清除率明显高于GSP1和GSP3,当含量达到10mg/mL时,GSP2的过氧化氢清除率达到了48.12%,此时GSP1和GSP3的过氧化氢清除率分别是20.77%、26.81%。
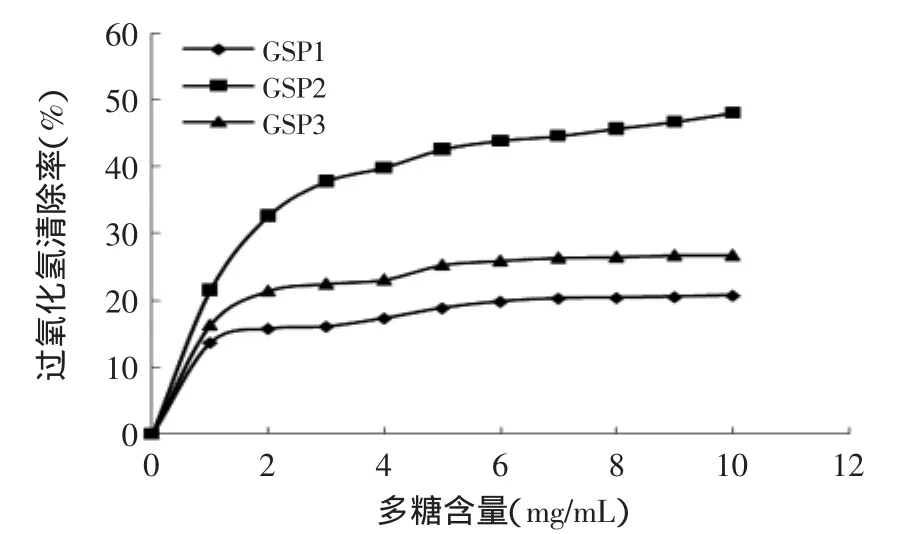
图8 清除过氧化氢能力测定结果Fig.8 The hydrogen peroxide scavenging activities of GSP1,GSP2 and GSP3
2.5.4 清除超氧化物阴离子自由基能力的测定结果图9表明紫芝胞外多糖GSP2具有较强的抗超氧化物阴离子自由基的能力,当含量为9mg/mL时,其超氧化物阴离子自由基的清除率为47.4%;该浓度下GSP1的超氧化物阴离子自由基的清除率仅为3.29%,GSP3的超氧化物阴离子自由基的清除率为21.7%。GSP2可能具有一定数量的羟基或酚式羟基,它会通过增加自身电子云密度来夺取超氧化物的电子,然后该羟基转向多糖分子内,从而达到抗超氧化物阴离子的作用;而GSP1和GSP3可能是具有较强的分子内或分子间氢键使其抗超氧化物阴离子的能力减弱或消失。
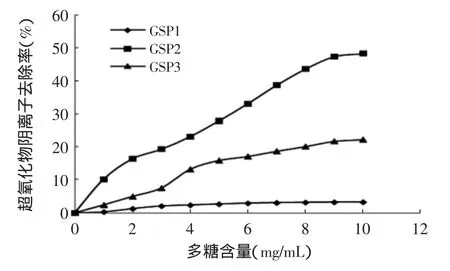
图9 清除超氧化物阴离子基能力测定结果Fig.9 Superoxide anion radicalscavenging activities of GSP1,GSP2 and GSP3
3 结论
通过聚酰胺法脱蛋白后的紫芝胞外粗多糖,经DEAE-52阴离子色谱柱梯度洗脱得到三种胞外多糖组分,经体外抗氧化性实验研究确定GSP2为主要功效成分,GSP2表现出很强的抗氧化和去除自由基等能力,明显强于其他两种组分。紫芝胞外抗氧化活性多糖GSP2的确定深化了紫芝胞外抗氧化活性物质的探索,也为未来充分利用自然资源提供了一种方法。后续的研究应该对紫芝胞外多糖GSP2的体内抗氧化活性进行研究深化,为寻找真正适合于人体的抗氧化活性物质奠定理论基础,从而能够更好地挖掘著名传统中药紫芝的药用功效。
[1]SHIAO M S.Natural products of the medicinal fungus Ganoderma lucidum: Occurrence, biological activities, and pharmacological functions[J].Chem Record,2003,3(3):172-180.
[2]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2000:13.
[3]RUSSELL R,PATERSON M.Ganoderma:a therapeutic fungal biofactory[J].Phytochemistry,2006,67(18):1985-2001.
[4]CHEN X P,CHEN Y,LI S B,et al.Free radical scavenging of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats[J].Carbohydrate Polymers,2009,77(2):389-393.
[5]JIA J, ZHANG X, HU Y S, et al.Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats[J].Food Chem,2009,115(1):32-36.
[6]XU J,LIU W,YAO W B,et al.Carboxymethylation of a polysaccharide extracted from Ganoderma lucidum enhances its antioxidant activities in vitro[J].Carbohydrate Polymers,2009,78(2):227-234.
[7]QI H M,ZHANG Q B,ZHAO T T,et al.Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa(Chlorophyta)in vitro[J].International Journal of Biological Macromolecules,2005,37(4):195-199.
[8]苗敬芝,吕兆启.灵芝深层液体发酵多糖的提取与测定[J].食品科学,2003,2(2):13-14.
[9]张潇艳,陈正行,王莉.米糠多糖的脱蛋白研究[J].食品工业科技,2008,29(3):163-165.
[10]王周,黄生权,宁正祥.灵芝水溶性粗多糖脱蛋白方法研究[J].食品科学,2010,35(8):222-225.
[11]张惟杰.糖复合物生化研究技术[M].第二版.杭州:杭州浙江大学出版社,1994:11-12.
[12]杨贵明,蒋爱华,薛秋生.用DNS光度法测定还原糖的条件研究[J].安徽农业科学,2006,34(14):3258-3264.
[13]陈毓荃.生物化学实验方法和技术[M].北京:北京科学出版社,2002:95-97.
[14]CHEN X G,LIU Y H.Hypoglycemic Polysaccharides from the Tuberous Root of Liriope spicata[J].Journal of Natural Products,2009,72(11):1988-1992.
[15]林萍,杨红澎,黄亮.紫芝菌丝体多糖的分离纯化及结构研究[J].食品研究与开发,2007,28(10):66-70.
[16]SUJA K P,JAYALEKSHMY A,ARUMUGHAN C.Free Radical Scavenging Behavior of Antioxidant Compounds of Sesame(Sesamum indicum L.)in DPPH System[J].Journal of Agricultural and Food Chemistry,2004,52(4):912-915.
[17]SMIMOFF N,CUMBES Q.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[18]ZHAO G R,XIANG Z J,YE T X,et al.Antioxidant activities of Salvia miltiorrhiza and Panax notoginseng[J].Food Chemistry,2006,99(4):767-774.

