泰乐菌素降解菌的筛选及其降解动力学研究
孙瑞珠 ,马玉龙 ,2*,张 娟 ,张作义 ,王 艳 ,王 敏 ,马志强 (.宁夏大学化学化工学院,宁夏 银川75002;2.宁夏天然药物工程技术研究中心,宁夏 银川 75002;.银川市西夏区农牧水务局,宁夏 银川 75002)
泰乐菌素(Tylosin)是一种由弗氏链霉菌(Streptomyces fradiae)产生的大环内酯类兽用抗生素,被广泛用于畜禽生产及治疗[1].抗生素类药物进入动物体内后,约 30%~90%以药物原形或代谢产物的形式随畜禽粪便排出体外[2-4].近年来,由于抗生素在畜牧养殖中的大量使用,导致其对环境污染的问题日趋严重,如何解决此类问题,已成为当前国际上的讨论热点之一[5].研究表明,土壤中抗生素残留按浓度计算已经达到 11~300μg/kg,这个数字已接近于土壤中其他农药类有机污染物的含量水平[6-8].微生物发酵法生产抗生素过程中,发酵醪液进行固液分离时会产生大量废弃药渣,这些含有高营养成分的药渣若能有效利用,不仅可以缓解资源危机,还可达到废物治理的目的,然而,由于残留有未分离完抗生素的存在,极大地限制了抗生素药渣的循环利用.
近年来,国内外在废水、畜禽粪便中残留抗生素去除的研究报道较多,而关于药渣中残留抗生素处理的报道甚少. 姚斌等[9]研究表明,混合光合细菌PSB-DR对2,3,4-三氯苯酚的降解符合高浓度底物抑制的酶促反应类型.Kummerer等[10]、Ingerslev 等[11]和 Drillia 等[12]通过生物法,对生活废水中残留的环丙沙星、氧氟沙星、甲硝哒唑、复方新诺明、土霉素等进行降解研究,但所得结果并不一致.甘露等[13]采用紫外辐射光解与生物降解同步耦合的气升式内循环反应器降解喹啉,其降解动力学结果可用有抑制性的Haldane模型描述.Yang等[14]报道,在厌氧条件下土壤中微生物对磺胺嘧啶类抗生素所起的降解作用很小.而研究表明,堆肥能有效去除畜禽粪便中残留的四环素类抗生素[15-19].童子林等[20]提出猪粪在中温(35℃)厌氧消化中,四环素和金霉素的降解过程符合一级反应动力学方程.
目前,抗生素类污染物处理方法的研究主要集中于膜分离、好氧厌氧反应器等工艺方面.生物修复是一种去除环境污染物经济有效的治理技术[21-23],而对降解抗生素类污染物的高效降解菌株的筛选及其降解动力学的研究报道较少.因此,本研究从降解动力学角度,探讨生物降解药渣中残留泰乐菌素的机理,以期为泰乐菌素废弃药渣环保处理提供科学依据.
1 材料与方法
1.1 材料
1.1.1 供试样品 泰乐菌素标样购于美国Sigma公司,泰乐菌素药渣(泰乐菌素发酵醪液进行固液分离时产生的菌饼部分,其主要成分是微生物菌丝体、未代谢利用完的有机物、无机盐,其干物质残留的泰乐菌素含量为 2.14mg/g)由泰乐菌素生产企业提供.
1.1.2 培养基 酵母膏蛋白胨葡萄糖(YPD)培养基:酵母膏1g,蛋白胨2g,葡萄糖2g,水100mL(固体加入琼脂 1.2g).药渣培养基:泰乐菌素药渣与水按 1:10比例(重量百分比)混合后,置室温下浸泡 12~14h,离心弃沉淀,再通过抽滤弃除漂浮的杂质即可.将泰乐菌素含量分别调为 50,100,200,300,400,500mg/L.药渣蛋白胨培养基:在上述100mL药渣培养基中加入蛋白胨0.5g.
1.1.3 菌株TS1分离源、筛选与驯化分离 菌株 TS1分离源采于长期堆放泰乐菌素药渣附近的土壤. 称取10g土样,加入装有90mL pH 7.0的磷酸盐缓冲溶液的250mL三角瓶中,并加入一定量的玻璃珠,在摇床上充分打散土样后,取土壤浸出液备用.向土壤悬液中加入泰乐菌素药渣及适量的蛋白胨、葡萄糖. 经过逐次投加的方式,泰乐菌素浓度从 50mg/L依次增加到 500mg/L,置于35℃、130r/min的恒温振荡摇床中培养7d.每个驯化培养周期结束后,取培养液 10mL接入到90mL新鲜培养基中,开始下个周期培养,经过 6个周期驯化培养.将所筛选出的复合菌在含有泰乐菌素的平板上,根据菌落生长快慢、大小、形状、颜色等进行多次划线分离纯化,得到 3株不同形态的单一菌株.用无菌接种环分别挑取分离的单一菌落1环于1.1.2所示的YPD液体培养基中进行培养,分别取10 mL处于对数生长期的菌液(约 48h 达到对数增长期,此时的菌体浓度为108cells/mL),接入到90mL泰乐菌素初始浓度为500mg/L的药渣蛋白胨培养液中,考察 3种菌株对泰乐菌素的降解效果.通过降解效果的对比,筛选出降解能力较强的优势菌株.进行纯化后挑取单一菌落接种于斜面培养基,4℃冰箱保存.以上操作均在无菌环境下进行.
1.2 试验方法
1.2.1 泰乐菌素降解试验 配制泰乐菌素浓度分别为50, 100, 200, 300, 400, 500mg/L的药渣蛋白胨培养液,初始 pH 值调至 7.0~7.2,各取 90mL于250mL三角瓶中,分别接入10mL处于对数增长期的菌液(所用培养基为1.1.2所示的YPD培养基);置于恒温振荡摇床中,在 35℃、130r/min下培养,间隔12h定期取样测定泰乐菌素浓度,研究不同初始浓度条件下泰乐菌素的降解效果.每个处理设置3个平行.
1.2.2 共代谢基质降解试验 配制泰乐菌素浓度为300mg/L的药渣培养基,取90mL于250mL三角瓶中,分别加入葡萄糖、蛋白胨和氨氮各0.5g.再接入 10mL处于对数增长期的菌液,置于35℃、130r/min恒温振荡摇床中培养,间隔 12h定期取样测定泰乐菌素浓度,探讨菌株在加入蛋白胨、葡萄糖和氨氮作为共代谢基质时对泰乐菌素的降解特性(同时以不外加其他基质为对照),每个处理设置3个平行.
1.3 检测方法
1.3.1 微生物浓度测定方法 定期取2mL培养液,用UV-1200型紫外分光光度计测定500nm处的光密度(OD500),细菌浓度的计算公式为:Ccell=314.5× OD500[24].
1.3.2 泰乐菌素测定方法 降解前后药渣中残留泰乐菌素浓度采用高效液相色谱仪(LC-20AT,日本岛津),用外标法定量检测.样品前处理为:取5mL样品,用三氯乙酸终止反应[25].然后用10mL乙腈超声提取10min,5000r/min离心10min,共提取3次,收集上清液于45℃下减压旋转蒸干.再加入 10 mL醋酸钠缓冲溶液(pH5.5)和 5mL正己烷,5000r/min离心10min,水相以1m/min流速,过预先用5mL甲醇、5mL水活化处理后的C18固相萃取柱,然后用5mL水和5mL甲醇-水(体积比为2: 8)洗涤C18柱.分析物用5 mL甲醇洗脱并收集全部洗脱液,用10 mL体积比为30:70的乙腈-磷酸盐缓冲溶液溶解[26-27],待溶解完全后把溶液过0.45μm滤膜后保存,供高效液相色谱测定.
色谱条件:色谱柱为 Agilent HC-C18柱(5μm,250 mm×4.6mm);流动相:乙腈:KH2PO4(0.02mol/L,pH2.5) = 30:70(体积比)等度洗脱;流速:1mL/min;柱温:25 ℃;进样量:20μL;检测波长:285nm.
2 结果与讨论
2.1 菌株TS1菌落形态
经过平板初筛后获得 3株菌,再经过复筛后保留了 1株对泰乐菌素降解效果最大的菌,其对初始浓度为100mg/L的泰乐菌素在5d内的降解率可达100%,将其命名为TS1.菌株TS1在YPD固体培养基上呈圆形,中间凸起,乳白色,表面光滑,不透明,边缘整齐,菌落直径约为2~3mm(图1).菌株TS1经革兰氏染色确定为革兰氏阴性菌,显微镜观察是杆状菌(图2).
图1 菌株TS1在YPD固体培养基上的菌落形态Fig.1 Colony morphology of strain TS1 on solid YPD medium

图2 菌株TS1经革兰氏染色后细胞形态(×1000)Fig.2 Cell morphology of strain TS1 after Gram staining(×1000)
2.2 菌株TS1对不同初始浓度泰乐菌素的降解效果及降解动力学
2.2.1 不同初始浓度泰乐菌素的降解效果 由图 3可知,当泰乐菌素初始浓度为 50,100mg/L时,5d内菌株TS1的降解率可达100%;当泰乐菌素初始浓度为200mg/L时,处理6d可降解99%;而当泰乐菌素初始浓度为300~500mg/L时,7d内则可降解99%以上.图4是初始浓度为300mg/L的泰乐菌素降解前后的液相色谱图.虽然在所试泰乐菌素初始浓度范围内,菌株TS1对泰乐菌素的降解率不同,但菌株对泰乐菌素的绝对降解量随其初始浓度的增加而增大.同时,降解效率和菌株生长具有一定的一致性,开始时(0~1d)菌株生长处于延迟期,降解效率低;随着菌株进入对数生长期(2~3d),降解效率显著增高;之后随着时间的延长,由于营养成分的缺失和代谢废物的增加,菌株生长逐渐到衰退期,对泰乐菌素的降解能力也随之下降,降解曲线趋于平缓.

2.2.2 降解动力学分析 将不同初始浓度下的降解数据按一级反应动力学方程进行线性拟合,即:lnc=-kt+A,式中k[mg/(L·d)]表示降解速率常数,t(d)是降解时间,c(mg/L)是降解t时残留的泰乐菌素浓度,A为常数.拟合结果显示出良好的线性关系(图5).
由表 1可见,菌株对泰乐菌素的降解符合一级动力学特征,相关系数R2均高于0.95,所得一级动力学方程均能较好地反映菌株 TS1对泰乐菌素降解的趋势.泰乐菌素浓度在100~ 400mg/L时,降解速率常数k均大于0.4,半衰期都小于2d;当泰乐菌素浓度增加到500mg/L时,降解速率常数k明显下降,半衰期也延长到2.03d.说明高浓度的泰乐菌素对菌株的降解有抑制作用.
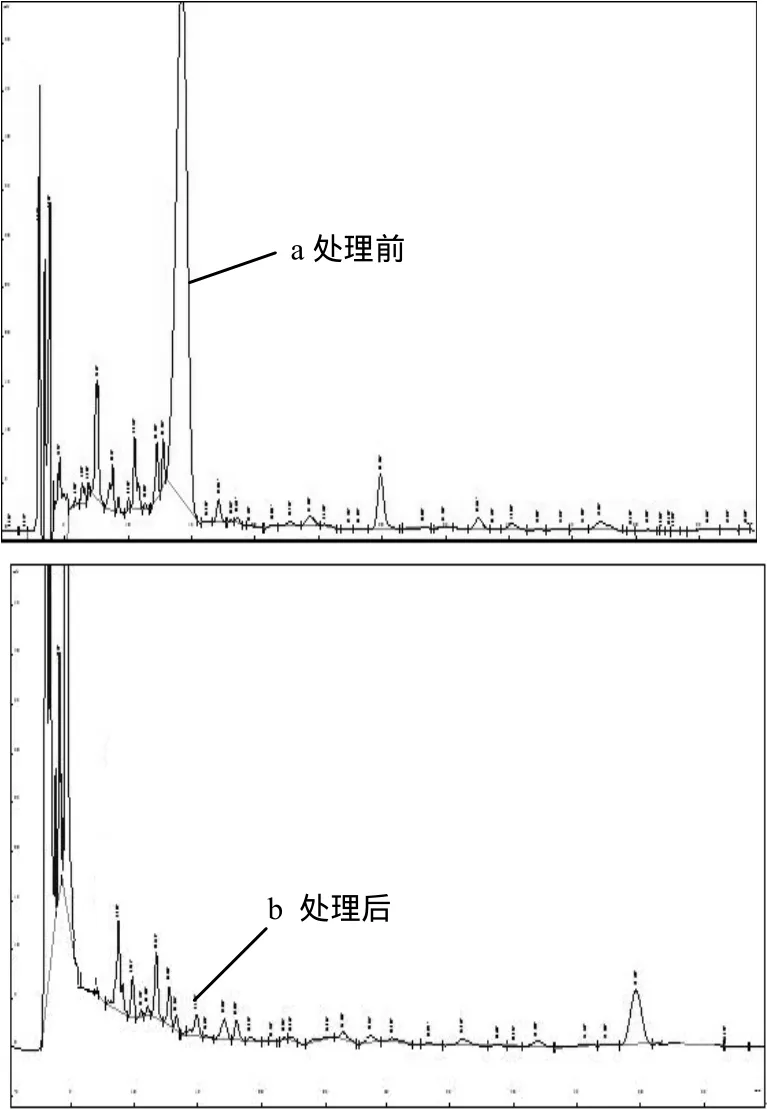
图4 初始浓度为300mg/L的泰乐菌素药渣经菌株TS1处理前后的HPLC图谱Fig.4 HPLC spectra of tylosin in pharmaceutical waste with initial concentration of 300 mg/L before (a) and after (b) treatment with strain TS1 for 7d
2.3 不同共代谢基质中菌株对泰乐菌素的降解效果
由图 6可见,蛋白胨或氨氮分别做泰乐菌素降解的共代谢基质时,菌株在7d内对初始浓度为300mg/L的泰乐菌素降解率可达 99%以上;而用葡萄糖作为共代谢基质时,菌株在 10d内对其降解率只有 66.7%;而在不外加其他物质的泰乐菌素药渣体系中,9d内泰乐菌素降解率可达 99%以上.由降解效率可知,蛋白胨的加入为菌株提供了优质氮源,前3d对泰乐菌素的降解率已达56.7%;氨氮体系中,菌株在第1d对泰乐菌素未显降解作用,第2d才开始降解,可能是菌株在适应了环境后才开始利用氨氮,但其降解速率仍然低于添加蛋白胨的体系;而体系中加入葡萄糖后,菌株对泰乐菌素的降解程度最小,在 10d内的降解率低于菌株 TS1在泰乐菌素药渣中的降解率,说明葡萄糖的加入不利于菌株TS1对泰乐菌素的降解作用.

图5 一级反应动力学线性拟合Fig.5 First-order kinetic relationship between ln c vs.time

表1 不同泰乐菌素初始浓度下降解动力学结果Table 1 Degradation kinetic of tylosin at differently initial concentrations
由表 2可知,共代谢体系中菌株对泰乐菌素的降解反应速率常数K蛋白胨+泰乐菌素药渣>K氨氮+泰乐菌素药渣>K葡萄糖+泰乐菌素药渣,这与其降解率数据结果相一致.蛋白胨或氨氮的加入均有助于菌株对泰乐菌素的降解,其速率常数分别为 0.4174和 0.3719mg/(L·d),均大于泰乐菌素药渣体系中的速率常数0.3301mg/(L·d),而加入葡萄糖后,反应速率常数为0.1076mg/(L·d),t1/2延长至 6.41d,提示葡萄糖的加入不利于菌株 TS1对泰乐菌素的降解作用.因为葡萄糖是微生物较容易利用的碳源,体系中加入葡萄糖时,菌株优先利用葡萄糖,导致菌株 TS1对泰乐菌素的降解速率下降,半衰期延长.因此,在菌株 TS1降解泰乐菌素的实际应用中,可加入一定量氨氮,以促进降解菌对泰乐菌素的降解作用.

图6 不同降解体系中泰乐菌素浓度随反应时间的变化Fig.6 Changes of tylosin concentrations with time in various biodegradation systems

表2 不同降解体系中反应动力学Table 2 Kinetic in different biodegradation systems
3 结论
3.1 从长期堆放泰乐菌素药渣的土壤中筛选分离出1株泰乐菌素高效降解菌株 TS1.用该菌处理泰乐菌素药渣,5d内能完全降解初始浓度分为50和100mg/L的泰乐菌素;6d内对200mg/L泰乐菌素的降解率达 99%以上,7d内对 300~500mg/L泰乐菌素的降解率均达99%以上.
3.2 菌株TS1对不同初始浓度泰乐菌素的降解符合一级动力学特征.在所研究浓度范围内,泰乐菌素浓度在100~400mg/L时,降解速率常数k均大于0.4,半衰期小于2d;当浓度达到一定限度时,反应速率开始显著下降,高浓度泰乐菌素抑制菌株对其的降解.
3.3 在降解体系中,蛋白胨或氨氮的加入促进了菌株对泰乐菌素的降解作用,而葡萄糖则对菌株降解泰乐菌素有抑制作用.
[1]Prats C, Francesch R, Arboix M, et al. Determination of tylosinresidues in different animal tissues by high performance liquid chromatography [J]. Journal of Chromatography B, 2001,766:57-65.
[2]Bound J P, Voulvoulis N. Pharmaceuticals in the aquatic environment a comparison of risk assessment strategies [J].Chemosphere, 2004,56(11):1143-1155.
[3]Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: A review of recent research data [J]. Toxicol. Lett., 2002,131(1/2):5-17.
[4]Montforts M H M M, Kalf D F, van Vlaardingen P L A, et al. The exposure assessment for veterinary medicinal products [J]. Sci.Total Environ., 1999, 225(1/2):119-133.
[5]Boxall A B A, Fog L A, Kay P, et al. Veterinary medicines in the environment [J]. Reviews in Environmental Contamination and Toxicology, 2004,180:1-92.
[6]Thiele-Bruhn S. Phar antibiotic compounds in soils-a review [J].Journal of Plant Nutrition and Soil Science, 2003,166:145-167.
[7]Hamscher G, Sczesny S, Hoper H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry [J].Analytical Chemistry, 2002,74(7):1509-1518.
[8]Baguer A J, Jensen J, Krogh P H. Effects of the antibiotics oxytetracycline and tylosin on soil fauna [J]. Chemosphere, 2000,40:751-757
[9]姚 斌,金赞芳,胡忠策,等.光合细菌对 2,4,6-三氯苯酚的降解特性 [J]. 中国环境科学, 2011,31(10):1669-1679
[10]Kummerer K, Al-Ahmad A, Mersch-Sundermann V.Biodegradability of some antibiotics, elimination of the genotoxicity and affection of wastewater bacteria in a simple test[J]. Chemosphere, 2000,40(7):701-710.
[11]Ingerslev F, Torang L, Loke M L, et al. Primary biodegradation of veterinary abtibiotics in aerobic and anaerobic and anaerobic surface water simulation systems [J]. Chemosphere, 2001,44:865-872.
[12]Drillia P, Dokianakis S N, Fountoulakis M S, et al. On the occasional biodegradation of pharmaceuticals in the activated process: The example of the antibiotic sulfamethoxazole [J].Journal of Hazardous Materials, 2005,122:259-265.
[13]甘 露,阎 宁,张永明.紫外辐射与生物膜同步耦合降解喹啉[J]. 中国环境科学, 2012,32(4):623-629.
[14]Yang J F, Ying G G, Yang L H, et al. Degradation behavior of sulfadiazine in soil under different conditions [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2009,44 (3):241-248.
[15]Arikan O A, Sikora L J, Mulbry W, et al. Composting rapidly reduces revels of extractable oxytetracycline in manure from therapeutically treated beef calves [J]. Bioresour. Technol., 2007,
98:169-17.
[16]Arikan O, Mulbry W, Rice C. Management of antibiotic residues from agricultural sources: Use of composting to reduce chlortetracycline residues in beef manure from treated animals [J].J. Hazard. Mater, 2009,164:483-489.
[17]Dolliver H, Gupta S, Noll S. Antibiotic degradation during
manure composting [J]. J. Environ. Qual., 2008,37:1245-1253.
[18]Bao Y, Zhou Q, Guan L, et al. Depletion of chlortetracycline during composting of aged and spiked manures [J]. Waste Manage., 2009,29(4): 1416-1423.
[19]Arikan O, Mulbry W, Ingram D, et al. Minimally managed composting of beef manure at the pilot scale: Effect of manure pile construction on pile temperature profiles and on the fate of oxytetracycline and chlortetracycline [J]. Bioresour. Technol.,2009,100(19):4447-4453.
[20]童子林,刘元璐,胡真虎,等.四环素类抗生素污染畜禽粪便的厌氧消化特征 [J]. 环境科学, 2012,33(3):1028-1032.
[21]Martienssen M, Fabritius H, Stefan K, et al. Determination of naturally occurring MTBE biodegradation by analyzing metabolites and biodegradation by products [J]. Journal of Contaminant Hydrology, 2006,87:37-53.
[22]Kuburovic N, Tocbrovic M, Raicevic V, et al. Removal of methyl tertiary butyl ether from wastewaters using photolytic,photocatalytic and microbiological degradation processes [J].Desalination, 2007,213:123-128.
[23]Schmidt T C, Schimer M, Haderlein S B, et al. Microbial degradation of methyl tert-butyl ether and etrt-butyl alcohol in the subsurface [J]. Journal of Contaminant Hydrology, 2004,70:173-203.
[24]Li Y, Loh K C. Activated carbon impregnated polysulfone hollow fiber membrance for cell immobilization and cometabolic biotransformation of 4-chlorophenol in the presence of phenol [J].Journal of Membrane Science, 2006,276:81-90.
[25]Pihlanto Anne. Antioxidative peptides derived from milk proteins[J]. International Dairy Journal, 2006,16 (11):1306-1314.
[26]谢 文,丁慧瑛,奚君阳,等.蜂王浆产品中 5种大环内酯类抗生素残留量的高效液相色谱-质谱/质谱检测方法 [J]. 色谱,2007,25(3):404-407.
[27]严丽娟,张 峰,方恩华,等.超高效液相色谱-电喷雾串联质谱法测定动物饲料中的大环内酯类和林可胺类抗生素 [J]. 色谱,2010,28(11):1038-1042.

