侵染广东甘薯的甘薯曲叶病毒分子检测与鉴定
汤亚飞, 何自福*, 韩利芳, 罗方芳
(1.广东省农业科学院植物保护研究所,广州 510640; 2.广东省植物保护新技术重点实验室,广州 510640)
甘薯曲叶病毒(Sweet potato leaf curl virus,SPLCV)引起的甘薯曲叶病是世界甘薯生产的重要病害之一,在美国[1]、西班牙[2]、巴西[3]、以色列[4]、意大利[5]、日本[6]等国家均有发生,并造成较严重的损失。该病毒属双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus)成员,基因组仅含有 DNA-A,由烟粉虱(Bemisia tabaci)以持久方式传播[7]。SPLCV主要侵染旋花科(Convolvulaceae)番薯属(Ipomoea)甘薯等植物,引起寄主植物叶片卷曲,导致产量损失。目前,在我国辽宁[8]、江苏[9]、云南[10]、福建[11]、台湾[12]等地已报道发现该病毒。
甘薯(Ipomoea batatas Lam.)是重要的粮食、能源和工业原料作物之一。广东省是我国主要的甘薯产区之一,年种植面积近30万hm2。2011-2012年,作者在全省各甘薯产区进行调查,先后在广州市天河区和梅州市兴宁市发现部分甘薯植株表现叶片向上卷曲、叶脉肿大等症状。应用菜豆金色花叶病毒属(Begomovirus 病毒通用简并引物AV494 CoPR[13-14]进行PCR检测显示,该病样中均存在菜豆金色花叶病毒属病毒。为了弄清该病毒的种类,进而指导病害防治,本研究对其基因组进行了克隆和序列分析。
1 材料与方法
1.1 病样来源
在广州市天河区和梅州市兴宁市的甘薯产区分别采集代表性甘薯病样10份和5份,田间病株表现为叶片向上卷曲,叶脉肿大等症状(图1)。

图1 田间甘薯曲叶病症状Fig.1 The symptoms of sweet potato leaf curl disease
1.2 病株总DNA提取
利用CTAB方法[15]提取甘薯病叶组织的总DNA。
1.3 PCR检测
利用菜豆金色花叶病毒属病毒通用简并引物AV494/CoPR[13-14],对病样进行PCR检测。
1.4 RCA扩增及酶切分析
以提取的病样总DNA 1.0μL为模板,利用TempliphiTMRCA Kit(GE Healthcare)进行滚环扩增(rolling circle amplification,RCA),具 体 方 法 按照试剂盒说明书上的步骤进行。
RCA 反应结束后,扩增产物分别用Pst I、Sac I和Nde I限制性内切酶进行酶切。酶切反应体系为:RCA产物2μL、内切酶1μL、10×内切酶缓冲液1μL,总酶切反应体系为10μL。在37℃条件下酶切2h以上,然后进行电泳分析。若某个内切酶酶切的产物产生2.5~3.0kb,或同时还产生1.3kb左右的条带,则克隆这些特异性条带。
1.5 序列分析
利用 DNAStar软 件 (DNASTAR Inc,Madison,USA)进行序列拼接,利用BLAST程序进行序列相似性搜索,进一步用DNAStar的 MegAlign进行序列比较分析。
2 结果与分析
2.1 病样PCR检测结果
利用菜豆金色花叶病毒属病毒特异简并引物AV494和CoPR进行PCR检测,从所有表现为曲叶症状的甘薯病样总DNA中均能扩增到一条预期大小为570bp的特异片段,而健康植株未扩增出任何片段。该结果表明,这些病样受到菜豆金色花叶病毒属病毒的侵染。
2.2 RCA产物酶切结果
随机挑取PCR检测为阳性的广州市病样2份及梅州市兴宁市病样1份,以其总DNA为模板进行RCA扩增,酶切结果显示,Pst I、Sac I、Nde I等3个内切酶均能将3个RCA产物分别切出一条约2.7kb大小的单一条带(图2),推测其可能是病毒基因组的全长组分A或B。为此,对该片段进行克隆,并分别随机挑选3个克隆进行测序。
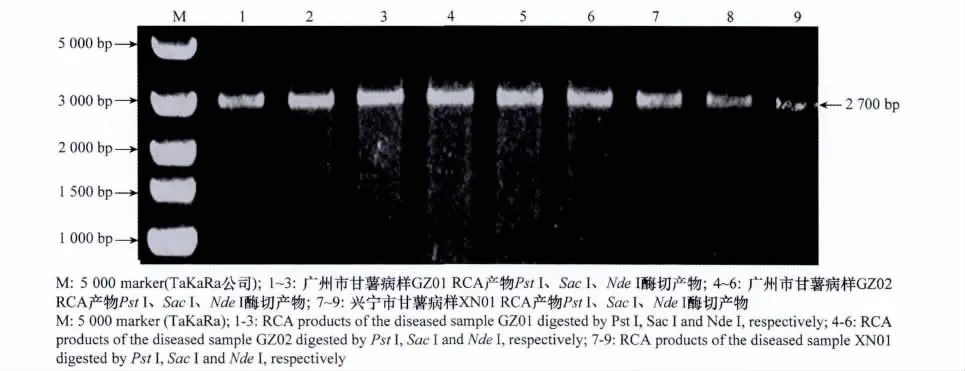
图2 甘薯病样总DNA RCA产物的酶切电泳结果Fig.2 Agarose gel electrophoresis of RCA products of DNA extracted from diseased samples digested by restriction enzymes
2.3 序列比较分析结果
基因克隆与序列测定结果表明,广州市甘薯病样GZ01病毒分离物(GenBank登录号为:JX286653)和GZ02病毒分离物(GenBank登录号为:JX286654)的全长均为2829nt,两者的同源率为97.3%;兴宁市甘薯病样XN01病毒分离物(GenBank登录号为:JX286655)全长为2828nt,与GZ01的同源率为98.4%,与GZ02的同源率为96.0%。
3个病毒分离物的全长基因序列均具有单组分菜豆金色花叶病毒基因组DNA-A典型特征,为单链闭合环状,推导编码6个ORFs。GZ01和GZ02基因组病毒含AV1基因 (295~1059nt,编码CP)和AV2基因 (72~470nt,编码与病毒移动相关蛋白),互补链含有AC1基因(1581~2675nt,编码复制酶)、AC2基因(1226~1672nt,转录激活蛋白)和AC3基因(1075~1509nt编码复制增强蛋白)和 AC4基因(2261~2518nt)。在 AV2与 AC1之间含有一个225nt的非编码区(2676~71nt),含有与双生病毒复制起始有关的保守序列TAATATTAC(2823~2nt)。病毒分离物XN01基因组结构除了在AV2与AC1之间非编码区的44nt处缺失一个碱基A外,其他与GZ01、GZ02的基因组结构特征相同。
BLAST结果显示,与广东3个分离物DNA-A有较高同源率的序列均属Begomovirus病毒分离物基因组。进一步比较结果(表1)显示,与来自西班牙、美国、韩国、日本、阿根廷及中国等19个分离物的序列同源率均在89.0%以上,其中GZ01与美国MS:1B-1a、MS:4B-14分离物同源率最高(94.5%),而GZ02和XN01与F-p1、F-p2、F-p3这3个分离物的同源率最高,分别为95.9%和94.3%。

表1 SPLCV 3个广东分离物与已报道的19个分离物DNA-A核苷酸序列同源率比较Table 1 Percentages of DNA-A nucleotide sequences identities between the 3 isolates from Guangdong and 19isolates of SPLCV previously reported
3 讨论
甘薯曲叶病是近年在广东甘薯上发现的一种新病害,通过PCR检测证明这些病样中均存在菜豆金色花叶病毒属(Begomovirus)病毒,进一步应用RCA方法从病样中获得3个病毒分离物DNA-A全长序列。这些病毒分离物DNA-A具有菜豆金色花叶病毒属成员基因组DNA典型特征,且与已登陆GenBank中SPLCV各分离物的序列同源率均在89%以上,其中与F-p1、F-p2和F-p3这3个分离物的同源率均在94.3%以上。因此,根据目前国际双生病毒分类方案[16],侵染广东甘薯的病毒分离物GZ01、GZ02和XN01均属于SPLCV。
采用RCA及PCR方法,在广东甘薯病样中均未检测到DNA-B组分和卫星分子的存在。同时,目前国内外已报道的SPLCV各分离物基因组均只含有DNA-A组分。因此,推测侵染广东甘薯的SPLCV也是一个单组分Begomovirus病毒。
虽然GZ01、GZ02和XN01这3个分离物均分离自广东甘薯上,但其DNA-A序列存在不同程度的差异,同源率为96.0%~98.4%;即使来自同一块甘薯地的分离物GZ01和GZ02,两者序列也存在一定差异(同源率为97.3%)。说明侵染广东甘薯的SPLCV种群存在遗传差异。关于这3个病毒分离物的致病性及其遗传变异的生物学意义,还有待于通过构建侵染性克隆接种来进一步研究。
近年来,烟粉虱传播的双生病毒病在我国广泛流行,其中番茄黄化曲叶病最为普遍,而在广东及华南地区双生病毒种类较多,目前至少发现有14种,受害植物种包括番茄[14]、番木瓜[17]、黄秋葵[18]、朱槿[19]、鳢肠[20]、软枝黄蝉[21]、棉花[22]等作物。2012年,本研究团队先后在广东省广州市和梅州市兴宁市等甘薯产区发现甘薯曲叶病,并从中检测与鉴定出甘薯曲叶病毒。这是首次在广东检测到该病毒。因此,应采取有效防治措施,预防与控制甘薯曲叶病毒传播、扩散和流行。
[1] Zhang S C,Ling K S.Genetic diversity of sweet potato begomoviruses in the United States and identification of a natural recombinant between Sweet potato leaf curl virus and Sweet potato leaf curl Georgia virus [J].Archives of Virology,2011,156(6):955-968.
[2] Lozano G,Trenado H P,Valverde R A,et al.Novel begomovirus species of recombinant nature in sweet potato (Ipomoea batatas)and Ipomoea indica:taxonomic and phylogenetic implications[J].Journal of General Virology,2009,90(10):2550-2562.
[3] Paprotka T,Boiteux L S,Fonseca M E N,et al.Genomic diversity of sweet potato geminiviruses in Brazilian germplasm bank[J].Virus Research,2010,149(2):224-233.
[4] Cohen J,Milgram M,Antignus Y,et al.Ipomoeacrinkle leaf curl caused by a whitefly-transmitted gemini-like virus[J].Annals of Applied Biology,1997,131(2):273-282.
[5] Briddon R W,Bull S E,Bedford I D.Occurrence of Sweet potato leaf curl virus in Sicily[J].Plant Pathology,2006,55(2):286.
[6] Onuki M,Hanada K.PCR amplification and partial nucleotide sequences of three dicot-infecting geminiviruses occurring in Ja-Japan[J].Annals of the Phytopathological Society of Japan,1998,64(2):116-120.
[7] Fauquet C M,Stanley J.Geminivirus classification and nomenclature:progress and problems[J].Annals of Applied Biology,2003,142(2):165-189.
[8] Luan Y S,Zhang J,Liu D M,et al.Molecular characterization of Sweet potato leaf curl virus isolate from China (SPLCVCN)and its phylogenetic relationship with other members of the Geminiviridae[J].Virus Genes,2007,35(2):379-385.
[9] Bi H P,Zhang P.Molecular characterization of two sweepoviruses from China and evaluation of the infectivity of cloned SPLCV-JS in Nicotiana benthamiana [J].Archives of Virology,2012,157(3):441-454.
[10]丁铭.侵染云南茄科作物和甘薯的粉虱传双生病毒基因组结构及进化特征[D].昆明:云南大学,2009.
[11]Yang C X,Wu Z J,Xie L H.First report of the occurrence of Sweet potato leaf curl virus in tall morning glory (Ipomoea purpurea)in China[J].Plant Disease,2009,93(7):764.
[12]Li Ruhui,Salih S,Hurtt S.Detection of geminiviruses in sweet potato by polymerase chain reaction[J].Plant Disease,2004,88:1347-1351.
[13]Wyatt S D,Brown J K.Detection of subgroupⅢgeminivirus isolates in leaf extracts by degenerate primers and polymerase chain reaction[J].Phytopathology,1996,86(12):1288-1293.
[14]何自福,虞皓,罗方芳.番茄烟粉虱传双生病毒PCR检测[J].中国病毒学,2004,19(1):67-69.
[15]Doyle J J,Doyle J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[16]Fauquet C M,Briddon R W,Brown J K,et al.Geminivirus strain demarcation and nomenclature[J].Archives of Virology,2008,153(4):783-821.
[17]张鲁斌,周国辉,李华平,等.侵染广州番木瓜的曲叶病毒DNA-A分子特征及生物学测定[J].中国农业科学,2005,38(9):1805-1810.
[18]董迪,朱艳华,何自福,等.侵染广东黄秋葵的木尔坦棉花曲叶病毒及伴随卫星DNA的分子特征[J].华南农业大学学报,2012,33(1):33-39.
[19]毛明杰,何自福,虞皓,等.侵染朱槿的木尔坦棉花曲叶病毒及其卫星DNA全基因组结构特征[J].病毒学报,2008,24(1):64-68.
[20]He Z F,Mao M J,Yu H,et al.First report of a strain of Alternanthera yellow vein virus infecting Eclipta prostrate (L.)L.(Compositae)in China[J].Journal of Phytopathology,2008,156:496-498.
[21]He Z F,Mao M J,Yu H,et al.Molecular characterization of a distinct begomovirus infecting Allamanda cathartica in Guangdong China[J].Archives of Virology,2009,154(8):1199-1202.
[22]Cai J H,Xie K,Lin L,et al.Cotton leaf curl Multan virus newly reported to be associated with cotton leaf curl disease in China[J].Plant Pathology,2010,59(4):794-795.

