甘肃省定西市当归“水烂病”病原鉴定及致病性测定
吕祝邦, 李敏权,2*, 惠娜娜, 王 立,漆永红, 马永强, 苓 强, 李继平*
(1.甘肃农业大学草业学院,兰州 730070;2.甘肃省农业科学院,兰州 730070;3.甘肃省农业科学院植物保护研究所,兰州 730070)
当归[Angelica sinensis (Oliv.)Diels]为伞形科植物,药用历史悠久,是中国大宗常用中药材[1]。甘肃当归种植历史悠久,早在西汉初就有记载[2]。随着中药材种植产业结构的调整,甘肃省当归的种植面积近年来逐年增加,2011年全省种植面积达2.60万hm2,其中定西市1.67万hm2,占全省种植面积的64.06%。定西当归质量好、品质佳,2001年定西市岷县被国家命名为“中国当归之乡”,“岷归”远销东南亚、港澳台及欧美等地20多个国家和地区,被欧洲人誉为“中国妇科人参”。
一些学者报道了当归麻口病、褐斑病、软腐病等[3-5],对病原和致病机理进行了研究。王玉娟[6]等报道了当归“水烂病”,认为细菌和真菌都可引起该病,但目前尚未对致病病原进行系统研究。近年来,由于降水量增多“水烂病”在定西市岷县、漳县、渭源等地严重发生,造成田间早期大量死苗,严重影响当归产业的发展。因此,本试验从病原形态特征、生理生化特性及16SrDNA序列分析入手,对甘肃省当归水烂病病原及其对不同品种当归的致病性进行研究,旨在为深入开展该病害的发生发展规律研究、综合防治以及当归的抗病育种等提供理论依据。
1 材料与方法
1.1 样本采集及镜检
2009-2011年在定西市岷县、漳县、渭源等当归种植区采集水烂病病样,品种为当地主栽品种‘岷归1号’,描述症状并拍照,实验室镜检,发现有溢菌现象。
1.2 供试培养基
NA培养基:酵母浸膏1g,牛肉浸膏3g,蛋白胨10g,蔗糖10g,琼脂18g,蒸馏水1000mL,pH 7.0。
KB培养基:硫酸镁(MgSO4·7H2O)1.5g,磷酸氢二钾(K2HPO4)1.5g,甘油10g,蛋白胨20g,琼脂20g,蒸馏水1000mL,pH 7.2。
1.3 病原菌的分离与纯化
在病健交界处剪取病样,3%的次氯酸钠浸泡3min,无菌水冲洗3次,用玻璃棒将组织捣碎静止片刻,在NA平板上划线,28℃下培养48h,挑取单菌落转接纯化并保存备用。
1.4 对烟草致病性测定
将菌落在NA培养基上划线培养36h,刮下菌苔配成菌悬液(浓度3×108cfu/mL),从烟叶背面将菌液注射到6~8叶龄活体烟草的叶肉组织中,室内套袋保湿,以注射灭菌水为对照,观察有无枯斑反应。
1.5 不同品种当归致病性测定
离体接种:选取健壮无损伤的二年生植株,3个品种为:‘岷归1号’(主栽品种)、‘岷归2号’(新繁品种)和‘朝鲜当归 ’(引进品种),每个品种选5株,流水冲洗干净,乙醇表面消毒。参考方中达的注射法接种,在植株根茎交界部位注射菌悬液(浓度3×108cfu/mL),每个品种重复3次,共15株,以接种无菌水为对照。接种后将植株放在培养皿内,置于28℃恒温箱保湿,观察发病情况。
盆栽接种:分别将3个品种的二年生归根冲洗干净,栽于装有灭菌蛭石的育苗盒中,每盒栽2株,待植株长至8~10cm,在根茎交界处用注射法进行接种,每株注射0.5mL菌悬液(浓度3×108cfu/mL),每个品种接3盒,共6株,室内套袋保湿,观察发病情况。
1.6 病原菌形态鉴定
参照方中达的方法,在NA、KB平板上分别划线培养,观察菌落生长速度、菌落形态和产生色素的情况。采用革兰氏染色法染色,在油镜下测量和观察菌体的大小和形状。生理生化指标的测定参考《植 病 研 究 方 法 》[7]、《伯 杰 细 菌 鉴 定 手 册 (第 八版)》[8]、《常见细菌系统鉴定手册》[9]等书中的方法。
1.7 16SrDNA分子鉴定
将菌株在NA培养基上连续活化2~3代,挑取单菌落转接于LB培养基中,28℃、200r/min培养24h。8000r/min离心5min,弃去上清液,加0.85mol NaCl,12000r/min离心5min,弃上清,沉淀用于DNA提取。
基因组DNA提取采用CTAB法[10]。选择细菌16SrDNA通用引物27f和1492r(由上海基康生物公司合成),其序列分别为:5′-AGAGTTTGATCATGGCTCAG-3′和 5′-GGTTACCTTGTTACGACTT-3′。PCR扩增采用50μL反应体系,其中10×PCR Buffer 5μL,25nmol/L MgCl28μL,10nmol/L dNTPs 4μL,10nmol/L 引物27f和引物1492r各1μL,1.5UTaq酶0.5μL,DNA模板2μL,加ddH2O至50μL。PCR扩增条件为:94℃ 预变性4min;然后94℃变性30s,50℃退火30s,72℃延伸2min,反应共30个循环;最后72℃延伸10min。4℃ 终止反应,保存备用。PCR产物送上海基康生物技术有限公司进行测序。将测序得到的结果在NCBI上用Blast进行相似性比对分析,用Mega5.1软件对所测基因序列与GenBank中相似性最高的基因序列进行聚类分析,构建系统发育树。
2 结果与分析
2.1 当归水烂病发病症状
在田间,病原菌从当归根茎交界处开始侵染。发病初期,叶柄基部呈现水渍状,植株地上部长势良好,叶片不萎蔫;发病中期,叶柄基部开始腐烂,叶片萎蔫,整个植株呈枯萎状;末期,地上部全部枯死,同时造成地下根腐烂。将分离纯化的菌株定名为ZB1。
2.2 对烟草的致病性
ZB1菌株在烟草叶片上经24~36h显症,产生灰褐色枯斑(图1a),表明该菌株对烟草具有致病性。
2.3 对不同当归品种的致病性
ZB1离体接种试验表明,3个品种都表现不同程度的湿腐。‘岷归2号’(新繁品种)24h显症,接种部位出现明显的水渍状湿腐(图1b),发病率为86.7%;‘岷归1号’(主栽品种)48h左右显症,病组织黑褐色腐烂,发病率为40%;‘朝鲜当归’(引进品种)发病较轻,接种部位出现轻微的水渍状褐斑,发病率为13.3%。
盆栽试验表明,接种5d,‘岷归2号’(新繁品种)开始显症,叶片萎蔫,接种部位有明显的湿腐,7d植株地上部全部枯萎,地下根开始腐烂(图1c);‘岷归1号’(主栽品种)接种7d开始显症,发病症状跟田间初期症状一样;‘朝鲜当归’(引进品种)接种12d显示轻微的症状。将枯萎的植株进行再次划线分离,得到的菌落和原来的菌落形态一样,符合柯赫氏法则。

图1 ZB1菌株致病性测定Fig.1 Pathogenicity tests of the strain ZB1
2.4 病原菌形态特征和培养性状
菌落在NA培养基上不透明,4~5d菌落略显黄色,中间形成雪花状白色小点且向内凹陷。在KB培养基上生长快,菌落透明,产生可扩散性黄绿色荧光色素。菌体杆状,大小(0.7~0.8)μm×(2.3~2.8)μm,革兰氏染色阴性(图2)。

图2 菌株ZB1形态特征及革兰氏染色结果Fig.2 Morphological characteristics and Gram-staining of the strain ZB1
2.5 生理生化特性
该菌最适生长温度为25~30℃,具有运动性,不耐盐,能溶解于3%的KOH溶液,紫外灯下产生黄绿色荧光,严格好氧,水解淀粉,硝酸盐还原阴性,接触酶反应阳性,可利用葡萄糖、麦芽糖、肌醇、D-甘露糖、甘油等碳素化合物,不能利用L-山梨糖。以上测试项均符合荧光假单胞杆菌的生理生化特性。
2.6 16SrDNA序列测定及同源性比较
对菌株的16SrDNA进行测序,得到的片段大小为1445bp。测序后,将菌株的16SrDNA区域序列与GenBank(http:∥www.ncbi.nlm.nih.gov)数据库进行Nucleotide Blast序列比对,结果表明,该菌株与GenBank已报道的荧光假单胞杆菌[Pseudomonas fluorescens(Trer.)Migula]AF336352.1序列相似性达99%。
用Clustal X软件对所测的菌株序列进行校正,将GenBank上获得的数据载入Mega5.1软件,按照N-J法,构建系统发育树。从构建的发育树可以看出,ZB1菌株与假单胞杆菌属的菌株相似性较高,和荧光假单胞杆菌(P.fluorescens)在同一分支,聚为一类(图3)。结合16SrDNA分子生物学特性及致病性特点,将菌株定为荧光假单胞杆菌第2生物型(P.fluorescens生物型Ⅱ)。
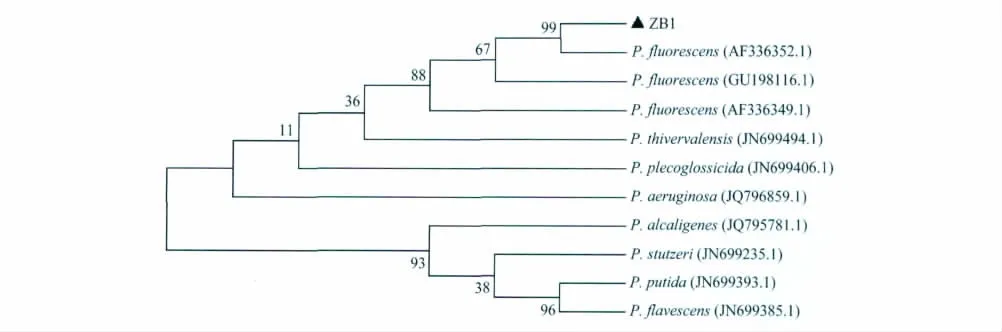
图3 菌株ZB1的16SrDNA序列聚类分析树Fig.3 Cladogram of the strain ZB1based on 16SrDNA sequences
3 讨论
当归“水烂病”在1990年就有学者提出,其症状与其他当归病害有所不同,本文首次对引起该病害的病原进行报道,在病组织中只分离到了细菌没有发现真菌。细菌病原的鉴定是细菌病害研究的基础,明确病害的病原是制定有效防治措施的重要前提。细菌分类鉴定除传统的形态特征、培养特性、生理生化特征和免疫学反应等方法外,16SrDNA技术已被用于细菌的快速分子诊断和分类鉴定。国内外一些学者利用16SrDNA方法对一些细菌进行了研究,刘长远[11]等采用16SrDNA方法鉴定出了黄瓜细菌性白枯病病原为绿黄假单胞菌(P.viridiflava)。李守萍[12]等利用16SrDNA鉴定出油松内菌根促生细菌为荧光假单胞杆菌(P.fluorescens),彭帅[13]等通过16SrDNA序列分析鉴定出了产葡萄糖酸的荧光假单胞杆菌(P.fluorescens),邓刚[14]等采用16SrDNA鉴定了甘肃番茄细菌性斑点病病原为丁香假单胞杆菌番茄致病变种(P.syringae pv.tomato)。本试验通过形态学、生理生化特性和16SrDNA分子特征鉴定出了甘肃省当归水烂病病原为荧光假单胞杆菌 (P.fluorescens)。根据国内外一些学者的报道,荧光假单胞杆菌是一类广泛分布于植物根际的促生细菌(plant growth promoting rhizobacteria,PGPR),分泌的各种次生代谢产物能防治一些植物病害[15-17],如小麦全蚀病[Gaeuman-nomyces graminis (Sacc.)Arx et Olivier]、马铃薯软腐病(Erwinia carotovora)、番茄灰霉病(Botrytis cinerea Pers.ex Tr.)等。根据资料的报道,荧光假单胞杆菌5个生物型中植物病原菌只有生物Ⅱ型[8,18]。5个生物型的分子鉴定比较复杂,本文对该病原菌只进行了16SrDNA测序分析,其他分子生物学特性尚待进行更深入的研究,暂时将该病原菌定为荧光假单胞杆菌第2生物型(P.fluorescens生物型Ⅱ)。本文首次报道了荧光假单胞杆菌第2生物型能引起当归水烂病,当归是该病原菌的一个新寄主。
致病性测定结果表明,该菌株对3个当归品种均致病,但对不同品种致病力不同,其中对‘岷归2号’(新繁品种)致病力最强,‘岷归1号’(主栽品种)次之,对‘朝鲜当归’(引进品种)致病力最弱,说明当归的不同品种可能存在抗性分化。从病害控制的角度考虑,新品种‘岷归2号’的推广应当慎重。
[1] 中华人民共和国药典委员会.中华人民共和国药典一部[M].北京:化学工业出版社,2010:124.
[2] 丁永辉.甘肃地道药材的历史与现状[J].中药材,1992,15(5):38-39.
[3] 马象震,苗晓春.当归麻口病的发生及其综合防治[J].甘肃农业科技,2008(11):53-54.
[4] 王艳,陈秀荣,王引权,等.甘肃省当归褐斑病菌生物学特性及其营养利用研究[J].中药材,2009,32(4):479-482.
[5] 赵振玲,张金渝,张智慧,等.云南当归软腐病的危害性及病原鉴定[J].云南大学学报,2010,32(2):227-232.
[6] 王玉娟,盛秀兰,孙政,等.当归麻口病发生规律及防治研究(二)[J].甘肃农业科技,1990(5):22-24.
[7] 方中达.植病研究方法[M].北京:中国农业出版社,2001.
[8] 布坎南R E,吉本斯 N E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:274-312.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10]奥斯伯F.精编分子生物学指南[M].颜子颖,王海林,译.北京:科学出版社,2001:39.
[11]刘长远,赵奎华,傅俊范,等.黄瓜细菌性白枯病CU-PV 07菌株鉴定及16SrDNA序列分析[J].沈阳农业大学学报,2008,39(6):682-685.
[12]李守萍,程玉娥,唐明,等.油松菌根促生细菌—荧光假单胞杆菌的 分 离 与 鉴 定 [J]. 西 北 植 物 学 报,2009,29(10):2103-2108.
[13]彭帅,韩晓日,马晓颖,等.产葡萄糖酸荧光假单胞杆菌的分离鉴定及解磷作用[J].生物技术通报,2011(5):138-141.
[14]邓刚,屈星,陈秀蓉,等.甘肃番茄细菌性斑点病病原菌鉴定[J].植物保护,2008,34(5):47-51.
[15]Defago G,Haas D.Pseudomonads as antagonist of soilborne plant pathogens:modes of action and genetic analysis[J].Soil Biochemistry,1990,6:249-291.
[16]Keel C,Schnider U,Maurhofer M,et al.Suppression of root diseases by Pseudomonas fluorescens CHA0:importance of the bacterial secondary metabolite2,4-diacetylphloroglucinol[J].Molecular Plant-Microbe Interactions,1992,5(1):4-13.
[17]Ursula Schnider,Christoph Keel,Caroline Blumer,et al.Amplification of the housekeeping sigma factor in Pseudomonas fluorescens CHAO enhance antibiotic production and improves biocontrol abilities l[J].Journal of Bacteriology,1995,9:5387-5392.
[18]王金生.植物病原细菌学[M].北京:中国农业出版社,2000.

