小麦黄花叶病毒外壳蛋白基因RNAi表达载体的构建及遗传转化
赵晓娟, 刘 艳, 王锡锋
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
小麦黄花叶病毒(Wheat yellow mosaic virus ,WYMV)是马铃薯Y病毒科(Potyviridae)大麦黄花叶病毒属(Bymovirus)的成员。小麦黄花叶病最早于1927年由Sawada在日本发现并描述[1],病株上产生褪绿条纹、花叶、矮化、分蘖减少等症状[2],由根肿菌纲的禾谷多黏菌(Polymyxa graminis)以持久性方式传播。此病害自20世纪70年代开始大发生至90年代以来,每年发生面积都超过66万hm2;2005年仅江苏省发病面积就高达4.636万hm2,危害日趋严重,已成为危害中国小麦生产的一种重要病毒病害[3]。
RNA沉默这种现象在生物界中普遍存在[4-6]。外源基因随机整合到宿主细胞产生dsRNA,随后被酶Dicer-1(CG64792,DCRI)切割生成siRNA[7],siRNA作用于同源mRNA分子发生特异性的降解作用,引起转录后水平的基因沉默。siRNA可结合在靶mRNA上,作为引物在依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)的作用下合成新的dsRNA,重复上述过程,使RNAi的作用级联放大[8-9]。RNAi具有高效性、快速性、特异性、依 赖 ATP 参 与 反 应[10]、传 播 性[11]、遗 传性[12-13]等特点。
目前对于WYMV还没有有效的化学防治药剂,主要的防治措施是种植抗病品种,但是常规的抗病育种由于抗源材料少和育种周期长而效果欠佳。本研究依照RNAi原理设计了有 WYMV CP介导的RNA干涉的dsRNA前体,构建发夹结构,连接到适合禾本科植物转化的载体pWMB006上。与含有选择标记bar基因的载体pAHC20,利用基因枪方法共转化小麦幼胚愈伤组织,希望获得剔除共转化标记基因的抗WYMV小麦植株。
1 材料与方法
1.1 材料
WYMV南京分离物由本实验室2009年3月采集自江苏省农业科学院试验农场,采集的样品带回后进行RT-PCR和ELISA检测确认为WYMV病株。大肠杆菌:JM110;转基因小麦的受体品种为江苏里下河农科所的品种‘扬麦12号’。质粒载体:pWMB006、pAHC20,由中国农业科学院作物研究所惠赠。
Taq E、dNTPs、pMD18-T simple vector试剂盒都购自TaKaRa生物技术公司。DNA限制性内切酶、T4DNA连接酶、高保真DNA聚合酶都购自NEB(北京)生物技术有限公司。无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司。植物凝胶购自Sigma公司。试验所用的pGEM T-easy载体,购自Promega生物技术公司,感受态细胞DH 5α购自北京全式金生物公司。DNA凝胶回收试剂盒和质粒DNA小量提取试剂盒购自Axygen试剂公司。可裂膜、金粉、阻挡网、载体膜均购自BIORAD(伯乐)公司。
1.2 方法
1.2.1 引物设计
WYMV CP基因序列保守,GC含量较高,适宜作为干扰片段。
依据WYMV的基因组序列(GenBank登录号:AJ130983),设计扩增CP基因的引物,SEQ No.1:5′GCA GCT GAC ACA CAA AC 3′、SEQ No.2:5′GGT TAG TTC TGG GTG TCC 3′。扩增出的全长CP基因片段预计大小为879bp。
根据pWMB006载体上存在的多克隆位点分析,利用XhoI、NheI可以将目的基因的正向片段连接到载体;而利用SpeI、SacI可以将目的基因的反向片段连接到载体。依照RNAi的机制,设计带有酶切位点部分CP基因的RNAi引物,正义链(酶切位点XhoI、NheI):SEQ No.3:5′CCG CTC GAG ATG CCC TCA TTC CC 3′;SEQ No.4:5′CTA GCT AGC GCA GCT GAC ACA CAA AC 3′。反义链(酶切位点SpeI、SacI):SEQ No.5:5′CGA GCT CAT GCC CTC ATT CCC 3′、SEQ No.6:5′GAC TAG TGG TTA GTT CTG GGT GTC C 3′。
1.2.2 干扰载体的构建
首先将pWMB006载体用XhoI、NheI内切酶切成线性片断,与同样经XhoI、NheI酶切割目标片段得到正向片断,用T4连接酶连接到pWMB006载体的正义链位点,即形成正义链载体pWMB006sCP。然后在正义链载体的基础上继续构建反义链载体,即用SpeI、SacI内切酶分别酶切反向片断和正义链载体,再用T4连接酶两个线性片段连接到一起,最终构建成干扰载体pWMB006DsCP。同样的原理,用SpeI、SacI内切酶分别酶切反向片断和pWMB006载体,用T4连接酶两个线性片段连接,得到反义链载体pWMB006asCP(图1)。
1.2.3 基因枪法介导的遗传转化
采集授粉14d左右的‘扬麦12’小麦幼穗,将其幼胚接种于SD2固体培养基上。26℃恒温培养箱内,黑暗培养诱导愈伤组织,7d后转移到0.4mol/L渗透压培养基(SD2+甘露醇0.2mol/L+山梨醇0.2mol/L)正中央,渗透处理4~6h,以备基因枪轰击之用。
质粒DNA与共转化载体pAHC20(图2)以1∶1的比例混合均匀,制成微弹,用基因枪进行轰击(射击参数:距离为6cm,气压7584.5kPa)。轰击后的愈伤组织在原培养基上培养16~18h,转移到SD2培养基上,恢复培养2周。将愈伤组织转移到筛选分化培养基(1/2MS+1mg/L NAA+1mg/L KT+2mg/L Bialaphos)上诱导分化。待愈伤组织出现绿芽分化后,将其转到无激素的1/2MS培养基上。待苗高1~2cm时转移到移壮苗培养基(1/2MS+0.5mg/L IAA+5mg/L Bialaphos)上壮苗。苗高6~8cm的植株,且根系生长较好时,移入花盆置于温室培养。
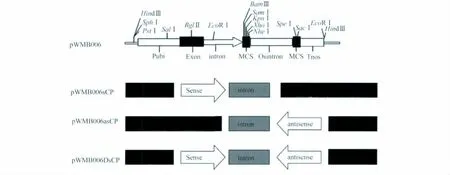
图1 试验设计中的4个载体结构示意图Fig.1 Schematic diagram of the structures of the four vectors designed in this study

图2 含有选择标记基因(bar)的共转化载体pAHC20结构示意图Fig.2 Schematic diagram of the structure of the cotransformation vector pAHC20with selective marker gene(bar)
1.2.4 T0代转基因小麦的PCR检测
基因枪转化后,经组织培养得到4个载体的转化植株,每株分别采样,提取叶片的DNA进行PCR检测。PCR扩增体系如下:r Taq 0.2μL;10×PCR Buffer 2.5μL;dNTP Mixture(各 2.5mmol/L)2μL;上游引物和下游引物(10μmol/L)各1μL;DNA(10ng/μL)1μL,加ddH2O补足25μL。PCR扩增程序:94 ℃ 3min;(94 ℃ 30s,60 ℃ 30s,72℃45s),35个循环;72℃10min。1.5%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 WYMV CP基因正向与反向片段的获得
从WYMV南京分离物中扩增CP基因,得到的阳性克隆,测序结果与GenBank登录号为AJ130983的浦江分离物序列相同。以SEQ No.3、SEQ No.4为引物扩增带有酶切位点的正向片段,以SEQ No.5、SEQ No.6为引物扩增反向片段(图3)。得到879bp的目标片段,目的片段回收后连到pMD-18T simple载体中。

图3 RT-PCR扩增得到的CP基因Fig.3 CP gene amplified by RT-PCR
2.2 干扰载体的构建及酶切验证
将含目的片段的T载体用XhoI、NheI双酶切,回收得到含XhoI、NheI酶切位点的目的片段,与同样经XhoI、NheI双酶切的空载体pWMB006用T4连接酶连接,转化大肠杆菌中,挑取单克隆进行测序和酶切验证。得到的阳性克隆经SpeI、SacI双酶切,用T4连接酶将其与SpeI、SacI酶切的反向片段连接,最终构建成干扰载体pWMB006DsCP。并对干扰载体进行酶切验证,确认得到了含正反义片段的植物干涉表达载体。
2.3 转基因再生植株的获得
以‘扬麦12’的幼胚为受体,进行基因枪转化。转化后的愈伤组织进行诱导分化(图4)、筛选、壮苗得到长势旺盛的植株(图5)。待苗高6~8cm,根系生长较好时,移入花盆中,置于温室培养。

2.4 转化植株T0代的PCR检测
本研究获得了4个载体的转基因小麦pWMB 006DsCP、pWMB006asCP、pWMB006sCP和 pWMB006的再生植株。PCR鉴定转基因小麦的T0代结果为:4个载体的T0代转基因阳性小麦株数分别是15、8、3、5株,相应的转化率分别是1.00%、0.68%、0.27%、1.46%(表1)。
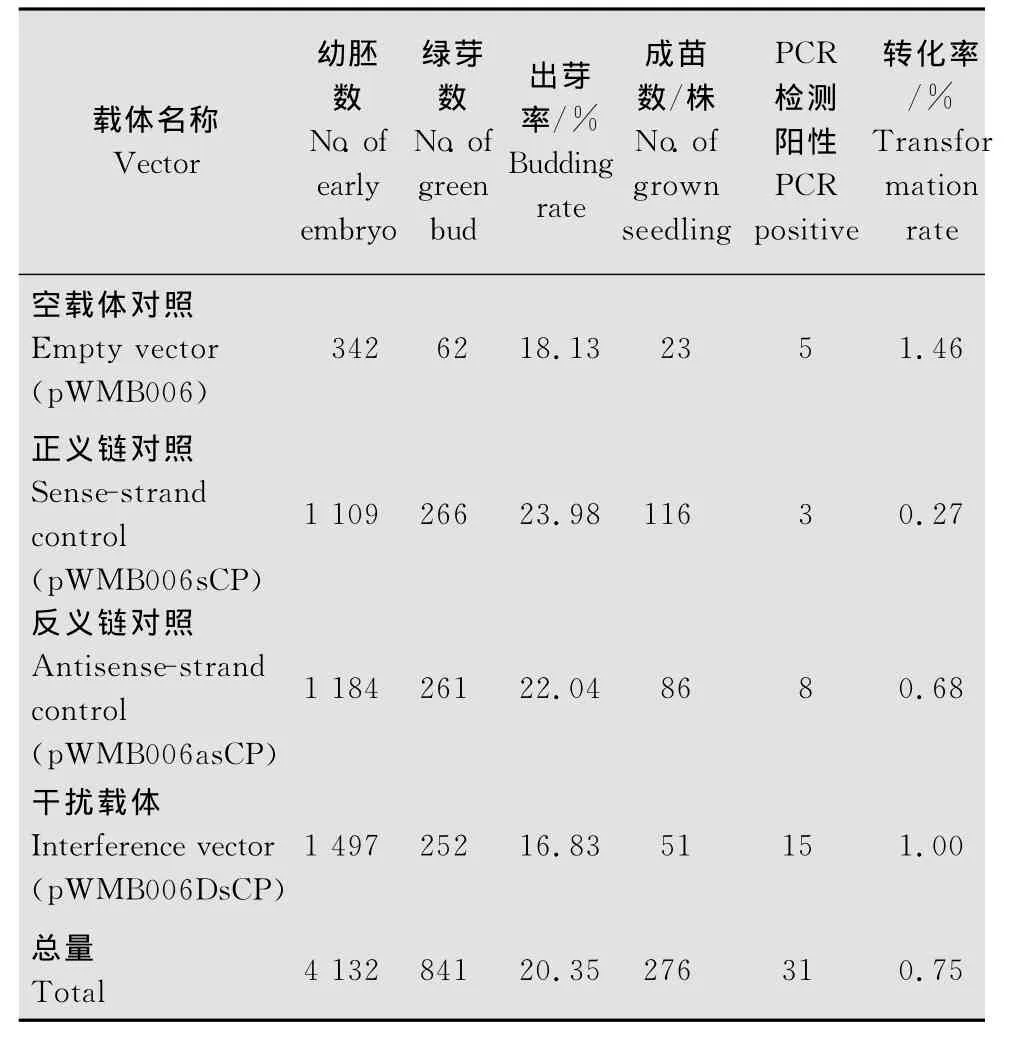
表1 T0代植株转化试验结果Table 1 Experimental results of T0transgenic plants
3 讨论
利用RNA干扰机制进行植物抗病基因工程研究,是目前植物抗病毒研究领域的热点。将病毒基因序列设计成反向重复结构,使其在转基因寄主细胞内转录形成具有双链结构的“发夹RNA”(hairpin RNA,hpRNA),即茎环结构,可强烈诱导寄主的RNA沉默并显著增强植物抵抗同源病毒的能力[14-15]。在利用发夹结构载体转化已经获得多例单种病毒高效抗性的成功经验的基础上[16-17],科学家们又尝试利用多种病毒的保守序列串联构建发夹结构载体,以达到获得兼抗多种病毒的转基因植株的目的[18-19]。一般来说,CP基因在各自的病毒中都具有高度的保守性,因此成为抗病毒基因工程的首选策略。自1986年报道首例转TMV CP基因获得抗病性植株以后[20],已有10多个属30余种病毒进行了转CP基因研究,涉及烟草、番茄、南瓜等多达几十种受体植物,其中大多数转入CP基因的植株对病毒或同属病毒具有一定程度的抗性[21-22]。
由禾谷多黏菌以持久性方式传播的小麦黄花叶病毒在世界许多国家和地区大、小麦区均有发生,是一种全球性的病毒病害,造成大、小麦生产的严重危害并且尚无有效的防治措施。培育抗病品种是科学家长期以来的研究目标。本研究以WYMV的CP基因为沉默的靶标基因,根据病毒CP基因序列设计引物,构建适合单子叶植物转化的RNAi植物表达载体,通过基因枪介导法导入小麦愈伤组织,通过诱导转基因小麦植株产生RNA干扰作用,最终获得抗WYMV的小麦基因工程植株。
为避免转基因后代的生物安全问题,本研究采用的是目的基因和标记基因质粒共转化策略。基因枪转化后两个转化载体在减数分裂过程中,标记基因和目的基因发生分离,从而可以剔除选择标记基因,通过PCR检测可以筛选到只含功能基因而不含标记基因的转基因小麦。另外,小麦基因组是异源六倍体,基因组非常复杂。基因枪的转化方法随机性较大,转基因后代拷贝数目不等、插入位点也会存在偶然性。目的基因整合到小麦基因组后,还存在着基因沉默、后代分离等现象。因此,通常需要对得到的转基因植株后代从转录、翻译不同水平进行验证,以确定目的基因是否稳定表达。本试验得到了转WYWV-CP的T0代阳性植株,取得了阶段性的结果,T1代的转基因植株的分子检测和抗性鉴定正在开展之中。
[1] Sawada E.Wheat yellow mosaic prevention[J].Journal of Plant Protection,1927,14:444-449.
[2] 陈剑平,阮义理,董玛佳.我国一些地区发生的小麦土传病毒病原研究[J].病毒学杂志,1989(2):176-181.
[3] 王锡锋,刘艳,韩成贵,等.我国小麦病毒病害发生现状与趋势分析[J].植物保护,2010,36(3):13-19.
[4] Hammond S M,Bernstein E,Beach D,et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophilacells[J].Nature,2000,404:293-296.
[5] Plasterk R H,Ketting R F.The silence of the genes[J].Current opinion in Genetics and Development,2000(10):562-567.
[6] Matzke M,Matzke A J M,Kooter J M.RNA:Guiding gene silencing[J].Science,2001,293:1080-1083.
[7] Zamore P D,Tuschl T,Sharp P A,et al.RNAi:Double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21to 23 nucleotide intervals[J].Cell,2000,101(1):25-33.
[8] Winston W M,Molodowitch C,Hunter C P.Systemic RNAi in Caenorhabditis elegans requires the putative transmembrane protein SID-1[J].Science,2002,295:2456-2459.
[9] Verdel A,Jia S,Gerber S,et al.RNAi-mediated targeting of eterochromatin by the RITS complex[J].Science,2004,303:672-676.
[10]Nykanen A,Haley B,Zamore P D.ATP requirements and small interfering RNA structure in the RNA interference pathway[J].Cell,2001,107:309-321.
[11]Jorgensen R A,Atkinson R G,Forster R L S,et al.An RNA-based information superhighway in plants[J].Science,1998,279:1486-1487.
[12]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double stranded RNA in Caenorhabdits elegans[J].Nature,1998,391:806-811.
[13]Travella S,Klimm T E,Keller B.RNA Interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat[J].Plant Physiology,2006,142:6-20.
[14]Smith N,Singh S,Wang MB,et al.Total silencing by intronspliced hairpin RNAs[J].Nature,2000,407:319-320.
[15]Wesley S V,Helliwell C A,Smith N A,et al.Construct design for efficient,effective and high-throughput gene silencing in plants[J].The Plant Journal,2001,27:581-590.
[16]Wang M B,Abbott D C,Waterhouse P M.A single copy of a virus-derived transgene encoding hairpin RNA gives immunity to barley yellow dwarf virus[J].Molecular Plant Pathology,2000,1(6):347-356.
[17]Fahim M,Ayala-Navarrete L,Miller A A,et al.Hairpin RNA derived from viral NIagene confers immunity to wheat streak mosaic virus infection in transgenic wheat plants[J].Plant Biotechnology Journal,2010,8(7):821-834.
[18]Bucher E,Lohuis D,van Poppel P M,et al.Multiple virus resistance at a high frequency using a single transgene construct[J].Journal of General Virology,2006,87:3697-3701.
[19]Lin C Y,Ku H M,Chiang Y H,et al.resistance to a DNA and a RNA virus in transgenic plants by using a single chimeric transgene construct[J].Transgenic Research,2011,20(2):261-270.
[20]Beachy R N,Abel P P,Nelson R S,et al.Expression of genes encoding the TMV coat protein and 30-Kd protein in transformed Plants[J].Journal of Cell Biochemistry,1986:38-38.
[21]Baulcombe D C.Mechanisms of pathogen-derived resistance to viruses in transgenic plants[J].The Plant Cell,1996,8(10):1833.
[22]Chen X.Small RNAs-secrets and surprises of the genome[J].The Plant Journal,2010,61:941-958.

