骨髓干细胞分化的成骨样细胞与可降解镁合金体外相容性的研究
杨晓龙 李德华 李洪秀
随着生活节奏的加快,各种原因导致的骨组织损伤、缺损患者越来越多。目前临床治疗骨损伤的骨板、骨钉及植骨材料主要是不锈钢、钛合金及聚乳酸等。但这些材料不能降解需要二次手术取出,并且组织相容性差[1]。因此寻找力学性能好、组织相容性强,又可安全降解的新型骨组织工程支架材料意义重大。
最新发现表明镁合金具有良好的力学特性及人工可降解性,有望成为新型植骨材料,应用于骨损伤的固定及组织工程骨的支架材料[2]。但镁合金与细胞的生物相容性尚待探讨,其能否利于成骨细胞的生长增殖分化尚无定论。因此,本研究拟将骨髓干细胞诱导分化为成骨样细胞,并在体外与镁合金材料复合培养,检测成骨样细胞的形态、增殖能力及成骨分化情况,为镁合金的体外细胞相容性提供实验数据,为其能成为新型骨修复材料提供理论依据。
1 材料与方法
1.1 实验动物 健康清洁级SD大鼠20只,体质量100~150 g,雌雄不限,由辽宁医学院实验动物中心提供。
1.2 主要试剂 L-DMEM、H-DMEM、胎牛血清(Gibco),胰蛋白酶、β-甘油磷酸钠(Sigma),碱性磷酸酶染色试剂盒、ALP活度检测试剂盒(凯基生物)。
1.3 大鼠BMSCs的原代培养及向成骨样细胞分化 大鼠行颈椎离断法处死,无菌分离双侧股骨,含10%FBS的L-DMEM冲洗骨髓腔,接种至50 ml培养瓶中。37℃、5%CO2、饱和湿度条件下培养。每3 d换液,达80%融合时传代培养。
取P3的BMSCs,以0.5×105/孔的细胞悬液接种于铺有盖玻片的六孔板。待细胞达90%融合时更换成骨诱导培养液(含10%FBS的H-DMEM、10 mmol/L的β-甘油磷酸钠、10-7 mol/L地塞米松、5 mg/L抗坏血酸)。37℃、5%CO2、饱和湿度条件下培养,每3 d换液。
1.4 碱性磷酸酶(ALP)染色鉴定诱导后的成骨样细胞 当诱导后细胞达90%融合时,4%多聚甲醛固定,PBS漂洗。碱性磷酸酶染色(按试剂盒说明进行),封片,光学显微镜观察。
1.5 可降解镁合金材料样品的制备 将镁合金(重量百分比:Zn 1.2%,Mn 0.6%,Ca 2.0%)支架材料用PBS清洗并吹干,置于24孔培养板,紫外线照射消毒正反面各2 h,备用。
1.6 成骨样细胞与镁合金材料的复合培养 消化制备2×105/ml的成骨样细胞悬液,接种到置于24孔培养板中的镁合金支架材料表面,孵箱内复合培养。24 h、48 h、72 h后行戊二醛固定,洗涤,脱水,CO2临界点干燥、喷金后,扫描电子显微镜细胞形态。
1.7 制备镁合金支架材料浸提液 无菌条件下,按照材料表面积/浸提介质为0.003 cm2/L的比例,加入成骨诱导培养液至盛有镁合金支架材料的容器中。孵箱中孵育24 h后提取容器中的液体,即为浸提液,应用此浸提液进一步培养成骨样细胞。
1.8 MTT法检测浸提液培养的成骨样细胞增殖活性 消化制备1×104/ml的成骨样细胞悬液,接种至96孔板,培养24 h后,将培养液换为浸提液,对照组加入普通的成骨诱导培养液,分别培养 12 h、24 h、48 h、72 h 后,每孔加入 20 μl MTT(5 mg/ml),37℃孵育 4 h,每孔加 DMSO 150 μl,震荡,用酶联免疫仪选择570nm波长测定各孔的光吸收值。
1.9 检测浸提液培养的成骨样细胞ALP活度 消化制备1×105/ml的成骨样细胞悬液,接种至6孔板,培养24 h后,将培养液换为浸提液,对照组加入普通的成骨诱导培养液,分别培养12 h、24 h、48 h、72 h后,胰酶消化制成单细胞悬液,超声粉碎细胞,按ALP活度检测试剂盒说明书进行碱性磷酸酶活度的检测。
1.10 统计学分析 所有数据均用均数±标准差表示,用SPSS 13.0软件,采用One-way ANOVA进行数据分析。P<0.05为有显著性差异。
2 结果
2.1 骨髓干细胞分化为成骨样细胞的形态观察及鉴定 原代培养的骨髓干细胞逐渐伸展成长梭形,类似成纤维细胞,呈涡轮状紧密排列(图1)。加入成骨诱导培养液后,逐渐变成多角形,具有成骨细胞的形态特点,并聚集形成钙化结节(图2)。碱性磷酸酶染色显示成骨诱导后的细胞含有大量ALP,呈深棕黑色阳性表达(图3)。证实骨髓干细胞经成骨诱导后可分化为成骨样细胞,具有成骨细胞的形态和特性。

图1 原代培养的骨髓干细胞(相差显微镜×100)
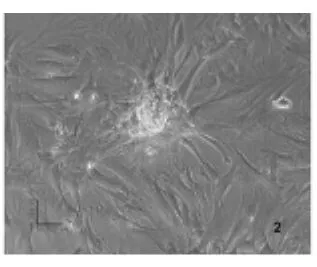
图2 骨髓干细胞诱导分化的成骨样细胞(相差显微镜×100)

图3 成骨样细胞的碱性磷酸酶染色(光镜×100)
2.2 扫描电镜观察 成骨样细胞黏附在较粗糙的材料表面,伸展成短梭形或多角形,并伸出突起,形成细胞连接,生长状态良好,增殖旺盛(图4)。表明支架材料具有明显的细胞相容性,适合细胞黏附生长。

图4 成骨样细胞与支架材料复合培养(扫描电镜×100)
2.3 MTT法检测细胞增殖活性 结果显示随着培养时间的延长,两组的吸光度都逐渐增高(P<0.05),表明浸提液与普通成骨诱导培养液均可保证成骨样细胞正常生长,经历了潜伏期和对数生长期。而在相同时间点两组的吸光度并未有明显差异(P>0.05),表明浸提液培养的成骨样细胞具有正常的增殖活性,并未受到抑制,浸提液没有明显的细胞毒性(图5)。

图5 成骨样细胞的MTT值
2.4 ALP活度检测 结果显示随着培养时间的延长,两组的细胞的ALP活度都逐渐增高(P<0.05),表明浸提液与普通成骨诱导培养液一样可以促进成骨样细胞分泌碱性磷酸酶。而在相同时间点两组的ALP活度并未有明显差异(P>0.05),表明浸提液培养的成骨样细胞可以维持其正常的成骨活性(图6)。

图6 成骨样细胞的ALP活度值
3 讨论
Friedenstein等[3]发现骨髓干细胞在一定条件下可分化为成骨细胞,表达成骨细胞表型,骨髓干细胞成功活跃在骨组织工程领域。本研究采用全血培养法分离SD大鼠股骨骨髓,培养的骨髓干细胞呈长梭形,增殖能力强,具有间充质干细胞的特性。在成骨诱导液培养下骨髓干细胞变为多角形并形成钙结节,经碱性磷酸酶染色发现诱导后的细胞呈深棕色阳性表达,我们认为其具有成骨细胞的形态及生物学特性,可以称为成骨样细胞,符合成骨细胞分泌有机成分和矿物质的鉴定指标[4]。
支架材料是组织工程领域的三大要素之一,必须具备良好的组织相容性和可降解性,促进细胞的黏附和生长。作为骨组织工程的支架材料还要富于一定的韧性和硬度,因此近年来镁合金作为可降解的新型骨组织工程支架材料备受关注[5]。其具有高分子化合物独特的可降解性,又兼有金属材料的坚韧性。数据表明高强度镁合金的比强度可以达到480 gPa/(g/cm3),密度约为1.7 g/cm3,与人的骨密度(1.75 g/cm3)较接近,符合理想的骨板要求;镁合金的弹性模量是45 gPa,而人骨弹性模量为 20 gPa,足以满足人植骨的要求[6]。大量研究又表明作为骨固定材料镁合金可以加速损伤骨质愈合,抑制局部骨质疏松的发生[7,8]。
目前对于支架材料的评价包括体内和体外两种。体外实验是将细胞或组织与支架材料或支架浸提液复合培养,检测细胞生长、增殖及功能等相关指标,比体内实验更具有可控性、可重复性、可定量分析等优点[9],是评价支架材料组织相容性的重要依据。因此本研究将诱导成功后的成骨样细胞与镁合金复合培养,经扫描电镜观察发现材料表面有大量细胞附着,生长状态良好,表明此支架材料有利于成骨样细胞的黏附生长。检测浸提液培养下细胞的增殖活性,有助于考察支架材料的毒性[10]。MTT法操作简单、灵敏度高、重复性好是检测细胞增殖活性的主要方法。本实验结果表明经浸提液培养的成骨样细胞仍具有旺盛的增殖潜能,说明镁合金支架材料不具有细胞毒性。本实验又应用ALP活度检测试剂盒检测浸提液培养细胞的成骨分化情况,发现浸提液培养的细胞与正常培养液组的碱性磷酸酶活度并未出现明显差异,说明镁合金材料的浸提液与正常成骨诱导液一样,也可以促进成骨样细胞的成骨分化,具有明显的骨诱导能力。
本实验探讨了镁合金材料在体外促进成骨样细胞的增殖和分化情况,但关于镁合金植骨材料在动物体内组织中能否促进骨组织再生,有待于后续的体内实验进行证实。
[1]Liu Zhendong,Fan Qingyu.Stress shield effect-search the lost key.Chinese Journal of Orthopaedic Trauma,2002,4(1):62.
[2]Li LC,Gao JC.Evaluation of cyto-toxicity and corrosion behavior of alkali-heat treated magnesium in simulated body fluid.Surf Coat Techn,2004,185(1):92.
[3]Shih CH,Nien J C,Shie LH,et al.Isolation and characterization of size-sieved stem cells from human bone marrow.Stem cells,2002,20(1):249-258.
[4]Pan Feng;BAI Shu-ling.Experimental Study on the Differentiation of Cultured Bone Marrow Stromal Stem Cells(BMSCs)of Rabbit into the Osteoblast in Vitro.Progress of Anatomical Sciences,2005,11(1):12-15.
[5]Simion M,Fontana F.Autogenous and xenogeneic bone grafts for the bone regeneration.Minerva Stomatol,2004,53:191-206.
[6]Mark P Staiger, Alexis M Pietak, J erawala Huadmai,et al.Magnesium and its alloys as orthopedic biomaterials:a review.Biomaterial,2006,27(9):1013.
[7]Saris NE,Mervaala E,Karppanen H,et al.Magnesium:an update on physiological,clinical and analytical aspects.Clin Chim Acta,2000,294(1-2):1-26.
[8]Dai Kerong.Fracture fixation and stress shield effect.Journal of Medical Biomechanics,2001,15(2):69.
[9]Witte F,Kaese V,Haferkamp H,et al.In vivo corrosion of four magnesium alloys and the associated bone response.Biomaterials,2005,26(17):3557-3563.
[10]Sun J,Li J,Liu X,et al.Proliferation and gene expression of osteoblasts cultured in DMEM containing the ionic products of dicalcium silicate coating.Biomed Pharmacother,2009,63(9):650-657.

