硫丹及其主要代谢产物对紫色土中酶活性的影响
熊佰炼,张进忠,2,* ,代 娟,邢 赜,徐卫红
(1.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.重庆市农业资源与环境重点实验室,重庆 400716)
硫丹(endosulfan)是一种广泛使用的有机氯农药,2011年被列入持久性有机污染物(POPs)控制清单[1]。我国从1994年开始生产和使用硫丹,多年的施用使得我国大部分地区土壤中都有不同程度的硫丹残留和积累[2-3]。土壤酶是土壤生化反应的重要催化剂,对土壤物质代谢和养分转化都有显著影响[4-5]。土壤酶对环境变化非常敏感,可以作为预警土壤环境质量变化和外源性化学污染物的生物指标[6-7]。硫丹在土壤中的残留势必影响土壤酶活性,相关研究主要涉及的土壤酶有脱氢酶、荧光素二乙酸脂水解酶、酸性磷酸酶、碱性磷酸酶、固氮酶、芳基硫酸酯酶和β-d-葡萄糖苷酶等[8-9]。但是,关于硫丹及其主要代谢产物(硫丹硫酸盐和硫丹二醇)对土壤脲酶、硝酸还原酶和多酚氧化酶活性的影响尚不清楚,且未见报道。
土壤脲酶催化尿素水解成CO2和NH3,常作为土壤响应环境干扰的重要指标[10-12]。硝酸还原酶催化硝态氮还原为亚硝态氮,是反硝化过程中的一种重要酶,参与土壤氮素循环[13-14]。土壤多酚氧化酶将木质素分解产生的酚类物质氧化为醌类物质,随后形成腐殖质等有机物,其活性高低与土壤有机质的形成和腐殖化程度密切相关[15-16]。紫色土是长江上游最常见的土壤类型,分布区地形多为丘陵、低山,土壤有机质含量普遍不高,水土流失较为严重[17],该地区在防治农作物虫害时大量施用硫丹[2],使得土壤中硫丹残留较为严重[3]。为此,本研究采用室内避光培养实验,模拟研究硫丹及其主要代谢产物(硫丹硫酸盐和硫丹二醇)对紫色土中上述3种酶活性的影响,为探讨硫丹对土壤环境质量的影响和评估农药施用的生态风险提供科学依据。
1 材料与方法
1.1 供试土壤
供试紫色土采自西南大学实验农场0—20 cm土层,该农场无使用硫丹类农药的历史,且未检出硫丹及其代谢产物。采集的土壤样品经自然风干、研磨、分别过1 mm和0.25 mm筛后备用,其基本理化性质见表1。

表1 供试土壤的基本理化性质(0—20 cm土层)Table1 Basic physicochemical property of the tested soil(0—20 cm depth)
1.2 主要试剂和材料
α-硫丹(98%)、β-硫丹(98.7%)标准品购自美国Sigma公司;硫丹硫酸盐(98.5%)、硫丹二醇(99.4%)标准品购自德国Dr.Ehrenstorfer公司;
硫丹原药购自河南春光农化有限公司,纯度为96%,经测定α、β-硫丹的质量比为62.66∶37.34;
乙腈、甲醇均为色谱纯(美国Thermo Fisher公司);其余试剂均为分析纯;
Florisil固相萃取小柱(美国Welch公司):500 mg/6 mL,用前经正己烷活化。
1.3 实验步骤和方法
1.3.1 土壤培养与酶活性测定
向过0.25 mm筛的土壤中加入溶于石油醚的硫丹原药,充分搅拌混匀,待石油醚完全挥发后,得到质量浓度为1.00 g/kg的硫丹污染母土。在过1 mm筛的土壤中加入适量的污染母土,多级稀释混匀,使土壤中原药浓度分别为0、5、10、20和100 mg/kg,得到CK、T1—T4共5种处理。称取制得的土样300 g,调节含水量至田间最大持水量的60%,装入广口瓶中,盖上棉塞,在(25±1)℃的生化培养箱中避光培养,每个处理做3次重复。培养过程中用高温灭菌去离子水补水,维持土样含水量的恒定。第5、10、15、20、30和60天时采集土样,立即测定土壤酶活性。脲酶、硝酸还原酶和多酚氧化酶的活性分别用尿素残留法、邻苯三酚比色法和酚二磺酸比色法测定[18],设置无土壤的底物和无底物的土壤为对照。上述方法测定脲酶、硝酸还原酶和多酚氧化酶活性的相对标准偏差(RSD)分别为5.1%、4.2%和4.4%(n=5)。
1.3.2 土壤中硫丹及其代谢产物的提取与净化
土壤中硫丹及其代谢产物的提取在马辉等[19]和Kumar等[20]方法的基础上加以改进。在培养0、5、10、15、20、30和60 d时称取相当于20 g干土的培养土样,加入50 mL丙酮,超声提取30 min,Whatman 42号定性滤纸过滤,用少量丙酮多次洗涤滤渣,全部滤液转移至分液漏斗中,加入10%的NaCl溶液100 mL,分别用50、50和30 mL石油醚振荡提取3次,每次振摇5 min以上,静置分层,弃去下层丙酮水互溶相。提取液经无水Na2SO4柱脱水后转移至旋蒸瓶,40°C水浴减压浓缩至近干,加入2 mL石油醚,旋涡振荡溶解。将2 mL浓缩液转移至预先活化的Florisil固相萃取小柱,用10 mL甲苯/正己烷(65∶35)淋洗,收集流出液,氮气吹干,准确加入2 mL乙腈,涡旋振荡溶解,供高效液相色谱(HPLC)分析。
1.3.3 硫丹及其代谢产物的测定与质量控制
采用 HPLC(Shimadzu Sil-20A)分离、SPD-20A检测器测定硫丹及其代谢产物的含量。色谱柱:DiamonsilTM(钻石二代)C18液相色谱柱(4.5μm,250 mm ×4.6 mm);流动相:乙腈∶水(70∶30体积分数),等度洗脱,流速为1.0 mL/min;进样体积20μL;检测波长214 nm[21];外标法定量。α、β-硫丹、硫丹硫酸盐和硫丹二醇的检测限均为0.1 mg/L,4种化合物在6个加标水平获得的平均回收率分别为96.67%、95.17%、95.33%和97.50%,相对标准偏差(RSD)分别为6.91%、6.03%、6.81%和7.24%。
1.4 数据处理
采用SPSS 16.0对实验数据进行拟合、Pearson相关分析和偏相关分析,Origin 8.5软件绘图。
2 结果与分析
2.1 硫丹在紫色土中的降解过程
α、β-硫丹、硫丹硫酸盐和硫丹二醇浓度随时间的变化过程如图1所示。从图1可以看出,土壤中α、β-硫丹的浓度均随培养时间的增加而逐渐减少;前20 d硫丹硫酸盐浓度增加较快,30 d后基本趋于稳定;硫丹二醇浓度呈现先增加后减小的趋势,在15 d时达到最大。

图1 土壤中硫丹及其代谢产物浓度随时间的变化Fig.1 Variations of the concentrations of endosulfan and its metabolites in soil with time
采用一级反应动力学模型拟合土壤中硫丹随培养时间的降解过程,获得如表2所示的结果。一级降解反应动力学方程为:

土壤中硫丹的半衰期为:

式中,t为降解反应时间(d);C0和Ct分别为土壤中硫丹的初始浓度和t时刻的浓度(mg/kg);k为反应速率常数(d-1)。
从表2可以看出,可用一级反应动力学模型描述α-、β-硫丹在紫色土中的降解过程,获得的决定系数在0.935—0.995之间。硫丹初始浓度对降解反应速率常数有一定影响,T1—T3处理时α-硫丹的降解速率常数相差不大,T4处理的速率常数明显变小;T2—T4处理的β-硫丹降解速率常数十分接近,明显小于T1处理的0.01/d。获得α-、β-硫丹的半衰期分别为32—99 d和69—116 d,高浓度的硫丹在紫色土中降解更慢。
2.2 硫丹处理对土壤酶活性的影响
硫丹处理对土壤酶活性的影响如图2—图4所示。从图2可知,CK处理时脲酶活性为0.13—0.14 mg·g-1·24 h-1;添加硫丹的初始浓度越大,脲酶活性越低。第5天时,T1处理对脲酶起激活作用,较CK增加20.0%(n=3,P<0.05),T2处理对脲酶也表现出激活作用,但与CK差异不显著;除此之外,硫丹处理对脲酶不再表现出激活作用。第5—20天时T1—T3处理脲酶活性随时间发生波动,且大部分与CK差异不显著,仅T3处理在第10天时较CK下降16.2%(n=3,P<0.05);第20—60天时T1—T3处理脲酶活性随时间持续下降,第60天时受到明显抑制,较CK分别下降19.2%、34.8%和46.9%(n=3,P<0.01)。T4处理对脲酶活性有强烈的抑制作用,第5、10、15、20、30和60天时分别下降94.5%、85.0%、68.8%、90.1%、56.7%和71.9%(n=3,P <0.01)。

表2 土壤中α、β-硫丹降解的动力学方程(n=7)Table 2 Dynamic equations of endosulfan degradation in soil
从图3可知,CK处理时硝酸还原酶活性为0.950—1.161 mg·g-1·24 h-1。T1处理,第5天对硝酸还原酶起激活作用,较CK增加12.3%(n=3,P<0.05);第20和60天,酶活性与CK差异不显著。除此之外,硫丹处理对硝酸还原酶活性表现出明显的抑制作用,抑制作用随添加硫丹初始浓度的增加而逐渐增强。T1—T3处理酶活性变化的趋势基本相同,说明这3个处理对硝酸还原酶活性的作用机理可能相同;T4处理第5、10、15、20、30和60天时酶活性较CK分别下降54.8%、70.1%、72.8%、84.3%、88.8%和89.9%(n=3,P <0.01),表明高浓度硫丹对酶活性的作用方式可能发生了变化。

图2 硫丹对土壤脲酶活性的影响Fig.2 Effect of endosulfan on urease activity in soil图中数据为¯x±S

图3 硫丹对土壤硝酸还原酶活性的影响Fig.3 Effect of endosulfan on nitrate reductase activity in soil
从图4可知,CK处理时多酚氧化酶活性为0.57—0.72 mg·g-1·2 h-1,除T4处理的酶活性峰值出现在第15天,T1—T3处理均出现在第20天。T1处理对多酚氧化酶表现出一定的抑制作用,第10、15、30和60天时酶活性较CK分别下降12.6%、12.3%、25.3%和22.7%(n=3,P<0.05),但第5和20天时对酶活性影响不显著。T2处理对多酚氧化酶活性的影响不大,仅第60天时表现出较强的抑制作用,酶活性较CK下降14.2%(n=3,P<0.01)。T3处理对多酚氧化酶活性的影响随时间变化较大,表现为“无显著影响(第5天)—激活(第10、15、20天)—无显著影响(第30天)—抑制(第60天)”的变化趋势。第 5、10、15、20和 30天,T4处理对多酚氧化酶起激活作用,酶活性较CK分别增加92.6%、93.6%、139.9%、83.8%和 31.3%(n=3,P<0.01);第60天,多酚氧化酶活性恢复到CK水平。总体来说,随着添加硫丹初始浓度的增大,多酚氧化酶活性呈“抑制(T1处理)—无影响(T2处理)—激活(T3和T4处理)”的变化趋势。
2.3 硫丹残留与土壤酶活性的关系
硫丹在土壤中以多种途径转化,硫丹硫酸盐和硫丹二醇是其主要代谢产物。将酶活性与硫丹及其主要代谢产物浓度进行Pearson相关分析和偏相关分析,结果见表3。

图4 硫丹对土壤多酚氧化酶活性的影响Fig 4 Effect of endosulfan on polyphenol oxidase activity in soil
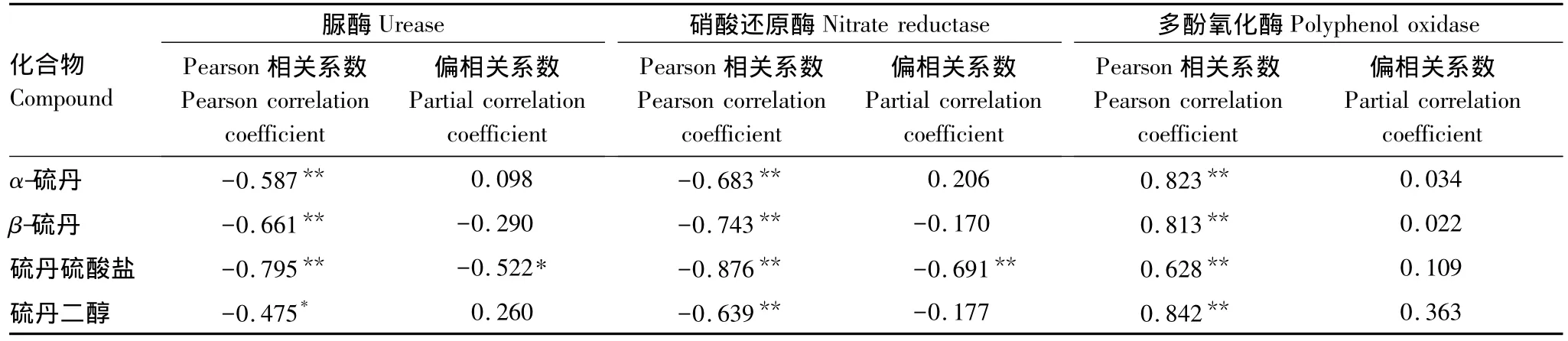
表3 土壤酶活性与硫丹及其代谢产物浓度的相关关系Table 3 Correlations between the enzyme activity and the concentration of endosulfan and its metabolites in soil
从Pearson相关系数来看,土壤脲酶和硝酸还原酶活性与α-、β-硫丹、硫丹硫酸盐和硫丹二醇浓度均呈显著负相关,多酚氧化酶活性与其呈显著正相关。可见,土壤中这4种化合物对脲酶和硝酸还原酶活性均起抑制作用,对多酚氧化酶活性起激活作用。但是,当多个影响因素同时存在时,Pearson相关分析不能真实反映变量间的相关关系。因此,在考察土壤酶活性与硫丹或其代谢产物浓度的相关关系时,需要控制其它变量的影响,进行偏相关分析。
从表3的偏相关分析结果可以看出,脲酶活性与α-、β-硫丹和硫丹二醇浓度间的偏相关系数均未达到显著水平,表明这3种化合物单独作用时对脲酶活性的影响均不大;脲酶活性与硫丹硫酸盐浓度间的偏相关系数为-0.522,呈显著负相关,对脲酶活性起抑制作用。硝酸还原酶活性与α-、β-硫丹和硫丹二醇浓度的偏相关性不显著,表明这3种化合物单独作用时对其活性的影响较弱;硝酸还原酶活性与硫丹硫酸盐间的偏相关系数为-0.691,呈显著负相关,对硝酸还原酶活性起抑制作用。多酚氧化酶活性与α-、β-硫丹、硫丹硫酸盐和硫丹二醇浓度间的偏相关系数均未达到显著水平,表明这4种化合物单独作用时对多酚氧化酶活性的直接影响较小。
3 讨论
在农业土壤环境中,农药的迁移转化主要有挥发、淋溶、水解、光解、微生物降解和生物吸收等途径,其中许多过程不受农药初始浓度的影响,符合一级反应动力学特征,半衰期通常是一个常数[22]。但本研究中α-、β-硫丹的半衰期分别为32—99 d和69—116 d,随硫丹初始浓度不同而发生改变。Awasthi等[23]的研究也表明,硫丹在土壤中的降解速率会随其初始浓度的增加而减慢。其原因可能是在室内培养条件下,土壤微生物和酶活性是影响硫丹降解的主要因素。硫丹具有生物毒性,高浓度硫丹处理对微生物和酶活性的毒害作用更大,抑制了微生物和酶对硫丹的降解。
脲酶活性与α-、β-硫丹和硫丹硫酸盐浓度间的Pearson相关系数(-0.587、-0.661和-0.795)大于偏相关系数(0.098、-0.290和-0.522),表明这3种化合物同时存在时对脲酶活性的影响比其单独存在时强。Soto等[24]和Wan等[25]的研究表明,α-、β-硫丹和硫丹硫酸盐对陆生和水生生物、人体的联合毒性高于单一化合物,表现出毒性的协同作用。由此看来,α-、β-硫丹和硫丹硫酸盐共存时对脲酶活性的抑制作用高于单一化合物,使得硫丹处理能显著降低土壤脲酶的活性。但是,图2中T1处理5 d时脲酶活性高于CK,表现出激活作用,与相关分析获得的结论不符。这可能是因为土壤中存在两种形式的脲酶[26]:一是吸附在土壤有机质和土壤矿物中的胞外脲酶;二是以游离态存在于微生物细胞中的胞内脲酶。有机氯农药对微生物具有毒性,可破坏甚至杀死土壤微生物细胞,使部分胞内脲酶释放出来,增大脲酶的浓度,进而增强土壤中脲酶的活性[27]。T1处理5 d时,硫丹及其代谢产物可能破坏微生物细胞,释放出的胞内脲酶增加了土壤中的酶浓度,导致脲酶活性比CK大。随着培养时间的增加,不适应硫丹胁迫的微生物细胞被全部破坏,适应硫丹胁迫的微生物不再释放胞内脲酶,硫丹处理对脲酶活性不再表现出激活作用。T2、T3和T4处理5 d时脲酶活性未表现激活作用,可能与硫丹的浓度较高有关。Nasreen等[28]的研究表明,硫丹施用量为1.0—7.5 kg/hm2(约为10—75 mg/kg[29])时对黑粘土(Black clay soil)中脲酶起激活作用,本研究却发现10—100 mg/kg硫丹处理可抑制紫色土中脲酶活性;当硫丹浓度增大到10.0 kg/hm2(约为100 mg/kg[29])时,对脲酶活性的影响由激活转向抑制[28],与本研究100 mg/kg硫丹抑制紫色土中脲酶活性的结果一致。Sannino等[30]发现,在同一种农药(草甘膦或百草枯)的作用下,不同类型土壤中脲酶活性出现被抑制和激活的两种截然不同结果。由此看来,硫丹对土壤脲酶活性的影响可能与土壤类型有关。
硝酸还原酶活性与β-硫丹、硫丹硫酸盐和硫丹二醇浓度间的Pearson相关系数(-0.743、-0.876和-0.639)大于偏相关系数(-0.170、-0.691和-0.177),表明这3种化合物同时存在时对硝酸还原酶活性的抑制作用强于单一化合物,对酶活性的影响类似于毒物之间的协同作用。图3中T1处理5 d时硝酸还原酶活性高于CK,其原因还有待进一步研究。硫丹影响土壤酶活性可长达数月,作用结果表现为持续抑制、持续激活、激活与抑制作用随时间变化等3种形式[8-9,31-32]。Kalyani等[9]发现,硫丹在98 d内可持续抑制土壤固氮菌产生的固氮酶。Buff等[33]认为,硫丹可以吸附于固氮菌细胞膜,并进入细胞内部与胞内蛋白质结合,对固氮菌产生毒害作用,抑制固氮酶活性。图2和图3中60 d内土壤脲酶和硝酸还原酶活性受到持续抑制,偏相关分析表明起抑制作用的主要是残留期比母体化合物更长的硫丹硫酸盐,这两种酶活性的抑制作用机理是否类似于硫丹持续抑制固氮酶活性,还需要进一步研究。
Pearson相关分析表明,多酚氧化酶活性与α-、β-硫丹、硫丹硫酸盐和硫丹二醇浓度间均呈显著正相关,而偏相关分析显示多酚氧化酶活性与它们均无显著相关性,说明这4种化合物单独存在时对多酚氧化酶活性影响较小,对酶活性的影响可能是它们共同作用的结果。图4中T2—T4处理,硫丹含量越高,多酚氧化酶的活性越强,其中T3和T4处理分别在培养5—20 d和30 d时显著激活多酚氧化酶活性。Gianfreda等[34]和周礼恺[4]报道,含苯环的化合物能诱导和激活土壤中多酚氧化酶的活性,并促进该类化合物的氧化分解。Chen等[35]进一步证实,在一定条件下,土壤中多环化合物的浓度越大,多酚氧化酶的活性越强。李钠等[36]研究表明,含杂环的尼古丁和烟焦油能诱导胞内多酚氧化酶向胞外迁移,增加该酶的活性。硫丹的分子结构中含有两个五元碳环、一个六元碳环、一个七元杂环,这可能是T3和T4处理在培养初期可显著激活多酚氧化酶活性的原因之一。Defo等[8]的研究显示,硫丹可为某些微生物的生长提供碳源,增加了土壤中酶的活性,使得硫丹处理初期多酚氧化酶被激活。图4中T2—T4处理对多酚氧化酶活性最终都起抑制作用,可能与硫丹的高毒代谢产物硫丹硫酸盐的积累有关,除第5天和20天外,T1处理显著抑制多酚氧化酶活性的原因还有待进一步研究。
[1] Yang J,Zhang WJ.Current situation of production,use and management of endosulfan.Pesticide Science and Administration,2011,32(10):6-9.
[2] Jia H L,Li Y F,Wang D G,Cai D J,Yang M,Ma JM,Hu JX.Endosulfan in China 1-gridded usage inventories.Environmental Science and Pollution Research,2009,16(3):295-301.
[3] Jia H L,Sun Y Q Li Y F,Tian C G,Wang D G,Yang M,Ding Y S,Ma J M.Endosulfan in China 2-emissions and residues.Environmental Science and Pollution Research,2009,16(3):302-311.
[4] Zhou L K.Soil Enzymology.Beijing:Science Press,1987:116-222
[5] He W X,Yao M J,Sun L N,Sun T H.Effects of furadan on soil enzyme activity.Chinese Journal of Applied Ecology,2007,18(8):1921-1924.
[6] Zhang Y L,Chen L J,Zhang L L.Enzymological indicators of soil quality.Chinese Journal of Soil Science,2005,36(4):598-604.
[7] Fan K,Wang K Y,Wang D,Xia X M,Liu Z L,Wang H Y.Effects of 1,3-dichloropropene on soil microbial population and enzyme activities.Acta Ecologica Sinica,2008,28(2):695-701.
[8] Defo M A,Njine T,Nola M,Beboua F S.Microcosm study of the long term effect of endosulfan on enzyme and microbial activities on two agricultural soils of Yaounde-Cameroon.African Journal of Agricultural Research,2011,6(9):2039-2050.
[9] Kalyani SS,Sharma J,Dureja P,Singh S,Lata.Influence of endosulfan on microbial biomass and soil enzymatic activities of a tropical alfisol.Bulletin of Environment Contamination and Toxicology,2010,84(3):351-356.
[10] Tejada M,Gonzalez J L,Hernandez M T,Garcia C.Application of different organic amendments in a gasoline contaminated soil:Effect on soil microbial properties.Bioresource Technology,2008,99(8):2872-2880.
[11] Shen G Q,Lu Y T,Zhou Q X,Hong JB.Interaction of polycyclic aromatic hydrocarbons and heavy metals on soil enzyme.Chemosphere,2005,61(8):1175-1182.
[12] Hinojosa M B,Carreira JA,Rodrguez-maroto J M,García-Ruíz R.Effects of pyrite sludge pollution on soil enzyme activities:Ecological doseresponse model.Science of the Total Environment,2008,396(2/3):89-99.
[13] Zhang Z D,Zhao L P.The significance of soil enzyme in studying soil fertility management.Chinese Journal of Soil Science,2006,37(2):362-368.
[14] Chen L J,Wu Z J,Jiang Y,Zhou L K.Response of N transformation related soil enzyme activities to inhibitor applications.Chinese Journal of Applied Ecology,2002,13(9):1099-1103.
[15] Hao JC,Wu Y Y,Lian B,Wu C D.Properties of polyphenoloxidase in soil and its significance.Chinese Journal of Soil Science,2006,37(3):470-474.
[16] Yue Z H,Wang B W,Wang H F,Yan X F.Polyphenol oxidase activity and its relationship to the soil main fertilizer factor in west Songnen alkali grassland.Acta Pratacul Turae Sinica,2009,18(4):251-255.
[17] He Y R.Purple Soil in China(Volume 2).Beijing:Science Press,2003:13-31.
[18] Pi G J,Tang SY.Principle and Application of Agricultural Environmental Monitoring.Chengdu:Chengdu University of Science and Technology Press,1998:148-154.
[19] Ma H,Zhang D H,Li X X,Zhang SJ,Chen Y D.Study on a residues dynamics of endosulfan in cotton and soil.Journal of Shihezi University:Natural Science Edition,2008,26(5):579-582.
[20] Kumar P,Singh S P,Madhukar D,Kotresh A M.Determination of endosulfan residues in buffalo meat using high performance liquid chromatography.Buffalo Bulletin,2009,28(4):188-197.
[21] Siddique T,Zahir A Z,Frankenberger W T.Reversed-phase liquid chromatographic method for analysis of endosulfan and its major metabolites.Journal of Liquid Chromatography& Related Technologies,2003,26(7):1069-1082.
[22] Hamaker J W.Mathematical Prediction of Cumulative Levels of Pesticides in Soil.In Rosen A A and Kraybill H F(eds.),Organic Pesticides in the Environment.Washington D C:American Chemical Society,1966,60(10):122-131.
[23] Awasthi N,Ahuja R,Kumar A.Factors influencing the degradation of soil-applied endosulfan isomers.Soil Biology and Biochemistry,2000,32(11/12):1697-1705.
[24] Soto A M,Chung K L,Sonnenschein C.The pesticides endosulfan,toxaphane,and dieldrin have estrogenic effects on human estrogen-sensitive cells.Environmental Health Perspectives,1994,102(4):380-383.
[25] Wan M T,Kuo J N,Buday C,Schroeder G,Aggelen G V,Pasternak J.Toxicity ofα-andβ-endosulfan and their formulated and degradation products to Daphnia magna,Hyalella azteca,Oncorhynchus mykiss,Oncorhynchus kisutch,and biological implications in streams.Environmental Toxicology and Chemistry,2005,24(5):1146-1154.
[26] Pettit N M,Smith A RJ,Freedman R B,Burns R G.Soil urease:activity,stability and kinetic properties.Soil Biology and Biochemistry,1976,8(6):479-484.
[27] Wang C Y,He W X,Liu H L,Lai H X,Deng X C.Effect of monochlorobenzene on soil urease activity characteristics.Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition,2009,37(7):171-175.
[28] Nasreen C,Mohiddin GJ,Srinivasulu M,Padmini R A,Ramanamma P,Rangaswamy V.Interaction effects of insecticides on enzyme activities in black clay soil from groundnut(Arachis hypogaea L.)fields.Environmental Research,Engineering and Management,2012,60(2):21-28.
[29] Nasreen C,Mohiddin G J,Srinivasulu M,Padmini R A,Ramanamma P,Rangaswamy V.Responses of soil enzymes to insecticides in groundnut(Arachis hypogaea L.)cultivated black soil.World Journal of Agricultural Sciences,2012,8(2):163-168.
[30] Sannino F,Gianfreda L.Pesticide influence on soil enzymatic activities.Chemosphere,2001,45(4/5):417-425.
[31] Giri1 P K,Saha M,Halder M P,Mukherjee D.Effect of pesticides on microbial transformation of sulphur in soil.Journal of Soil Science and Environmental Management,2011,2(4):97-102.
[32] Kumar S.Effect of endosulfan and chlorpyrifos on protease activity in the cultivated soil.International Journal of Advanced Engineering Technology,2011,2(3):188-192.
[33] Buff K,Mano DM S,Langenbach T.Effect of endosulfan on Azospirillum lipoferum growth,morphology,nitrogenase activity,and protein binding.Applied and Environmental Microbiology,1992,58(9):3173-3176.
[34] Gianfreda L,Rao M A,Piotrowska A,Palumbo G,Colombo C.Soil enzyme activities as affected by anthropogenic alterations:intensive agricultural practices and organic pollution.Science of the Total Environment,2005,341(1/3):265-279.
[35] Chen Y,Wang CX,Wang Z J,Huang SB.Assessment of the contamination and genotoxicity of soil irrigated with wastewater.Plant and Soil,2004,261(1/2):189-196.
[36] Li N,Zhang J,Min H,Shao A P,Zhou H J.Variation of polyphenoloxidase in phenanthrene-degrading and other aromatic compounds-degrading bacteria.Agriculture and Life Sciences,2006,32(5):495-499.
参考文献:
[1] 杨峻,张文君.硫丹的生产使用现状及管理动态.农药科学与管理,2011,32(10):6-9.
[4] 周礼恺.土壤酶学.北京:科学出版社,1987:116-222.
[5] 和文祥,姚敏杰,孙丽娜,孙铁珩.呋喃丹对土壤酶活性的影响.应用生态学报,2007,18(8):1921-1924.
[6] 张玉兰,陈利军,张丽莉.土壤质量的酶学指标研究.土壤通报,2005,36(4):598-604.
[7] 范昆,王开运,王东,夏晓明,刘振龙,王红艳.1,3-二氯丙烯药剂对土壤微生物数量和酶活性的影响.生态学报,2008,28(2):695-701.
[13] 张志丹,赵兰坡.土壤酶在土壤有机培肥研究中的意义.土壤通报,2006,37(2):362-368.
[14] 陈利军,武志杰,姜勇,周礼恺.与氮转化有关的土壤酶活性对抑制剂施用的响应.应用生态学报,2002,13(9):1099-1103.
[15] 郝建朝,吴沿友,连宾,吴春笃.土壤多酚氧化酶性质研究及意义.土壤通报,2006,37(3):470-474.
[16] 岳中辉,王博文,王洪峰,阎秀峰.松嫩平原西部盐碱草地土壤多酚氧化酶活性及其与主要肥力因子的关系.草业学报,2009,18(4):251-255.
[17] 何毓蓉.中国紫色土(下篇).北京:科学出版社,2003:13-31.
[18] 皮广洁,唐书源.农业环境监测原理与应用.成都:成都科技大学出版社,1998:148-154.
[19] 马辉,张东海,李小侠,张少军,陈勇达.硫丹在棉花及土壤中的残留动态研究.石河子大学学报:自然科学版,2008,26(5):579-582.
[27] 王聪颖,和文祥,刘海轮,来航线,邓小成.一氯苯对土壤脲酶活性特征的影响.西北农林科技大学学报:自然科学版,2009,37(7):171-175.
[36] 李钠,章骥,闵航,邵爱萍,周红军.菲和其他芳香族化合物降解菌多酚氧化酶的变化研究.浙江大学学报:农业与生命科学版,2006,32(5):495-499.

