羧基化磁性微球固定化Aeromonos sp.F3的研究
庞 文 静, 王 红 英, 钱 斯 日 古 楞, 刘 德 祎
(大连工业大学 生物工程学院, 辽宁 大连 116034)
0 引 言
磁性高分子微球是近年发展起来的一种新型磁性材料,是通过适当的方法将磁性无机粒子与有机高分子结合形成的具有一定磁性及特殊结构的复合微球[1]。磁性复合微球不仅具有普通高分子微球的众多特性还具有磁响应性,所以不仅能够通过共聚及表面改性等方法赋予其表面功能基团,如—OH、—COOH、—CHO、—NH2等,还能在外加磁场的作用下具有导向功能[2]。目前,磁性微球已广泛用于生物医学、细胞学、分离工程、免疫诊断、靶向药物、催化剂载体等诸多领域[3-4]。以其作为载体对各种物质进行固定,经过磁性固定后的大分子物质可以在磁场的引导下进行分离纯化,效果良好且操作简便,而且微球可以重复利用。近几年,科学家们正致力于研究一种可用于微生物分离的磁性载体[5],磁性微球作为固定化载体显示出良好的研究前景。
本文提出了用表面羧基化的磁性微球固定化微生物细胞的方法。研究了菌/磁性微球相对质量比、pH、温度等条件对固定化菌产酶的相对酶活力的影响,确定了磁性固定化Aeromonossp.F3菌体的最佳反应条件,并对磁性固定化Aeromonossp.F3的操作稳定性做了研究,以期为磁性固定化菌的研究提供参考。
1 材料与方法
1.1 材 料
细菌Aeromonossp.F3是由本课题组在前期工作中筛选并鉴定的产蛋白酶的一种海洋微生物;FeCl3·6H2O,FeCl2·6H2O,油酸,KMnO4等均为国产分析纯试剂。
1.2 Aeromonos sp.F3的培养
将-80 ℃保藏的菌种,室温放置2 h后,接种于种子培养基中,置于摇床(30 ℃、160 r/min)中摇瓶培养8 h。
发酵培养基(g/L):葡萄糖0.3,酵母浸粉0.9,氯化钠0.5。
1.3 磁性微球的制备
1.3.1 磁性微球的制备
将0.2 mol/L FeCl3·6H2O和0.125 mol/L FeCl2·6H2O分别溶解于40 mL的去离子水中,混合于250 mL的三口烧瓶中,置于40 ℃水浴锅中,搅拌均匀后,流加18 mL浓氨水;1 min后,逐滴加入4.26 g油酸,继续在70 ℃的水浴中快速搅拌1 h。反应结束后,用酒精洗涤2次,除去多余的油酸,再用去离子水洗涤至中性保存。
1.3.2 磁性微球的羧基化改性
取20 mL上述制得的磁性微球悬浮液(40 mg/mL),加入150 mL的KMnO4溶液(20 mg/mL),冰浴条件下,在超声波细胞粉碎机中破碎20 min。将氧化破碎后的磁性微球置于三口烧瓶之中,高速搅拌5 h,用去离子水洗涤3次,得到羧基化的磁性微球。
1.4 Aeromonos sp.F3菌体的磁性固定化
取培养好的菌液,在4 000 r/min的条件下离心20 min后弃上清液;沉淀用去离子水离心洗涤2次,将离心后的菌体分散于去离子水中,得到质量浓度为10 mg/mL的菌液。将3 mL菌液中加入1 mL羧基化的磁性微球,并在一定条件下进行固定化。借助磁场分离后用去离子水洗涤,得到磁性固定化细胞。将该固定化细胞接种到发酵培养基中,在30 ℃、160 r/min条件下摇瓶培养8 h。取上清液,测其酶活。
1.5 菌体磁性固定化条件的优化
1.5.1 菌/磁性微球的质量比对固定化的影响
在菌/磁性微球质量比分别为1.9、3.1、4、4.9、5.4、6.2的条件下,常温中固定化1 h后,用去离子水洗涤固定化菌,在磁场下分离并注入新鲜的培养基,置于摇床(30 ℃、160 r/min)中摇瓶培养8 h,取上清液,测其酶活。通过测定发酵上清液中酶活的大小。考察菌体的磁性固定化效能。
1.5.2 pH对固定化的影响
在菌/磁性微球质量比为3.1,pH分别为6.0、7.0、8.0、9.0、10.0的条件下,常温中固定化1 h后,用相对应的pH缓冲溶液洗涤,在磁场下分离并注入新鲜的培养基,置于摇床(30 ℃、160 r/min) 中摇瓶培养8 h,取上清液,测其酶活。
1.5.3 反应时间对固定化的影响
在菌/磁性微球相对质量比为3.1、pH为8的条件下,常温中分别固定化15、30、45、60、75、90 min。用去离子水洗涤固定化菌后,在磁场下分离并注入新鲜的培养基,置于摇床(30 ℃、160 r/min) 中摇瓶培养8 h,取上清液,测其酶活。
1.5.4 反应温度对固定化的影响
在菌/磁性微球相对质量比为3.1、pH为8的条件下,分别于5 、15 、30 、45 、60 ℃下固定化0.5 h后,用去离子水洗涤固定化菌,在磁场下分离并注入新鲜的培养基,置于摇床(30 ℃、160 r/min) 中摇瓶培养8 h,取上清液,测其酶活。
1.6 固定化菌操作稳定性的探究
最佳条件下(室温下,菌/磁性微球相对质量比为3.1,pH为8固定化0.5 h),在摇床(30 ℃、160 r/min)中对固定化菌进行连续培养,每8 h更换一次新鲜培养基。
1.7 酶活力的测定
采用福林酚法测定菌体产生的蛋白酶活力。其中以酪蛋白为水解底物、酪氨酸为标准物。
2 结果与讨论
2.1 菌/磁性微球的相对质量比对固定化的影响
选择其他条件一定,而菌/磁性微球的相对质量比不同的条件下进行固定化后,对固定化菌连续培养,测得酶活。如图1所示,随着菌/磁性微
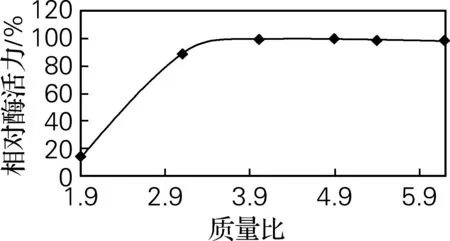
图1 菌/磁性微球的相对质量比对固定化的影响
球的相对质量比增大,即固定化体系中菌体浓度增大而磁性微球浓度降低时,在相同的培养条件下,酶活力随着质量比的增大而增大,但质量比达到3.1以上时,酶活力趋于平稳。故确定最佳质量比为3.1。
2.2 pH条件对固定化的影响
改变固定化反应体系中的pH,对固定化菌进行连续培养,测得酶活。如图2 所示,pH对细胞固定化效率的影响较大,当pH为8时相对酶活力最大。因此确定最佳pH为8。

图2 pH对固定化的影响
2.3 反应时间对固定化的影响
当固定化反应时间不同时,对固定化菌进行连续培养,测得酶活。如图3所示,固定化时间对细胞固定化影响较小,考虑到细胞活性的因素,确定最佳反应时间0.5 h。
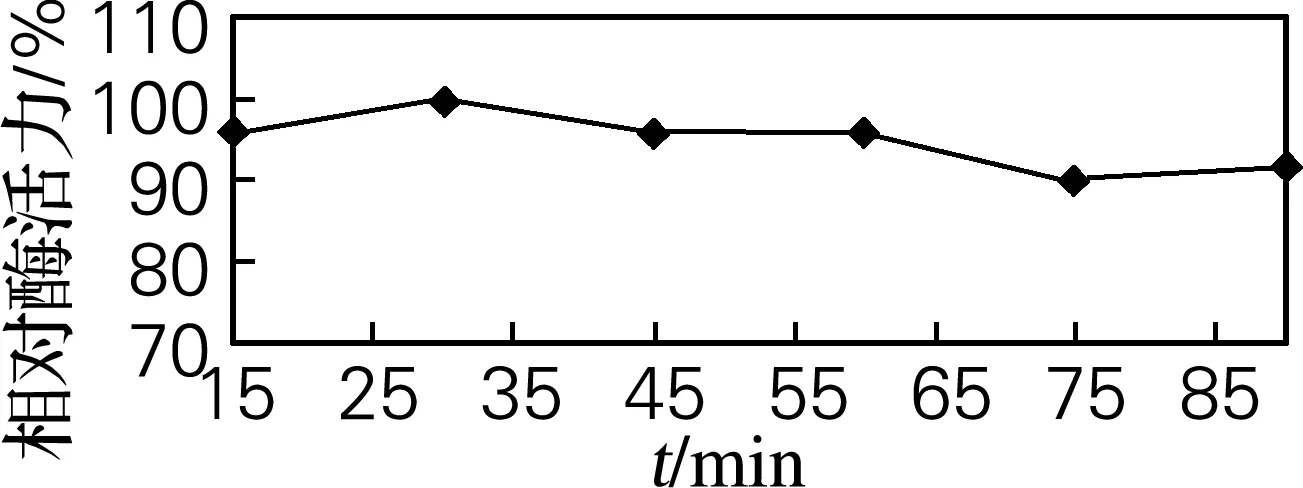
图3 时间对固定化的影响
2.4 温度对固定化的影响
改变固定化反应温度时,对固定化菌进行连续培养,测得酶活。如图4所示,在不同温度下固定化菌产酶的相对活性呈小幅波动,说明温度对菌体和磁性微球相互作用的影响并不显著,但对菌体

图4 温度对固定化的影响
细胞的活性会有一定的影响,为降低能源消耗,选择温度较低的25 ℃为最佳反应时间。
2.5 固定化菌连续培养的相对酶活力
在最佳反应条件下,连续重复利用固定化菌产酶,测发酵上清液的相对酶活大小。如图5所示,磁性固定化菌体可以重复利用7次,其产生胞外酶的相对酶活力仍可保持在50%~60%。
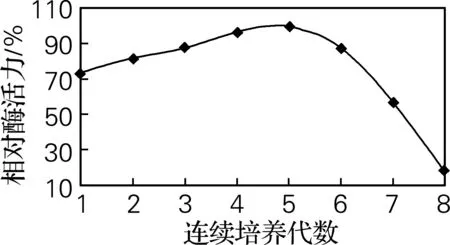
图5 固定化菌连续培养的相对酶活力
3 结 论
采用改性的磁性微球固定化Aeromonossp.F3菌,并对其固定化条件和操作稳定性进行研究,得到磁性微球固定化Aeromonossp.F3菌的最佳条件为:固定化时间0.5 h,菌/磁性微球的相对质量比为3.1,pH为8,温度为25 ℃;在最佳条件下,磁性固定化菌重复利用7次时其产生胞外酶的相对活力仍保持在50%~60%,实现了Aeromonossp.F3菌体细胞在磁场作用下的有效分离和重复利用。本研究为功能化的磁性微球固定化菌的后续研究奠定了基础。
[1] 孙井辉,王红英,钱斯日古楞,等. 纳米级磁性微球靶向性研究[J]. 材料导报, 2011, 25(17):177-179.
[2] MUTHANA M, MULTHOFF G, KYTAI N, et al. Tumour infiltrating host cells and their significance for hyperthermia[J]. International Journal of Hyperthermia, 2010, 26(3):247-255.
[3] 常凯,王红英,孙井辉,等. 磁性壳聚糖微球固定化脂肪酶的研究[J]. 大连工业大学学报, 2011, 30(1):30-33.
(CHANG Kai,WANG Hong-ying, SUN Jing-hui, et al. Immobilization of lipase onto magnetic chitosan microspheres[J]. Journal of Dalian Polytechnic University, 2011, 30(1):30-33.)
[4] 刘天孚,刘琦,王君. 羧基磁性微球的制备及其用于CD细胞分离应用[J]. 化学工程师, 2011, 12(3):6-8.
[5] 郭卫强,焦艳华. 高分子磁性微球的研究进展[J]. 化工技术与开发, 2012, 41(7):40-42.

