与杜氏盐藻驱动蛋白Ⅱ动力亚基C端相互作用的新蛋白的酵母双杂交筛选*
李 靓,崔柳青,王瑞莉,毛丽红,韩 康,柴丹丹,薛乐勋#
1)郑州大学生物工程系细胞生物学研究室 郑州 450001 2)河南工业大学生物工程学院 郑州 450001
驱动蛋白作为细胞内一类马达蛋白,在细胞内物质运输中扮演着重要角色。其成员驱动蛋白Ⅱ是参与鞭毛内运输的关键动力蛋白之一,包括含马达结构域的FLA8、FLA10两个动力亚基及一个非动力亚基KAP,其中FLA8与FLA10两个亚基的C端相互缠绕,形成螺旋-卷曲-螺旋结构[1]。有研究[2-3]表明鞭毛内运输机制不仅对于纤毛的组装是必要的,而且在组织纤毛产生的信号通路中也发挥重要作用。杜氏盐藻是一种单细胞绿藻,培养条件简单。由于其具有一对等长的鞭毛而常被用作研究鞭毛内运输及鞭毛相关疾病的模式生物。为了筛选参与鞭毛内运输及相关信号通路的蛋白,作者以FLA8 C 端为诱饵,采用酵母双杂交的方法从杜氏盐藻的cDNA酵母文库中筛选与之相互作用的新蛋白。
1 材料与方法
1.1实验材料及试剂杜氏盐藻购自美国德州大学,杜氏盐藻cDNA酵母文库为郑州大学生物工程系细胞生物学研究室构建,EcoRⅠ、BamHⅠ、Hind Ⅲ 等DNA限制性内切酶、pMD19-T载体、DNA连接试剂盒均购自宝生物工程(大连)有限公司,质粒提取试剂盒、凝胶回收试剂盒购自AXYGEN公司,酵母双杂交所用载体pGBKT7、菌株Y187和AH109均购自Clontech公司,酵母蛋白提取试剂盒购自上海生工生物工程技术服务有限公司,筛选试剂X-α-Gal、3-AT购自Sigma公司。
1.2FLA8cDNA片段的扩增提取杜氏盐藻总RNA,反转录成cDNA作为模板,设计两端分别带有EcoRⅠ和BamHⅠ酶切位点的FLA8 C端特异性引物(EcoRⅠ-FLA8:5’-CCGGAATTCGTGGGCAT CAGCGAGGACCA-3’,BamHⅠ-FLA8:5’-CGCGGATC CTCATGCAGGCTTAGAAGACG-3’),以制备好的cDNA为模板,PCR扩增FLA8 C端的cDNA片段。
1.3pGBKT7-FLA8-C诱饵表达载体的构建将得到的FLA8 C端PCR产物和载体pGBKT7用EcoRⅠ和BamHⅠ双酶切,分别回收大小为1 302 bp和7 300 bp的目的片段,并按照DNA连接试剂盒连接,转化大肠杆菌DH5α,蓝白斑筛选得到阳性菌落,扩大培养,提取质粒pGBKT7-FLA8-C备用。
1.4自激活检测按照Clontech小规模酵母转化说明书将构建好的pGBKT7-FLA8-C诱饵表达载体转化入酵母菌株Y187和AH109中,同时以pGBKT7-53和空载体分别作为阳性和阴性对照。得到的克隆分别划线于SD/-Trp/X-α-Gal、SD/-His/-Trp/X-α-Gal和SD/-Ade/-Trp/X-α-Gal固体培养基上。如果在SD/-His/-Trp/X-α-Gal培养基上生长,在杂交筛选中需加入组氨酸抑制剂3-AT以抑制His泄露。如果在SD/-Ade/-Trp/X-α-Gal培养基上生长,则诱饵蛋白对报告基因有自激活作用,不适合用酵母双杂交筛选相互作用蛋白。
1.5毒性检测将含有诱饵表达载体和空载体的Y187和AH109菌株分别划线于SD/-Trp固体培养基上倒置培养,挑取大小相同的克隆分别接种于SD/-Trp液体培养基中,30 ℃、250 r/min,过夜振荡培养,测光密度值。若含诱饵表达载体的菌株光密度值明显低于含空载体的菌株,则说明诱饵蛋白的存在阻碍了酵母菌株的生长,该蛋白不适合用酵母双杂交筛选相互作用蛋白。
1.6诱饵蛋白表达情况检测按照酵母蛋白提取试剂盒提取酵母蛋白,SDS凝胶电泳,以Myc 小鼠单抗为一抗,HRP标记的兔抗小鼠IgG为二抗,Western blot检测。
1.7酵母双杂交取1 mL文库菌在冰上融化后与预先活化的Y187(含pGBKT7-FLA8-C质粒)菌株共同转接于5 mL 2×YPDA/kanr的液体培养基中,30 ℃缓慢摇晃,20 h后取样观察是否有三叶形合子形成,若无或者量较少,则继续培养至24 h。
1.8杂交结果筛选杂交后的菌液涂于SD/-Ade/-His/-Leu/-Trp固体培养基上,30 ℃倒置培养3~5 d至克隆出现。挑取单克隆划线于SD/-Ade/-His/-Leu/-Trp/X-α-Gal/3-AT固体培养基上,30 ℃倒置培养3~5 d,若所挑取的克隆生长并表现为蓝色,则按照同样方法再转接一代;若不再生长或者只生长而不变蓝色则是假阳性。传至第五代仍生长良好且表现为蓝色的克隆即为阳性克隆。
1.9筛选结果鉴定挑取阳性菌落细胞作为模板进行菌落PCR,扩增得到的片段,胶回收后与pMD19-T载体连接,转化DH5α,酶切鉴定,并将菌液送华大基因科技有限公司测序。
2 结果
2.1诱饵表达载体双酶切鉴定用EcoRⅠ和BamHⅠ对pGBKT7-FLA8-C质粒双酶切鉴定,电泳后表现出2条条带,一条约7 300 bp,为线性的pGBKT7载体;另一条约1 300 bp,为插入的FLA8 C端cDNA片段(图1),该结果表明诱饵表达载体构建成功。经测序证明其中没有发生突变,可用于酵母双杂交实验。
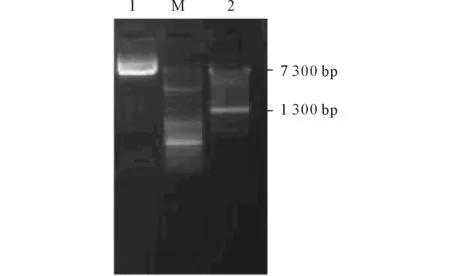
图1 诱饵表达载体酶切鉴定
M:DL 10 kb相对分子质量标准;1:pGBKT7-FLA8-C质粒;2:pGBKT7-FLA8-CEcoRⅠ和BamHⅠ双酶切。
2.2自激活检测将含有诱饵表达载体的酵母菌株AH109和Y187在SD/-Trp/X-α-Gal和SD/-His/-Trp/X-α-Gal培养基上生长并变蓝,而在SD/-Ade/-Trp/X-α-Gal培养基上不能生长。提示酵母细胞存在本底His泄漏,加入3-AT至终浓度为15 mmol/L时,可以完全抑制His泄漏。
2.3毒性检测含诱饵表达载体和pGBKT7空载体的Y187菌株接种过夜培养后测得其光密度值分别为1.25和1.34,表明诱饵蛋白的存在对酵母菌株无毒性。
2.4双杂交配子形成检测杂交20 h时取样用显微镜观察,图2为×1 000时的酵母细胞,已经形成大量的三叶形合子,可进行下一步的筛选。

图2 双杂交配子形成检测(×1 000)
2.5双杂交结果见图3。杂交的菌液在SD/-Ade/-His/-Leu/-Trp/X-α-Gal/3-AT固体培养基上转接5代后,有2个菌落仍表现为蓝色,为筛选得到的阳性克隆。
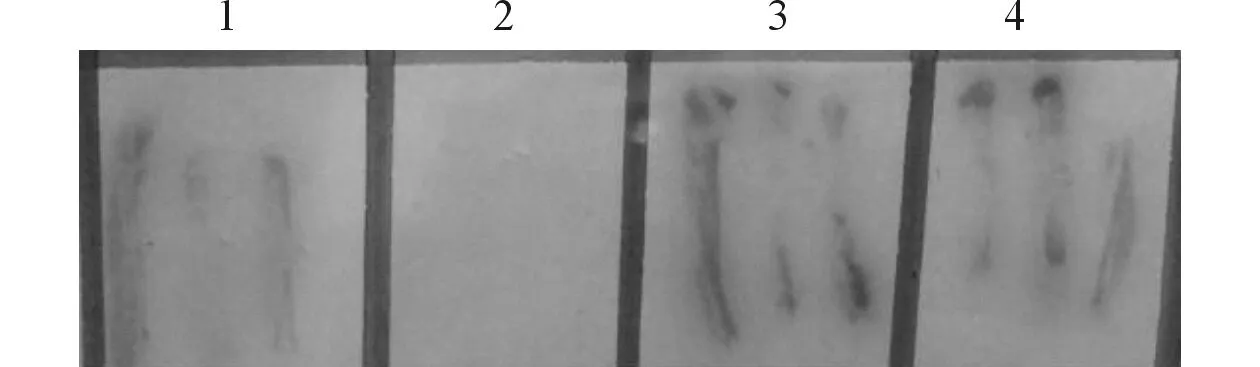
图3 酵母双杂交筛选结果
1:阳性对照,Y187(含pGBKT7-53质粒)与AH109(含pGADT7-Rec-质粒)菌株杂交;2:阴性对照,Y187(含pGBKT7-Lam质粒)与AH109(含pGADT7-Rec-LargeT质粒)菌株杂交;3、4:Y187(含pGBKT7-FLA8-C质粒)与AH109(文库菌)杂交筛选得到的阳性克隆。
2.6菌落PCR结果对双杂交筛选得到的阳性克隆进行菌落PCR,得到大小分别为1 500和1 200 bp的片段。见图4。
2.7双杂交测序结果及序列分析结果阳性克隆中所含的cDNA片段及所表达的蛋白经测序鉴定,分别与衣藻、团藻、小球藻等生物的预测蛋白(含蛋白质结合结构域)和鞭毛相关蛋白107(FAP 107)同源。杜氏盐藻预测蛋白部分氨基酸序列与衣藻和团藻相应序列的相似度分别为79%和80%,杜氏盐藻鞭毛相关蛋白部分氨基酸序列与衣藻和团藻相应序列的相似度均为58%。
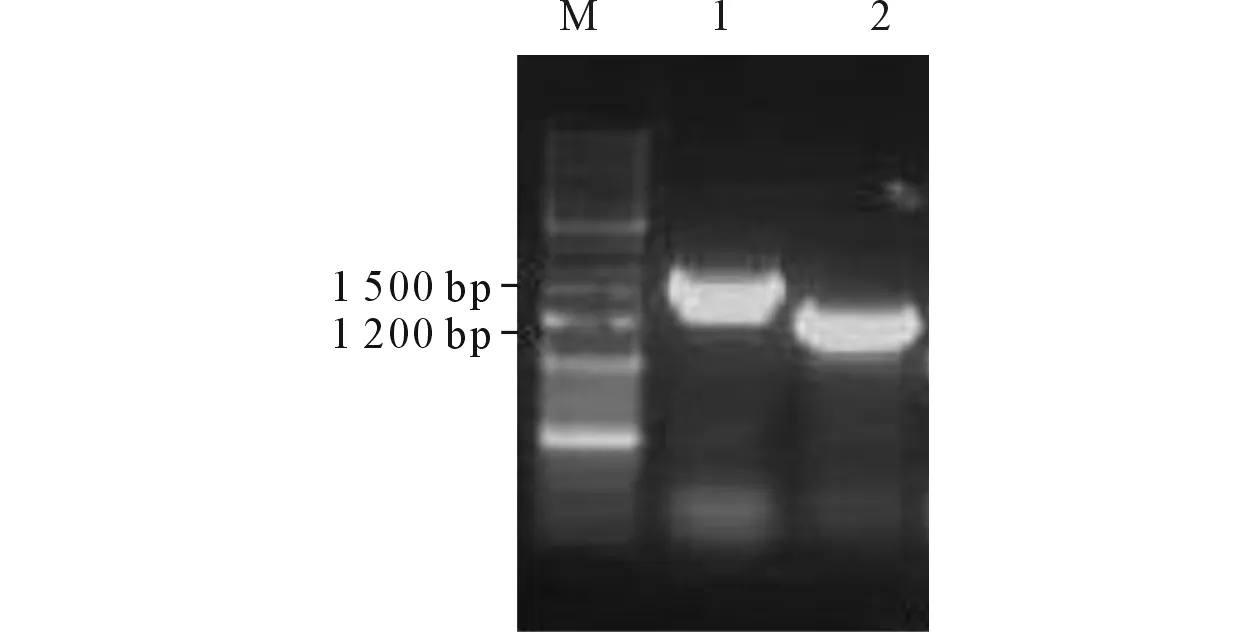
图4 阳性克隆菌落PCR结果
3 讨论
在细胞内,大分子蛋白质及复合物需要借助马达蛋白将其运输到目的区域。驱动蛋白是一类马达蛋白,利用水解ATP释放的能量沿着微管移动来运输货物蛋白[4]。驱动蛋白家族成员参与大分子、细胞器、囊泡的运输,同时对有丝分裂、形态发育等细胞活动都有重要影响[5-6]。鞭毛/纤毛是细胞表面突起的亚细胞结构,纤毛异常会导致多囊肾疾病、肥胖症、糖尿病及癌症等人类疾病[7]。驱动蛋白Ⅱ是驱动蛋白家族的一个重要成员,在鞭毛内运输中发挥着重要的作用[8]。鞭毛内运输是一个动态平衡的过程,受到细胞内外各种因素的影响[9],参与鞭毛/纤毛信号通路的调节,与多种疾病的发生相关[10]。
酵母双杂交是一个能够快速、直接分析体内蛋白之间相互作用的方法,可以在一定程度上反映细胞内的真实情况。用该方法筛选与驱动蛋白Ⅱ动力亚单位C端相互作用的蛋白,有助于了解鞭毛内运输机制及其参与的信号通路[11]。该实验中双杂交筛选得到两个和FLA8相互作用的蛋白:FAP107和一个预测蛋白。FAP107是由Pazour等[12]在莱茵衣藻的鞭毛蛋白质组学研究中发现的存在于鞭毛中的未知功能的蛋白质,其与FLA8尾部的结合提示该蛋白可能参与了驱动蛋白Ⅱ活性调控及相关信号的传递。筛选到的预测蛋白所含有的蛋白质结合结构域能够与多种蛋白质的C末端相结合而参与信号传递[13],因而该预测蛋白与FLA8 C端的结合很有可能与相关信号的传递有关。
[1]Cole DG.Kinesin-Ⅱ,the heterodimeric kinesin[J].Cell Mol Life Sci,1999,56(3/4):217
[2]Pan J,Wang Q,Snell WJ.Cilium-generated signaling and cilia-related disorders[J].Lab Invest,2005,85(4):452
[3]Wang Q,Pan J,Snell WJ.Intraflagellar transport particles participate directly in cilium-generated signaling in Chlamydomonas[J].Cell,2006,125(3):549
[4]Schnitzer MJ,Block SM.Kinesin hydrolyses one ATP per 8-nm step[J].Nature,1997,388(6640):386
[5]Oppenheimer DG,Pollock MA,Vacik J,et al.Essential role of a kinesin-like protein in Arabidopsis trichome morphogenesis[J].Proc Natl Acad Sci USA,1997,94(12):6261
[6]Lu L,Lee Y,Pan R,et al.An internal motor kinesin is associated with the Golgi apparatus and plays a role in trichome morphogenesis in Arabidopsis[J].Mol Biol Cell,2005,16(2):811
[7]Snell WJ,Pan J,Wang Q.Cilia and flagella revealed:from flagellar assembly in Chlamydomonas to human obesity disorders[J].Cell,2004,117(6):693
[8]Scholey JM.Kinesin-Ⅱ,a membrane traffic motor in axons,axonemes,and spindles[J].J Cell Biol,1996,133(1):1
[9]Engel BD,Ludington WB,Marshall WF.Intrafagellar transport particle size scales inversely with fagellar length:revisiting the balance-point length control model[J].J Cell Biol,2009,187(1):81
[10]潘俊敏.衣藻、纤毛与“纤毛相关疾病”[J].中国科学C辑:生命科学,2008,38(5):399
[11]柴丹丹,李庆华,阎赟梦,等.杜氏盐藻S腺苷高半胱氨酸水解酶酵母双杂交诱饵载体的构建及自激活和毒性检测[J].郑州大学学报:医学版,2012,47(1):16
[12]Pazour GJ,Agrin N,Leszyk J,et al.Proteomic analysis of a eukaryotic cilium[J].J Cell Biol,2005,170(1):103
[13]Smock RG,Gierasch LM.Sending signals dynamically[J].Science,2009,324(5924):198

