杜氏盐藻基因FLA8原核表达载体的构建和表达*
侯永杰,李庆华,薛乐勋
郑州大学生物工程系细胞生物学研究室 郑州 450001
驱动蛋白是一种具有保守马达结构域的蛋白,实验[1]证实驱动蛋白的作用是结合在微管和鞭毛上,参与小囊泡和细胞器的转运[2]、纺锤体的形成和延伸[3]、染色体的分离和微管的形成[4-5]等。在驱动蛋白家族中,驱动蛋白2是惟一由异源动力亚基组成的复合物,其由两个动力亚基(FLA8,FLA10)和一个非动力亚基(KAP)组成。FLA8作为藻类驱动蛋白2中的一个动力亚基,具有正末端指向性,牵引完成鞭毛内的正向运输[6]。而鞭毛作为细胞表面上特殊功能的细胞器通过组装和解聚来保持鞭毛的动态平衡。研究[7]表明,鞭毛功能异常常伴随人类疾病的发生,如组织的左右不对称、多囊肾和多指/多趾等。因此,研究驱动蛋白家族中的FLA8基因能够更清楚地阐述鞭毛组装的异常与人类疾病的相关性。作者构建了杜氏盐藻基因FLA8的原核表达载体,并对诱导其表达的条件进行了探索。
1 材料与方法
1.1主要试剂及仪器杜氏盐藻藻株为UTEX-LB-1644,购自美国德州大学;表达载体pET28a(+)、工程菌DH5α和DE3为郑州大学生物工程系细胞生物学研究室保存,HRP-山羊抗兔IgG购自北京中杉金桥生物技术服务有限公司。载体pMD-T购自北京天根生物技术公司;LA Taq DNA聚合酶、限制性内切酶NdeⅠ和Hind Ⅲ、T4 DNA连接酶购自TaKaRa公司;X-Gal和IPTG购自上海生工生物工程技术服务有限公司;凝胶回收试剂盒和质粒DNA小提试剂盒购自Axygen公司。电泳仪(北京六一实验仪器厂),PCR仪(Biometra公司),凝胶成像仪(Synoptics公司)。
1.2杜氏盐藻FLA8基因的扩增根据已知的杜氏盐藻FLA8 cDNA序列设计合成引物。上游引物序列:5’-GGAATTCCATATGATGAGCAGCGGAGC CAATCC-3’;下游引物序列:5’-CCCAAGCTTTCAT GCAGGCTTAGAAGAC-3’;上、下游引物近5’端分别为添加NdeⅠ和Hind Ⅲ酶切位点。PCR反应体系:LA Taq酶0.5 μL,上、下游引物(100 μmol/L)各0.5 μL,dNTP(10 nmol/L)4 μL,10×LA Buffer 5 μL,模板cDNA 1 μL,加ddH2O至48.5 μL。反应条件:95 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸50 s,30个循环;72 ℃延伸10 min,4 ℃终止反应。PCR反应结束后,10 g/L的琼脂糖凝胶电泳检测扩增结果。
1.3目的基因与pMD-T的连接和鉴定大量扩增的PCR产物经过凝胶电泳分离后,依照凝胶回收试剂盒说明对目的基因片段进行凝胶回收,然后将目的基因与带有T末端的pMD-T载体进行连接。转化到大肠杆菌感受态细胞DH5α中,通过含有X-Gal和IPTG 的Amp+抗性的LB平板进行蓝白斑筛选。挑取白色的单克隆扩大培养后提取质粒进行双酶切鉴定,将鉴定正确的命名为pMD-T-FLA8并送华大基因生物公司测序。将测序结果用DNAMAN软件与GenBank上登录的基因对比。
1.4pET28-FLA8载体的构建和鉴定用限制性内切酶NdeⅠ和Hind Ⅲ切割空载体pET28a(+)和克隆载体pMD-T-FLA8,经过10 g/L琼脂糖凝胶电泳分离后,回收FLA8的基因片段和线性载体pET28a(+),用T4 DNA连接酶于16 ℃水浴中过夜连接。然后转化到大肠杆菌感受态细胞DE3中,涂布在含有Kan+抗性的LB平板上,37 ℃过夜培养直到有单克隆出现。挑取单克隆扩大培养后提取质粒进行酶切鉴定,将鉴定正确的质粒送华大基因生物公司测序。
1.5目的基因的原核表达将转化有pET28a-FLA8的大肠杆菌DE3在1 mmol/L IPTG下诱导,于37 ℃振荡培养,取对数生长期的菌液离心,进行SDS-PAGE电泳,以确定目的基因是否表达。
1.6目的蛋白的可溶性检测取诱导蛋白1.5 mL离心弃上清,用1×PBS缓冲液将沉淀洗涤2~3次,12 000 r/min离心1 min。用1×PBS缓冲液重悬菌体后超声破碎离心,将上清转移到另一洁净的EP管中。将2×SDS-PAGE 蛋白质凝胶上样缓冲液分别加入上清液及沉淀中,100 ℃沸水浴中煮沸 10 min 进行琼脂糖凝胶电泳,观察目的蛋白是以包涵体沉淀为主还是以可溶性上清为主。
1.7目的蛋白的Westernblot检测含有目的基因的载体和空载体分别在大肠杆菌中表达,取菌破碎后进行SDS-PAGE电泳,将电泳条带点转移到NC膜上,TBST洗膜3次。加兔抗FLA8抗体(稀释12 000 倍)过夜孵育,再用TBST洗膜3次,用110 000 的辣根过氧化物酶标记的山羊抗兔二抗与NC膜杂交,室温振荡孵育1 h,用TBST洗膜3次,ECL发光显影成像。
2 结果
2.1杜氏盐藻FLA8基因PCR扩增结果扩增后得到一条大小为2 355 bp的片段(图1)。

图1 PCR扩增结果
2.2克隆载体pMD-T-FLA8的鉴定pMD-T-FLA8双酶切结果见图2,提示与目的基因开放阅读框和已知载体的大小基本一致。

图2 pMD-T-FLA8载体酶切鉴定结果
2.3pET28-FLA8和鉴定双酶切质粒得到2 300和5 000 bp的片段各1条(图3),其大小与FLA8的开放阅读框和线性表达载体pET28a(+)的大小相接近。
2.4目的基因的原核表达见图4。
2.5目的蛋白的可溶性检测结果目的蛋白主要以包涵体形式存在,见图5。
2.6目的蛋白的Westernblot检测结果Western blot结果显示,在87 000可见一条特异较高的条带(图6)。
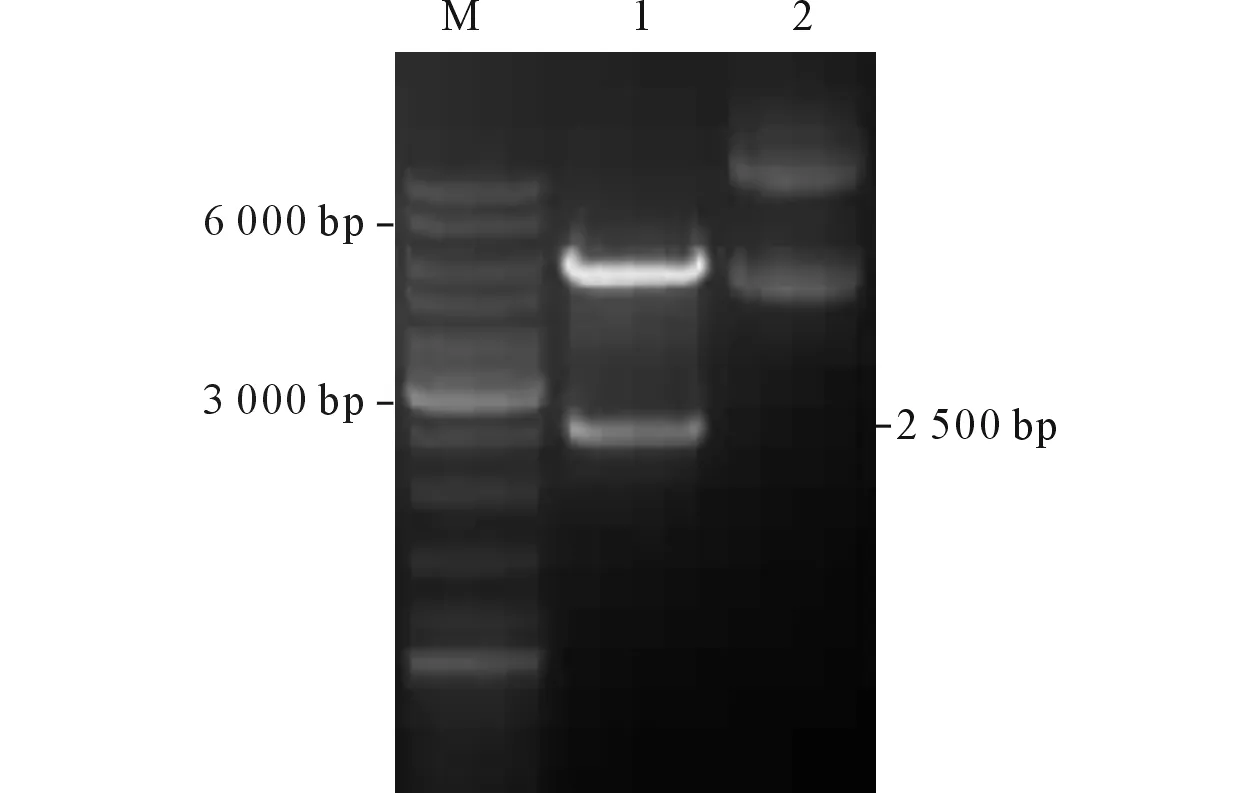
图3 pET28-FLA8载体的双酶切结果
M:Marker;1:pET28a(+)-FLA8双酶切结果;2:pET28a(+)-FLA8质粒。
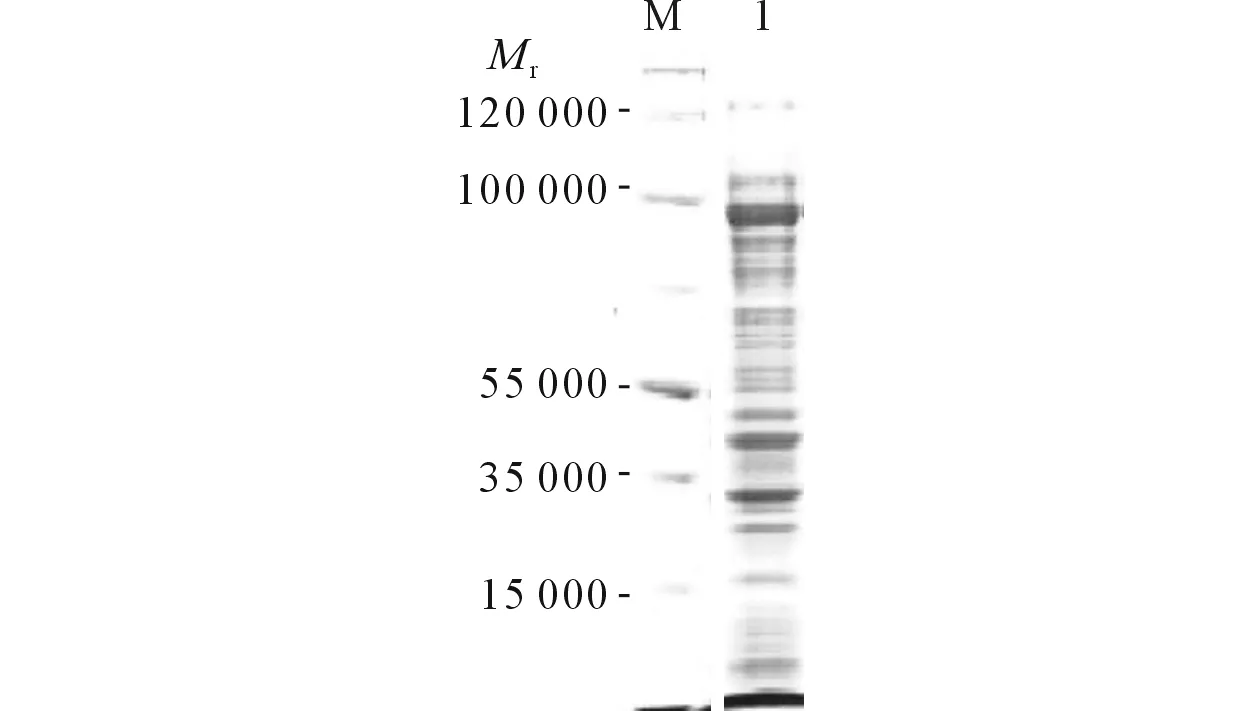
图4 目的基因的原核表达
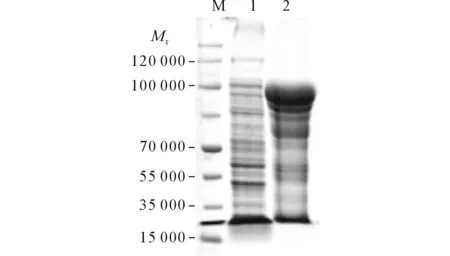
图5 目的蛋白的可溶性检测
M:蛋白Marker;1:菌体裂解后的包涵体沉淀;2菌体裂解后的上清。
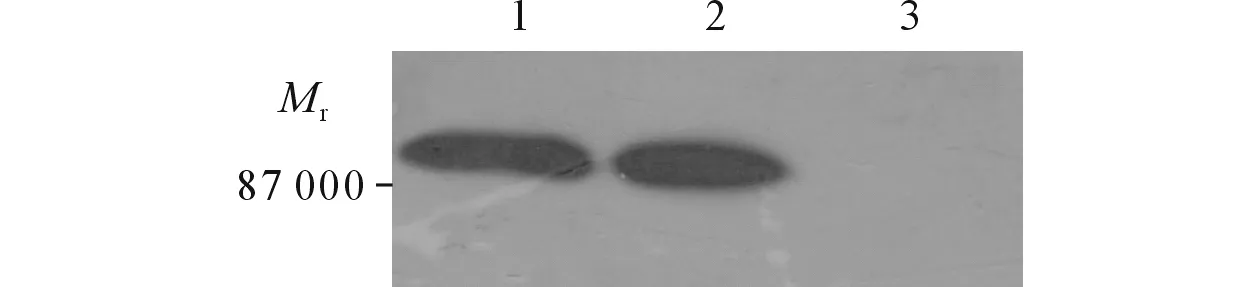
图6 目的蛋白的Western blot检测结果
3 讨论
研究[8]证明了衣藻中的驱动蛋白2与鞭毛内运输有关。鞭毛内运输颗粒作为运输体,能够将鞭毛组装所需“货物”运输到鞭毛组装部位。鞭毛有动力蛋白和驱动蛋白两个马达蛋白。驱动蛋白能在ATP酶水解能量的驱动下,使“货物”沿细胞骨架微管蛋白从基底部运送至鞭毛顶端,在鞭毛的正向端卸下“货物”,用来组装微管。另外,驱动蛋白还能参与细胞器或小囊泡的转运、微管的形成、染色体的分离和纺锤体的形成和延伸等[9-12]。作为驱动蛋白2中的两个动力亚基,FLA10的功能研究相对较多,但是对动力亚基FLA8的研究相对较少。因此,研究FLA8的功能可以更广泛地了解驱动蛋白2在鞭毛内运输中的功能,马达蛋白的转换以及鞭毛内运输的机制。作者克隆了杜氏盐藻的FLA8基因,将其连接到原核表达载体,并成功诱导其蛋白表达。以上结果有助于在基因和蛋白质水平研究杜氏盐藻。
[1]Sawin KE,LeGuellec K,Philippe M,et al.Mitotic spindle organization by a plus-end-directed microtubule motor[J].Nature,1992,359(6395):540
[2]Barton NR,Goldstein LS.Going mobile:microtubule motors and chromosome segregation[J].Proc Natl Acad Sci USA,1996,93(5):1735
[3]Moore JD,Endow SA.Kinesin proteins:a phylum of motors for microtubule-based motility[J]Bioessays,1996,18(3):207
[4]Wein H,Foss M,Brady B.DSK1,a novel kinesin-related protein from the diaom Cylindrotheca fusiformis that is involved in anaphase spindle elongation[J].J Cell Biol,1996,133(3):595
[5]Raich WB,Moran AN,Rothman JH.Cytokinesis and midzone microtubule organization in Caenorhabditis elegans require the kinesin-like protein ZEM-4[J].Mol Biol Cell,1998,9(8):2037
[6]李俊平,刘岷,毛丽红,等.杜氏盐藻FLA8基因全长的克隆及鉴定[J].郑州大学学报:医学版,2011,46(6):828
[7]Eley L,Yates LM,Goodship JA.Cilia and disease[J].Curr Opin Genet Develop,2005,15(3):308
[8]Marande W,Kohl L.Flagellar kinesin in protests[J].Future Microbiol,2011,6(2):231
[9]Pazour GJ,Witman GB.The vertebrate primary cilium is a sensory organelle[J].Curr Opin Cell Biol,2003,15(1):105
[10]Rosenbaum JL,Witman GB.Intraflagellar transport[J].Nat Rev Mol Cell Biol,2002,3(11):813
[11]Scholey JM.Intraflagellar transport[J].Annu Rev Cell Dev Biol,2003,19:423
[12]Qin H,Diener DR,Geimer S,et al.Intraflagellar transport(IFT)cargo:IFT transports flagellar precursors to the tip and turnover products to the cell body[J].J Cell Biol,2004,164(2):255
——一道江苏高考题的奥秘解读和拓展

