免疫磁珠富集技术进展①
闻一鸣 徐金亭 向军俭
(广东省分子免疫与抗体工程重点实验室 暨南大学抗体工程研究中心,广州510632)
免疫磁珠富集技术,是以磁性微球作为固相表面,结合免疫学方法建立起的一门具有重要应用前景的样品富集手段。具有磁性的微颗粒通过结合特定抗体,在液相中能特异性地与相应抗原结合,依靠磁场的作用力快速地使所需样品量得到大大的浓缩。由于免疫磁珠富集法具有快速及特异性强的特点,在三十余年的发展中,已广泛应用于分离及浓缩特定细胞、微生物、蛋白质和核酸片段等肉眼难以观察或样品中含量不高的物质。其应用也随着各个科学领域的发展而日趋全面和深入[1]。随着抗体技术的发展,免疫磁珠富集技术已成为细胞分选和蛋白质组学研究的重要技术支持。除此,鉴于免疫磁珠富集法有助于降低原有检测手段的检测限,其应用于食品致病微生物和环境、食品中小分子毒害物的检测将大有发展前景。
1 免疫磁珠的结构、功能与制备方法
1.1 免疫磁珠的结构 免疫磁珠是一种大小均一,表面具有特定化学基团的磁性微球。从结构上来说,它分为三部分,核心部分由磁性物质构成,如γ-Fe2O3、Fe3O4和 MeFe2O3,使磁性微球在磁场作用下能快速聚集;外层由聚苯乙烯、聚乙烯亚胺或聚丙烯酸等高分子材料包裹,保证磁性的密封性良好,不易出现漏磁现象;微球表面还覆盖有特殊的活化基团,常见的化学基团有羧基、氨基、巯基、甲苯磺酸基和环氧基等,能通过共价结合抗体蛋白上的氨基或羧基基团。近年来,一些商业机构还开发了表面具有特殊蛋白的磁性微球,如表面具有经基因工程改造的A蛋白或G蛋白的磁珠,这些磁珠对普遍抗体Fc区具有高亲和力,能藉此偶联抗体的恒定区;又如表面具有链霉亲和素的磁珠,能与生物素化的抗体紧密结合,高效地把抗体固定在微球表面。
1.2 免疫磁珠的功能 免疫磁珠的功能主要是通过表面的特异性抗体,在流体力学作用下,与液态中的相应抗原结合,并通过多次的磁分离作用,使目的抗原与其余杂质彻底分离,从而得到高度浓缩的抗原。根据磁珠表面偶联的不同抗体,免疫磁珠能在短时间内富集各种类型的抗原,如分子量极小的核酸、小分子毒素、特异性蛋白、细胞或致病微生物。这种结合了物理学、生物学和免疫学的浓缩技术,使样品的前处理过程变得简单,且重复性较高。
1.3 免疫磁珠的制备 针对拟富集的物质制备合适的免疫磁珠,是达到有效富集的关键所在,也是采用免疫磁珠富集技术的难点所在。一般来说,制备免疫磁珠的过程需要关注磁性微球的大小、表面活化基团、抗体的选择和偶联量、封闭及保存等方面[2,3]。
1.3.1 磁珠的选择 对于磁珠的挑选,一般是针对其粒径和表面活化基团进行选择。磁珠的粒径一般在纳米至微米水平,国外常见的商业用磁珠大小一般在1~4.5 μm之间,属于体积较大的磁珠,磁性较好,能通过外层大量的活性基团偶联抗体,从而结合体积相当的富集产物聚集到磁场下,实现细胞、病原微生物及其他微米级颗粒的分选和富集[4,5]。而纳米级的免疫磁珠每单位重量具有更大的表面积,分散性更好,对磁场的反应性极敏捷,适用于医学诊断、治疗和高通量分析[6]。
免疫磁珠的制备实质上是磁珠表面的活性基团与抗体外部的氨基的结合过程,这种结合可以是共价的,也可以是非共价的结合。当抗体与表面带有羧基、氨基、巯基、甲苯磺酸基和环氧基等基团的磁珠结合[6],则形成较为牢固的共价连接,不容易解离;但这类基团在偶联抗体的过程没有靶向性,会无可避免地结合在抗体的Fab区,降低免疫磁珠制备后的富集效果。相反,具有偶联靶向性的一些表面活化基团,如A蛋白和G蛋白,能通过非特异性吸附抗体Fc区,把抗体靶向吸附在磁珠表面,并暴露出与抗原结合的Fab区;链霉亲和素活化的磁性微球,则能通过偶联Fc区标有生物素的抗体,同样达到靶向偶联的目的。当然,这种通过非共价结合的偶联方式没有共价连接的稳定性高,在偶联过程可通过加入交联剂增强偶联的稳定性。
1.3.2 抗体的选择及滴度 用于制备免疫磁珠的抗体可以是单克隆抗体也可以是多克隆抗体,单抗对于目的抗原的特异性较好,利于富集后直接用于检测或分选细胞[7];多抗的亲和力往往高于单抗,易于捕获抗原,但由于其表位较多,对于富集抗原后的处理,较单抗复杂。有关抗体的滴度,一般以ELISA测定结果为参照,但值得注意的是,磁性微球作为固相载体具有立体结构,比酶标板孔的表面积大得多,更利于抗原抗体反应,因此在磁珠偶联抗体过程中,可以适当降低抗体的偶联浓度。
1.3.3 偶联的条件 抗体与磁珠偶联的条件主要是指偶联时缓冲液的体系、pH、温度和反应时间等反应条件。缓冲液的体系主要依据磁珠表面活化基团的特点进行选择,一般选择离子浓度较低的缓冲体系,并加入0.5%吐温-20以减少磁珠聚集现象[8];缓冲液pH通常在pH5~pH9.5之间,过酸或过碱都会影响抗体的活性,不建议采用。对于反应温度、时间和环境,常作为相关因素考虑。反应温度越低,偶联时间越长[9],常见的反应条件是4℃过夜、室温反应3小时或37℃ 1小时。除此,偶联的过程必须保持磁珠的良好分散性,为此可以把磁珠置于涡旋搅拌器或旋转仪,防止磁珠的聚集。
1.3.4 免疫磁珠的封闭与保存 制备后的免疫磁珠表面仍存在较多未结合抗体的位点,因此需要以一些不与抗原反应的小分子把表面活性位点封闭,以减少富集过程中的非特异性吸附。常用的封闭剂有BSA、吐温-20、明胶和甘氨酸。由于BSA和明胶颗粒较其他封闭剂的分子量大,并且在封闭过程会在磁珠表面形成疏水表面,因此适合用于封闭较大的疏水性磁珠,而吐温-20与甘氨酸则适用于封闭亲水性的小磁珠。
2 免疫磁珠富集技术的优势
2.1 操作步骤简单省时 在磁场作用下,磁珠-抗体-抗原复合物能在数秒至数分钟内在磁场中聚集,通过去除上清及适当洗涤,便可把抗原高效富集(如图1),其操作步骤极为简单,对于试剂、设备及实验条件的要求不高,适用于一般实验室与科研机构。与离心、过滤或膜分离等传统样品分离程序相比,磁分离技术利用磁珠作为固相载体,能在同一试管内完成拟富集物质的分离和洗涤;同样地,对比液相色谱仪等大型仪器,磁分离也凸显了其对于设备要求上的简便[2]。
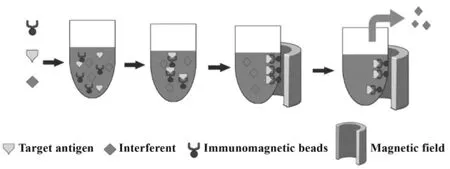
图1 免疫磁珠富集技术流程图Fig.1 The procedure of immunomagnetic enrichment technique
2.2 磁珠富集过程高保真 以往常采用离心分离富集、有机溶剂萃取和亲和层析等方式对样品进行提纯,对于样品的活性均存在一定程度的破坏,而且纯化的效率也未必很高[9]。离心技术浓缩样本是根据提取物和溶液中其余物质存在密度差,从而通过调整转速分离出提取物。然而,对于成分复杂的样品,该方法存在较大的缺陷,除此,离心后的沉淀与上清液难以通过吸取而彻底分离。有机溶剂萃取法则利用不同组分之间溶解度不同的特点进行分离,然而对于成分复杂的样品,该方法仍需要先进行样品预处理,保证溶液的组分较单一,便于萃取。亲和层析法常用于纯化蛋白质,样品能通过上柱及洗脱能获得特异性纯化,但偏酸或偏碱性的洗脱环境往往容易对蛋白质的活性造成影响。相比之下,通过磁场作用浓缩样品的免疫磁珠富集法能使所需物质高度浓缩,并且在富集过程,不破坏其生物学活性。
2.3 高特异性富集 免疫磁性微球表面覆盖着针对目的抗原的特异性抗体,在液相中能特异性识别抗原表位,并形成抗原抗体复合物,通过磁聚集与无关杂质分离,并在数次洗涤中得到纯度较高的目的抗原。过去常使用葡聚糖凝胶过滤层析分离并纯化样品中某成分,把分子量在一定范围内的物质通过葡聚糖截留,并以盐离子竞争洗脱,从而收集目的产物。该方法尽管也能起到富集效果,但无可避免地保留着分子量相近的杂质。相反,免疫磁珠富集法进一步把富集的纯度提升,充分发挥了免疫学方法的高特异性优势。
2.4 有助于提高检测限 酶联免疫吸附技术(ELISA)、免疫荧光和PCR核酸扩增法是常用于检测微量物质的方法,如水样中的寄生虫、食物样品中的致病菌含量和样品中的病毒含量等[10-15]。然而,尽管这类检测方法已经达到较高的灵敏度,但对于样品中浓度极低的检测物,仍然需要建立一套灵敏度更高的检测方法。鉴于免疫磁珠富集技术能从上游的样品前处理步骤中使目的检测物浓度大大提高,从而间接地降低了整套检测方法的检测限。因此,一系列依靠免疫磁珠富集样品,并结合各种检测技术的高灵敏检测方法应运而生,使检测限得以有效降低两个数量级或以上[16,17]。
3 免疫磁珠的主要应用领域
3.1 细胞分选及药物靶向治疗 免疫磁珠富集法最早被应用于细胞分选领域,主要有阳性筛选富集和阴性筛选富集法。根据目的细胞表面的特定表面抗原(如抗原CD3、CD24等),以标记有相应特异性抗体(如抗CD分子的抗体)的磁性微球,从样品中富集目的细胞的方法为阳性筛选富集法;相反,用特异性免疫磁珠除去样品中非目的细胞的方法即阴性筛选富集法,两种方法均可根据样品应用目的的不同富集所需的细胞。利用磁场分离纯化细胞的方法,可处理血液、骨髓、食物、水样或土样等生物类粗提液中的细胞,且通过这种方法富集的细胞依然保持良好的生物学活性,因此在生物医学领域中得到广泛应用,而在癌症的鉴定和治疗方面应用更是尤为广泛[18]。
磁性细胞分选器(Magnetic-assisted cell sorting,MACS)是根据免疫磁珠富集的原理制成的一种有效进行细胞分选的新仪器,Tucker等[19]成功应用该技术富集同源的背根神经细胞,Marek等[20]利用CD11b微珠捕获样品液中的小神经胶质细胞和星形胶质细胞,也得到了高纯度的目的细胞。MACS也被用于协助检测早期肺癌,通过偶联有抗CD14与CD16抗体,免疫磁珠能除去痰液中的巨噬细胞和中性粒细胞,使支气管上皮细胞的纯度从1.1%提升到40%,从而成为理想的样品检测物[21]。结合MACS和流式细胞术(Flow cytometry,FCM),也能富集并检测胃癌细胞,从而判定患者是否罹患胃癌[22]。磁性的药物靶向治疗以纳米微球作为载体,对于癌症治疗具有很好的前景。
目前,结合了免疫磁珠富集技术的药物靶向治疗在肿瘤诊断和治疗上,具有很好的发展前景。该治疗手段以纳米微球为载体,既使患者免受化疗带来的副作用,又提高了治疗的效果[23,24]。磁珠和药物结合后,在生物机体内,能通过外在的磁场作用,准确地完成药物在体内的空间定位,使药物聚集到理想作用位点;同时,由于药物在磁场作用下得到富集,则可减少药物注入剂量,从而减少药品的毒性副作用[25]。单克隆抗体常作为靶向药物偶联在纳米颗粒上,进入机体后通过抗原抗体反应形成复合物,促使靶细胞被免疫细胞吞噬或诱导细胞凋亡,是先进治疗癌症的有效方法之一。用于药物靶向治疗的纳米磁珠由于体积较小(常在10~100 nm之间),能顺利通过通透性较强的新生血管,从而直达肿瘤位置并留滞[1]。显然,免疫磁珠富集技术为体内靶向治疗打下了良好的基础,但该技术在生物医药领域的进一步发展,仍有赖于更多安全、稳定且有效的抗体药物的成功研制。
3.2 病原微生物的检测 病原微生物广泛存在于肉类、乳制品及水样等物质中,对于这些肉眼难发现的微生物,样品的前处理是至关重要的,免疫磁珠富集法与离心、有机溶液萃取和亲和层析等传统样品前处理方法相比,不仅快速简单,还提高了检测的可靠性和灵敏性,因此广泛应用于众多类型的食品检测和环境中的水样和土壤检测。
Lee等[26]应用免疫磁珠富集法,建立了一种快速检测淡水和海水水质的方法。他们以大肠杆菌和肠球菌含量为检测指标,通过相应抗体共价偶联羧基活化的磁珠制成免疫磁珠,捕获水样中的大肠杆菌或肠球菌,然后通过裂解细胞释放出菌体中的ATP,借助荧光素与ATP的显色反应鉴别样品中是否含有目的菌体。Yang[27]结合纳米磁珠及实时定量PCR技术,建立了快速检测营养肉汤和奶制品中单增李斯特菌的一种检测手段。在实验中,研究人员通过针对单核细胞增生李斯特菌的兔属多抗偶联纳米磁珠,使样品中的菌液得到浓缩,再设计针对该菌的特异性引物,利用实时定量PCR把富集后的样品进行核算扩增,最终以CT值(Threshold cycles)反映菌含量。该方法能检测到0.5 ml样品中含有的≥102个菌落,灵敏度甚高。上述两种利用免疫磁珠富集法的检测手段,依然需要对样品进行前增菌处理,但经过磁珠富集,增菌的时间从原来的需时2~3天,缩短为18~24小时,大大提高了检测的速度,有利于实际应用的推广。对于肠梨硅虫胞囊、分支杆菌和沙门氏菌等致病菌[28-30],也可通过磁珠富集法提升整体检测速度及灵敏度。Lien等[31]以免疫磁珠微流体用于快速检测甲型流感病毒。其操作较为简便,只需把带有藻红蛋白(一种荧光素)的抗甲型流感病毒的单克隆抗体与磁珠偶联,制备成免疫磁珠后捕获样品中的病毒颗粒,然后通过光学仪器检测样品的光强,从而判断样品中有无病毒。与只使用流式细胞术的检测手段相比,该方法灵敏度高出1 024倍,并且整个检测能在15分钟内完成,对比其他方法具有无可比拟的优势。
此外,免疫磁珠富集法还广泛应用于病毒检测当中,它使核酸在提取的过程中免受干扰酶(如RNA酶)和其他杂质的影响,确保样品处理过程的高保真[31]。Willis等[32]结合免疫磁珠分离技术及实时定量PCR,检测牛肉中大肠杆菌O157:H7的含量,该方法较只使用Real-time PCR的灵敏度更高。有研究比对了六种不同的隐孢子虫DNA提取方案,发现了采用免疫磁珠富集法提取的核酸片段,经过PCR及电泳鉴定后,条带最清晰,且阳性率最高[33]。
3.3 小分子抗原的浓缩 免疫磁珠富集技术可应用于浓缩一些半抗原小分子物质的富集,如水样或食品中的毒素和重金属等危害物。据报道,特异性的免疫磁珠能富集蓖麻毒素,借助光谱学技术,在20分钟以内便可检测出存在于牛奶中的蓖麻毒素,检测限达到 4 μg/ml[34]。Yang 等[35]制备了表面偶联有抗氯霉素的磁性微球,成功地从虾样品中提取出氯霉素。该项研究通过仪器分析免疫磁珠与抗原结合后的磁性减少量,从而判断抗原的结合率,更直观地展现了免疫磁珠的富集优势。目前,有关免疫磁珠用于富集小分子物质的研究仍不多见,主要是因为制备相关抗体难度较大且研发周期较长。鉴于近年来有关小分子毒物的污染事件愈发突出,许多科研机构已研发出针对毒素或各类重金属的高效价抗体[36-38],为免疫磁珠富集技术在这领域的应用打下了良好的基础。
3.4 蛋白质分析 随着蛋白质组学研究的兴起,免疫磁珠富集手段更多地被用于寻找并富集特定细胞株里的生物标记物。这些在细胞上清中含量较低的蛋白质,能被偶联了特异性抗体的磁珠捕获,并通过质谱分析鉴定。Aqai Payam等[39]利用超顺磁性微球偶联单克隆抗体,对存在于谷物中的真菌毒素蛋白进行分选,并结合液相色谱技术准确检测。通过免疫磁珠富集技术,初始含量极低的生物标记物得以高效浓缩并通过质谱被鉴定出来。Nylandsted等[40]利用免疫磁珠浓缩技术纯化溶酶体,比较正常状态下和癌症状态下溶酶体的性质差异,从而发现了原癌基因ErbB2的异位表达,导致了溶酶体膜蛋白质组发生显著性差异,最终使癌细胞高度扩散。Careri等[41]则把免疫磁珠富集方法应用于收集样品中浓度较低的花生过敏原蛋白,他们利用表面连有Protein A的磁性微粒偶联特异性单抗,直接从样品中富集到抗原Ara h3/4花生蛋白。
4 展望
免疫磁珠的发展至今已30余年,在众多科研工作者的努力下,免疫磁珠的应用日渐广泛及成功。国外商业用的免疫磁珠生产已走向稳定化和多元化发展,科研单位也能根据自身需要,采用化学方法合成所需的免疫磁珠。
目前,对于免疫磁珠的制备已有较为丰富的理论及实践依据,但抗体在偶联磁珠后活性、亲和力和效价有所降低往往会影响下游技术应用的效果,成为制约此富集技术应用的一个关键因素。因此,优化免疫磁珠制备方法,确保抗体偶联后保持良好活性和亲和力是应用此项富集技术的重要环节。除此,免疫磁珠在捕获抗原后,如何有效地解吸附,顺利进入下一环节的应用也是免疫磁珠富集技术在结合其他领域技术时所要关注的。
免疫磁珠富集技术所具备的特异性强、快速、操作简便及重复性强等多个优势必将给科研带来更多的便捷,过去在细胞分选领域的应用已得到广泛的成功,并为众多科研机构所推行。今后,免疫磁珠富集技术将更多地应用于病原微生物检测、药物靶向治疗、分子生物学领域及蛋白质组学的研究中,对于已有的样品检测方法及生物医学的药物研究注入新的动力。
1 Corchero J L,Villaverde A.Biomedical applications of distally controlled magnetic nanoparticles[J]Trends Biotechnol,2009;27(8):468-476.
2 Safarik I,Safarikova M.Magnetic techniques for the isolation and purification of proteins and peptides [J].Biomagn Res Technol,2004;2(1):1-17.
3 Daniel Horak,Michal Babic,Hana Mackova et al.Preparation and properties of magnetic nano-and microsized particles for biological and environmental separations[J].J SEP SCI,2007;30(11):1751-1772.
4 Lea T,Vartdal F,Davies C et al.Magnetic monosized polymer particles for fast and specific fractionation of human mononuclear cells[J].Scand J Immunol,1985;22(2):207-216.
5 Skjerve E,R∅rvik L M,Olsvik O et al.Detection of Listeria monocytogenes in foods by immunomagnetic separation[J].Applied and environmental microbiology,1990;56(11):3478-3481.
6 Erathodiyil N,Ying J Y.Functionalization of inorganic nanoparticles for bioimaging applications[J].Acc Chem Res,2011;44(10):925-935.
7 Gee A P,D Rechtenwald,Ralbruce A.Immunomagnetic cell separation using antibodies and superparamagnetic microspheres[M].New York:Marcel Dekker,Inc.,1998:25-28.
8 徐金亭,李志清,向军俭.单增李斯特菌免疫磁珠的制备研究[J].食品工业科技,2012;33(5):323-327.
9 Stevens K A,Jaykus L A.Bacterial separation and concentration from complex sample matrices:a review[J].Crit Rev Microbiol,2004;30(1):7-24.
10 Seo S M,Cho I H,Jeon J W et al.An ELISA-on-a-chip biosensor system coupled with immunomagnetic separation for the detection of vibrio parahaemolyticus within a single working day[J].J Food Protect,2010;73(8):1466-1473.
11 Sturbaum G D,Klonicki P T,Marshall M M et al.Immunomagnetic separation(IMS)-fluorescent antibody detection and IMS-PCR detection of seeded Cryptosporidium parvum oocysts in natural waters and their limitations[J].Appl Environ Microb,2002;68(6):2991-2996.
12 Fluit A C,Torensma R,Visser M J et al.Detection of Listeria monocytogenes in cheese with the magnetic immuno-polymerase chain reaction assay[J].Appl Environ Microbiol,1993;59(5):1289-1293.
13 Mendgen K.Growth of verticillium lecanii in pustules of stripe rust(puccinia striformis) [J].Phytopathol Z,1981;102(3):301-309.
14 Qiu J M,Zhou Y,Chen H et al.Immunomagnetic separation and rapid detection of bacteria using bioluminescence and microfluidics[J].Talanta,2009;79(3):787-795.
15 Yang W,Gu A Z,Zeng S Y et al.Development of a combined immunomagnetic separation and quantitative reverse transcription-PCR assay for sensitive detection of infectious rotavirus in water samples[J].J Microbiol Meth,2011;84(3):447-453.
16 Reidt U,Geisberger B,Heller C et al.Automated immunomagnetic processing and separation of Legionella pneumophila with manual detection by sandwich ELISA and PCR amplification of the ompS gene[J].J Lab Autom,2011;16(2):157-164.
17 Yang W,Gu A Z,Zeng S Y et al.Development of a combined immunomagnetic separation and quantitative reverse transcription-PCR assay for sensitive detection of infectious rotavirus in water samples[J].J Microbiol Methods,2011;84(3):447-453.
18 Horák D,Babic M,Macková H et al.Preparation and properties of magnetic nano-and microsized particles for biological and environmental separations[J].J Sep Sci,2007;30(11):1751-1772.
19 Tucker B A,Rahimtula M,Mearow K M et al.A procedure for selecting and culturing subpopulations of neurons from rat dorsal root ganglia using magnetic beads[J].Brain Res Brain Res Protoc,2005;16(1-3):50-57.
20 Marek R,Caruso M,Rostami A et al.Magnetic cell sorting:a fast and effective method of concurrent isolation of high purity viable astrocytes and microglia from neonatal mouse brain tissue[J].J Neurosci Methods,2008;175(1):108-118.
21 Qiu Q,Todd N W,Li R et al.Magnetic enrichment of bronchial epithelial cells from sputum for lung cancer diagnosis[J].Cancer,2008;114(4):275-283.
22 Wang G Y,Li L,Yu Y M et al.Detection of disseminated tumor cells in bone marrow of gastric cancer using magnetic activated cell sorting and fluorescent activated cell sorting[J].J Gastroenterol Hepatol,2009;24(2):299-306.
23 Laurent S,Forge D,Port M et al.Magnetic iron oxide nanoparticles:Synthesis,stabilization,vectorization,physicochemical characterizations,and biological applications[J].Chem Rev,2008;108(6):2064-2110.
24 Gupta A K,Gupta M.Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications[J].Biomaterials,2005;26(18):3995-4021.
25 Corchero J,Villaverde A.Biomedical applications of distally controlled magnetic nanoparticles [J].Trends Biotechnol,2009;27(8):468-476.
26 Lee C M,Griffith J F,Kaiser W et al.Covalently linked immunomagnetic separation/adenosine triphosphate technique(Cov-IMS/ATP)enables rapid,in-field detection and quantification of Escherichia coli and Enterococcus spp.in freshwater and marine environments[J].J Appl Microbiol,2010;109(1):324-333.
27 Yang H,Qu L,Wimbrow A N et al.Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR[J].Int J Food Microbiol,2007;118(2):132-138.
28 Keserue H A,Fuchslin H P,Egli T et al.Rapid detection and enumeration of Giardia lamblia Cysts in water samples by immunomagnetic separation and flow cytometric analysis[J].J Appl Environ Microb,2011;77(15):5420-5427.
29 Kaittanis C,Naser S A,Perez J M et al.One-step,nanoparticlemediated bacterial detection with magnetic relaxation[J].Nano Lett,2007;7(2):380-383.
30 Leon-Velarde C G,Zosherafatein L,Odumeru J A et al.Application of an automated immunomagnetic separation-enzyme immunoassay for the detection of Salmonella enterica subspecies enterica from poultry environmental swabs[J].J Microbiol Methods,2009;79(1):13-17.
31 Lien K Y,Hung L Y,Huang T B et al.Rapid detection of influenza A virus infection utilizing an immunomagnetic bead-based microfluidic system[J].Biosens Bioelectron,2011;26(9):3900-3907.
32 Fedio W M,Jinneman K C,Yoshitomi K J et al.Detection of E.coli O157:H7 in raw ground beef by PathatrixTMimmunomagnetic-separation,real-time PCR and cultural methods[J].Int J Food Microbiol,2011;148(2):87-92.
33 Jiang J,Alderisio K A,Singh A et al.Development of procedures for direct extraction of Cryptosporidium DNA from water concentrates and for relief of PCR inhibitors[J].Appl Environ Microbiol,2005;71(3):1135-1141.
34 He L L,Deen B,Rodda T et al.Rapid detection of ricin in milk using immunomagnetic separation combined with surface-enhanced raman spectroscopy[J].Journal of Food Science,2011;76(5):N49-N53.
35 Yang S Y,Ho C S,Lee C L et al.Immunomagnetic reduction assay on chloramphenicol extracted from shrimp[J].Food Chem,2012;131(3):1021-1025.
36 张彩霞,闫鸿鹏,名郑杰et al.雪卡毒素单克隆抗体的制备及鉴定[J].免疫学杂志,2011;27(10):890-893.
37 翟一凡,向军俭,唐 勇et al.重金属铅多克隆抗体的制备及鉴定[J].食品科学,2010;31(13):180-183.
38 颜 露,唐 勇,向军俭 et al.抗重金属Cr~(3+)单克隆抗体的制备及其应用[J].细胞与分子免疫学杂志,2011;27(4):422-424.
39 Aqai P,Peters J,Gerssen A et al.Immunomagnetic microbeads for screening with flow cytometry and identification with nano-liquid chromatography mass spectrometry of ochratoxins in wheat and cereal[J].Anal Bioanal chem,2011;400(9):3085-3096.
40 Nylandsted J,Becker A C,Bun kenborg J et al.ErbB2-associated changes in the lysosomal proteome[J].Proteomics,2011;11(14):2830-2838.
41 Careri M,Elviri L,Lagos J B et al.Selective and rapid immunomagnetic bead-based smaple treatment for the liquid chromatograply-electrospray ion-trap mass spectrometry detection of Ara h3/4 peanut protein in foods[J].J Chromatogr A,2008;1206(2):89-94.