采用布氏田鼠建立动物流感病毒感染模型的试验研究
刘洪强,吴德峰,陈吉龙
(1.福州大北农生物技术有限公司,福建 福州 350014; 2.福建农林大学 动物科学学院,福建 福州350002;3.中国科学院 微生物研究所,北京100101)
流感病毒(Influenza virus, IFV)能引起急性呼吸道疾病,是严重危害人畜健康的一种传染疾病。在世界范围广泛存在,每年约有15%~20%的人群被流感病毒感染,最近一次流感病毒疫情是2009年爆发的甲型流感病毒H1N1,此次疫情全球共确诊病例达到1311522人,其中死亡14142人。流感病毒的大流行给人类社会造成了巨大的经济损失。因此,研究流感病毒的致病机制及其分子生物学特性,对治疗和预防流感病毒有重大意义[1-2]。
在流感病毒的研究过程中,合理动物模型的建立对于研究流感病毒和宿主相互作用的致病机制非常重要。通过模型动物可以评价抗病毒药物及疫苗抗流感病毒的效果及其本身的安全性。动物模型在选择上需要遵守几个原则,即相似性、可重复性、可靠性、生物安全性及易行性和经济性[3-6]。当前用于流感病毒研究的动物有:雪貂、小鼠、金黄仓鼠、棉鼠及非人类灵长类动物(食蟹猴和豚尾猴等)等。考虑到经济,来源及生物安全等因素,现在实验室常用的流感动物模型首选的是小鼠模型[7-12]。
1 材料和方法
1.1 材 料
流感病毒株为A/WSN/33(H1N1),由中科院微生物研究所试验室经12质粒反向重组包装而得。细胞株为MDCK细胞;布氏田鼠由中国科学院动物研究所和中国医学科学院试验动物研究所提供;SPF鸡胚购自北京梅里亚维通试验动物;
1.2 仪器设备与试剂
仪器设备与试剂均由中科院微生物所提供。
1.3 试验方法
布氏田鼠麻醉后,根据Reed-Muench方法计算LD50的10倍量的A/WSN/33(H1N1)病毒通过滴鼻的接种方式,对布氏田鼠进行攻毒。对照组则采用鸡胚尿囊液,其它步骤与攻毒组一样。
1.4 临床观察及测量指标
参照其它小鼠模型观察和测量的指标进行;以攻毒当天为开始,每隔24 h观测相应的指标。
1.5 取材及固定
小鼠死亡后及时尸检取材,尸检后检查其脏器的组织病理学上的变化并及时记录;脏器用PBS冲洗后,一部分脏器组织用4%多聚甲醛溶液进行充分固定后,进行HE染色等试验;另一部分脏器组织取出后立即用液氮速冻,放置超低温冰箱保存。
1.5.1 MDCK细胞分离 将病死小鼠肺脏反复冻融后(目的使组织细胞中的病毒颗粒充分释放出来),每个肺脏加1 mL DMEM培养液用组织匀浆器充分研磨后3 000 rpm离心5 min,取上清,加入1/5体积的双抗(青霉素、链霉素各1000 IU/mL)4 ℃过夜。次日4 ℃ 10 000 rpm离心10 min后取上清,稀释10倍后加入100 μL/孔MDCK单层细胞,连续72 h观察细胞病变。
1.5.2 病毒鸡胚尿囊腔分离[13]将上述对脏器组织分离的病毒,按0.1 mL/胚的剂量尿囊腔途径接种于9~11日龄SPF鸡胚,其接种方法同试验一。
收获的鸡胚尿囊液进行红细胞凝集试验检测脏器组织扩增的HA效价。对首次病毒分离血凝结果呈阴性的样品继续传代两次,若用HA试验仍不能检测到红细胞的凝集,则可以被认为此脏器的病毒分离为阴性。
1.6 RT-PCR检测:
1.6.1 PCR引物的合成: Forward primer: GCGTCGACGCCACCATGGGGAAGGCAAAA-CTACTGGTCCT Reverse primer: TCAATTGCTCCCTCAGTTCC
1.6.2 RNA的提取 RNA的提取按天根公司TRZOL说明书进行,然后取3 uL电泳检验RNA。将获得的RNA反转录成cDNA,用于PCR试验,分析脏器组织中病毒HA基因的表达。反转录采用购于Promega公司的M-MLV逆转录酶进行。然后用反转录所得的cDNA进行PCR,以检测脏器组织中流感病毒HA基因的存在情况。
1.7 评价指标
流感病毒感染布氏田鼠模型的建立前提条件即为布氏田鼠是否对A/WSN/33(H1N1)流感病毒株具有敏感性及复制性,在此前提下,进一步建立稳定的流感病毒感染布氏田鼠的动物模型及模型的指标。流感病毒对布氏田鼠的易感性及流感病毒的布氏田鼠动物模型建立的评价指标如下:(1)体质量变化:接种的当天记为第一天,每24 h测量体重一次,并记录;(2)临床症状的变化:按照流感病毒的其它小鼠动物模型的感染症状进行参考,观察感染布氏田鼠的相应症状,包括:精神状态、毛色、饮食、行为活动及呼吸情况等;(3)肺脏指数:为小鼠肺脏质量比小鼠体质量;(4)病理变化:包括肺脏、肝脏等脏器的病理变化及其相应的病理组织学变化;(5)病毒的分离:采取感染小鼠的组织进行病毒的分离,红细胞凝集试验进行鉴定;(6)免疫组织化学法检测:检测感染小鼠中流感病毒颗粒;
2 结果与分析
2.1 A/WSN/33(H1N1)流感病毒对布什田鼠的感染性测定
试验将病毒以不同的稀释度通过滴鼻接种的方式,对布氏田鼠攻毒,试验共分为6个组,其中一个组为鸡胚尿囊液的对照组,另外5组布氏田鼠则分别感染病毒稀释倍数为10-1~10-5。布氏田鼠攻毒1 d后,攻毒组即出现较明显的临床症状,如体重下降,精神沉郁等,后期体质量下降严重,反应性降低,嗜睡,呼吸困难等,对照组小鼠没有任何临床症状,体质量呈上升趋势,呼吸良好,精神状态良好,采食性及饮水性都正常。结果表明,攻毒的病毒其稀释度越低则对布氏田鼠的致病力越强,符合正常感染规律。
A/WSN/33(H1N1)流感病毒感染布什田鼠后,其潜伏期为1~3 d,病程为2~7 d,感染7 d后,小鼠体质量不再下降的小鼠症状逐渐减轻。通过Reed-Muench法计算病毒的LD50为10-4.5/0.10 mL(见表1)。
通过以上试验的结果可以表明,布氏田鼠对A/WSN/33(H1N1)流感病毒易感性很强,而且感染后能够表现出比较明显的临床症状及与人相似的症状表现,因此,从易感性方面及临床症状表现等方面,布氏田鼠可以作为流感病毒感染的动物模型备选动物。对于其模型的建立,需要进一步检测和评价布氏田鼠作为流感病毒感染模型的模型标准。

表1 布氏田鼠感染流感病毒后死亡情况Table 1 Infected result of mice infected A/WSN/33(H1N1)virus
2.2 布氏田鼠模型的建立结果
2.2.1 临床症状与体质量变化 试验组攻毒后,感染小鼠1~2 d发病,前期表现出精神沉郁、采食量减少、反应性降低,眼半闭,聚堆等,感染后期则出现呼吸困难、嗜睡、闭目、被毛逆立、缩头弓背、消瘦、死亡等临床症状,恢复期从7~8 d开始,临床症状开始减轻,精神状态开始好转,反应性及活动性增强,采食量逐渐恢复,最后逐渐恢复正常。对照组小鼠,始终精神状态良好,采食量及反应性都正常,未出现任何临床症状。
试验布氏田鼠在攻毒前,其体质量都表现正常,试验组和对照组无明显区别。攻毒后,对照组布氏田鼠体质量继续逐日上升,试验组小鼠攻毒后第一天就出现体质量的下降,7~8 d后体质量不再下降的小鼠,逐渐恢复正常(见图2)。
2.2.2 组织病理学变化结果 死亡小鼠剖检可见感染小鼠肺脏有明显的病理变化,肺脏淤血、充血和水肿,肺脏体积有明显增大,肺脏组织局部有轻度实变。肝脏、肾脏有轻微淤血,肿大不明显,其它脏器组织的可见病理变化不明显。对照组布氏田鼠的剖检结果显示基本正常。
肺脏镜下病理变化:肺间质间有明显的慢性炎症,大量炎性细胞浸润其中,间质毛细血管扩张充血,肺泡上皮细胞坏死脱落,肺泡腔中大量的红细胞及炎性粒细胞充盈,肺泡膈增厚,炎性区肺泡消失,(见图3)。鸡胚尿囊液对照组未见病理改变。
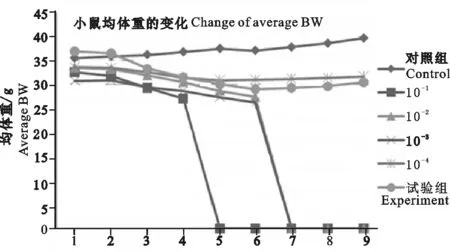
图1 试验各组体质量下降变化情况Fig. 1 Infected result of mice infected A/WSN/33(H1N1)virus

图2布氏田鼠感染A/WSN/33(H1N1)后体质量变化Fig. 2 Infected result of mice infected A/WSN/33(H1N1)virus
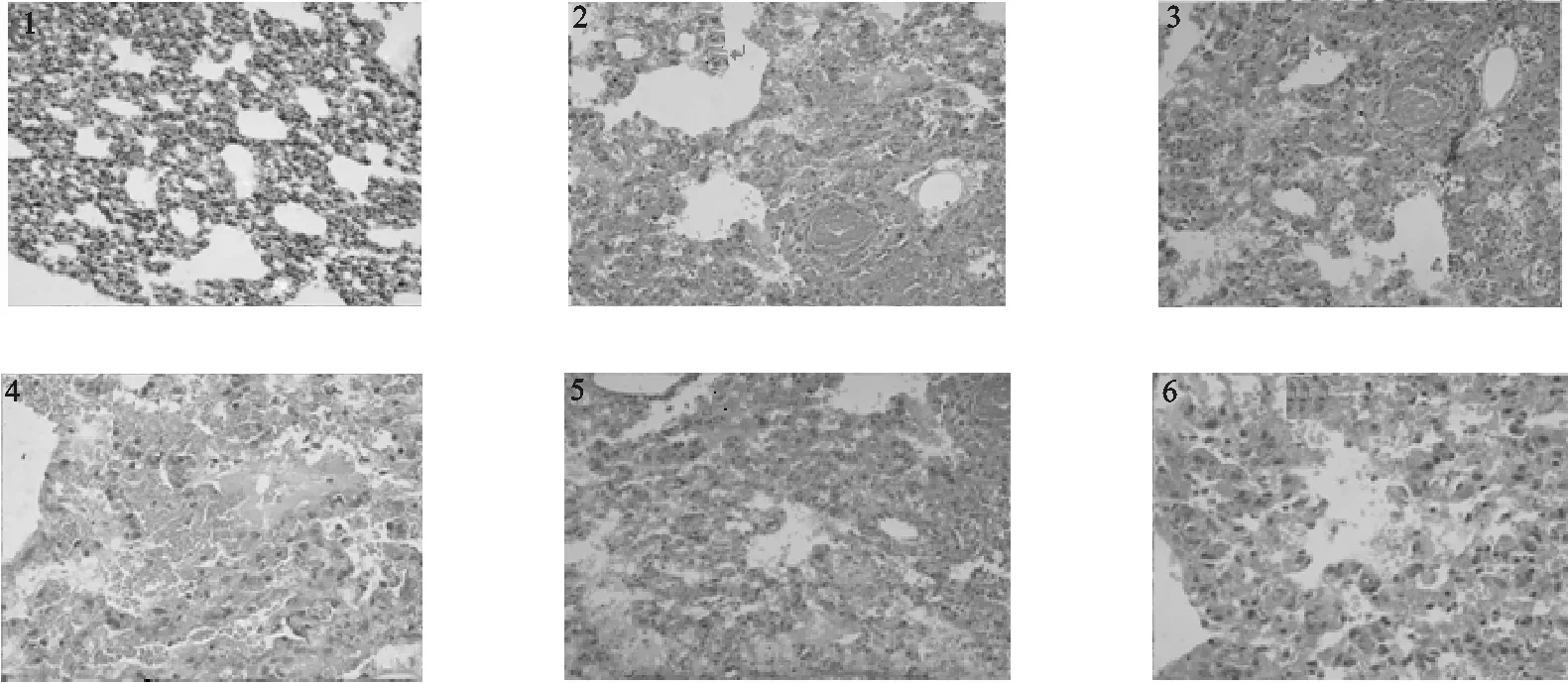
图3 流感病毒感染布氏田鼠的肺组织病理图片Fig. 3 HE pathological section of mice1.正常肺脏组织HE染色(10×20);2-6.感染流感病毒死亡小鼠的肺脏组织HE染色1.No abnormality is seen in Lung of the mice(10×20);2-6.The histological appearance of the lung
肝脏镜下病理变化:肝脏变化不明显,有的肝脏出血、淤血,肝窦充血,有部分出现肝脂肪性变性(见图4)。鸡胚尿囊液对照组未见病理改变。
肾脏组织镜下病理变化:部分肾小管的上皮细胞脱落、坏死,肾髓质间质局部淤血等(见图5)。鸡胚尿囊液对照组未见病理改变。
另外,气管的固有层和肌层出血,局部有炎性细胞浸润。其它的脏器组织未见明显的病理变化。
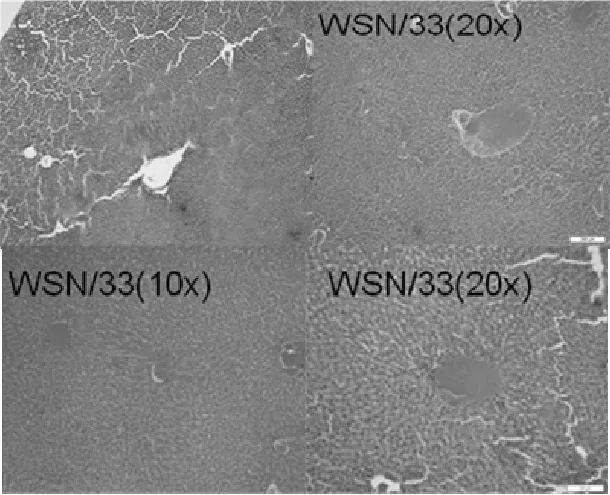
图4 流感病毒感染布氏田鼠的肝脏组织病理图片(HE)Fig. 4 HE pathological section of mice
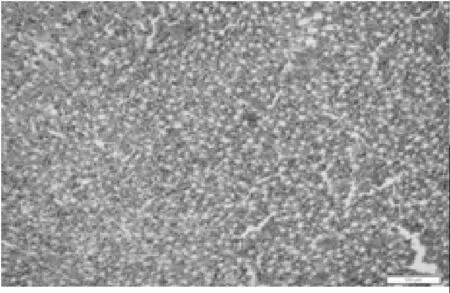
图5 流感病毒感染布氏田鼠的肾脏组织病理图片(HE10×20)Fig. 5 HE pathological section of mice
2.2.3 免疫组织化学检测 用A/WSN/33(H1N1)流感病毒NP蛋白的多克隆抗体和生物素标记的山羊抗兔的二抗做死亡小鼠的免疫组织化学检测,其阳性结果在组织细胞中可见棕黄色的颗粒,阴性结果则相反。结果表明在肺脏的上皮细胞中可以看到棕黄色的阳性颗粒,证明流感病毒在布氏田鼠的肺脏中存在(见图6)。
2.2.4 流感病毒的分离 鸡胚接种分离流感病毒结果死亡布氏田鼠肺脏上清接种SPF鸡胚分离流感病毒,然后通过红细胞凝集试验检测流感病毒的存在,结果为阴性的,连续传三代鸡胚,如还没有则为阴性。在小鼠的肺脏及肾脏中分离的病毒经鸡胚传代后,能够检测到红细胞凝集,其它组织则没有出现阳性结果。
2.2.5 脏器RT-PCR结果 死亡的布氏田鼠各脏器组织经反复冻融充分研磨,在避免RNA降解的前提下,提取各脏器组织总RNA,然后进行反转录,合成cDNA后,用A/WSN/33(H5N1)流感病毒的HA基因中某一段序列设计引物,其扩增目的基因的片段为370 bp,通过PCR反应特异性扩增WSN病毒的 这一段HA基因片段。
RT-PCR 扩增结果表明,在小鼠的肺脏、肝脏和肾脏中检测到流感病毒的相应大小的HA基因片段的存在。在其它脏器组织中则没有检测到HA片段基因。(如图7)
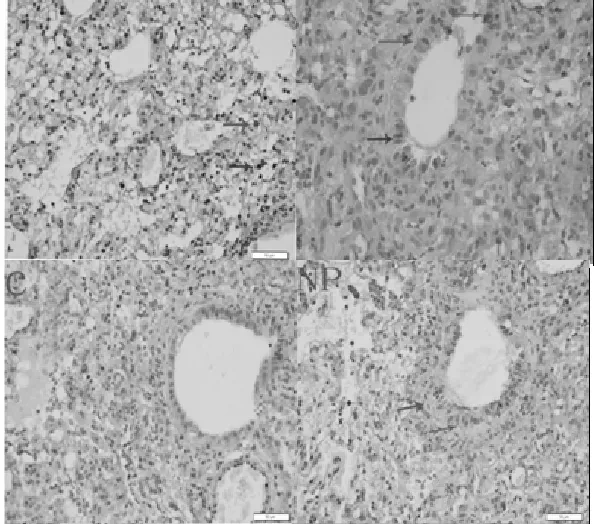
图6 WSN/33(H1N1)感染布氏田鼠NP抗体免疫组化(10×40)Fig.6 Immunohistochemistry SP of Mice lung
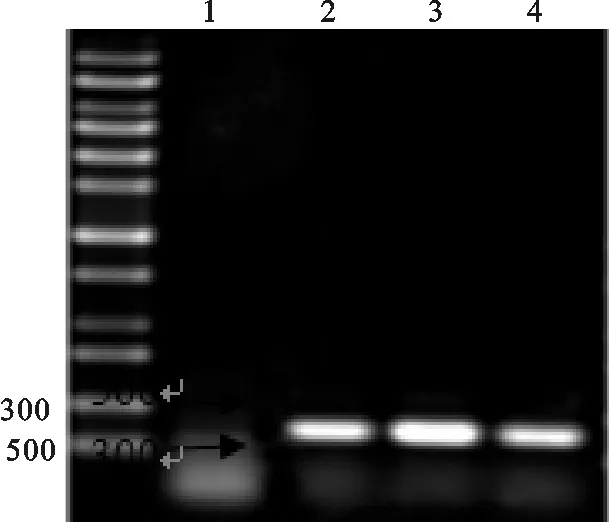
图7 小鼠脏器组织PCR扩增HA基因片段电泳结果Fig.7 Results of RT-PCR on organs of mice1.Marker;2.阴性对照;3.肝脏;4.肺脏;5.肾脏1.Marker;2.Negative;3.Liver;4.Lung;5.Kidney
3 讨 论
3.1 建立流感动物模型的临床价值
流感病毒感染人后能够导致从亚临床感染到严重的病毒性肺炎为主的呼吸系统疾病,并可导致死亡。流感病毒动物模型对于弄清病毒与宿主之间相互作用而致病的机制是非常必要的。另外模型的一个重要作用是可以用于一些抗流感病毒药物及疫苗效果的临床前期的评估。现在用于流感动物模型的对象主要有雪貂、小鼠、豚鼠、仓鼠等。鼠类作为流感动物模型有很多优点,包括遗传背景比较简单,便于饲养及比较廉价,感染症状与人比较相似,有比较明显的临床症状,便于对于疾病的评价。许多人流感病毒不能直接感染小鼠,需要在小鼠内连续传代后获得其相应的鼠适应株后,才具有较好的感染效果。小鼠感染后会呈现一定的临床症状,包括体质量下降、精神沉郁、呼吸急促等,剖检一般可见以肺炎为主的肺脏病理变化,而其它脏器相对不明显。本试验主要目的是通过参考其它流感病毒动物模型标准来建立流感病毒感染布氏田鼠的模型并建立其相应的评价标准,以期下一步能够为评估自然条件下流感病毒的致病机制和宿主的免疫机制打下基础,从而为流感病毒的预防和控制提供技术支撑。
布氏田鼠对流感病毒的易感性研究结果表明,流感病毒可以感染布氏田鼠,并且布氏田鼠对流感病毒非常敏感,感染后布氏田鼠表现出极高的感染率和死亡率,证明布氏田鼠可以用于下一步的流感病毒动物模型的研究。
3.2 流感病毒感染布氏田鼠的临床症状
流感病毒经滴鼻的接种方式感染布氏田鼠后,其潜伏期短,1~2 d即发病,前期表现体质量降低、精神沉郁、采食量减少、反应性降低,眼半闭,聚堆等,感染后期则出现呼吸困难、嗜睡、闭目、被毛逆立、缩头弓背、消瘦、死亡等临床症状,剖检可见肺脏肿大充血、淤血,肺脏组织局部有轻度实变。肝脏、肾脏有轻微淤血,肿大不明显,其它脏器组织可见病理变化不明显。组织病理学主要为肺脏的病变,以间质性肺炎为主,可见肺泡中大量炎性细胞浸润其中,间质毛细血管扩张充血,肺泡上皮细胞坏死脱落,肺泡腔中大量的红细胞及炎性粒细胞充盈,肺泡间膈增厚,炎性区肺泡消失。其它脏器则不明显。
恢复期从7~8 d开始,临床症状开始减轻,精神状态开始好转,反应性及活动性增强,采食量逐渐恢复,体质量也开始恢复,最后逐渐恢复正常。
3.3 布氏田鼠体质量的变化
试验结果分析表明,流感病毒感染布氏田鼠后可以导致其体质量的下降,这与其它流感病毒感染小鼠模型指标相一致。而且体质量的变化可以用于对于整个疾病过程的评估,前期症状中体质量的降低是评价小鼠感染的指标之一,后期对于疾病的发展也是一个重要的参考,如果体质量持续下降,最终小鼠可能死亡。如果7~8 d后,体质量不再下降并逐渐恢复,则小鼠最终转归。体质量的变化被认为是流感病毒小鼠模型建立成功的重要指标之一。
3.4 病毒的分离及其检测指标
通过对感染流感病毒的布氏田鼠的脏器中病毒的分离结果表明,肺脏的上清接种MDCK细胞后,可见明显的细胞肿胀圆化,细胞间隙增大,细胞核固缩或破裂,严重时细胞部分或全部脱落等细胞病变,其它脏器通过SPF鸡胚扩增后,只有肝脏中检测到了有血凝。
流感病毒感染布氏田鼠能够出现严重的临床症状并且死亡,这种结果是流感病毒与宿主布氏田鼠之间共同作用产生的。说明流感病毒可以在布氏田鼠的肺脏中大量存在和复制,因而引起了肺脏的病理变化,是布氏田鼠发病、死亡的重要致病机制。如果在发病期,小鼠获得了较强的免疫力,并能够清除病毒,则小鼠会逐步恢复至正常。
本次试验采用了RT-PCR及免疫组织化学等方法检测了死亡布氏田鼠中流感病毒存在情况表明,在其肺脏中都检测到了流感病毒的存在,说明流感病毒感染布氏田鼠的主要靶器官为肺脏,与其它流感病毒动物模型相一致。
综上所述,通过滴鼻的接种方式可以使布氏田鼠人为感染流感病毒,并且布氏田鼠表现出较强的易感性和致病性,感染后可引起与人相似的临床特征及肺部的病理变化。并且其发病规律与人也极为相似,对于模型的检测指标结果明确可靠,表明布氏田鼠可以作为流感病毒感染的良好动物模型,并且获得了稳定的布氏田鼠模型建立的评价指标。
4 结 论
布氏田鼠可以作为一个流感病毒感染的动物模型,试验成功建立了布氏田鼠的流感病毒感染模型,并通过体质量变化、临床症状和病理变化、病毒分离及病毒的检测等方面确立了其作为流感病毒感染模型的评价指标,说明成功建立了流感病毒感染布氏田鼠的动物模型。
参考文献:
[1] Reid A H,Taubenberger J K,Fanning T G, The 1918 Spanish influenza: integrating history and biology[J]. Microbes Infect, 2001,3(1):81-7.
[2] Horimoto Y, Dee D R,Yada R Y.Multifunctional aspartic peptidase prosegments[J]. N Biotechnol, 2009,25(5):318-24.
[3] Noah D L,Krug R M.Influenza virus virulence and its molecular determinants[J]. Advances in Virus Research, 2005,65:121-145.
[4] Joseph T.Evaluation of replication and pathogenicity of avian influenza a H7 subtype viruses in a mouse model[J]. Journal of virology, 2007,81(19):10558.
[5] Lamb R.The influenza virus RNA segments and their encoded proteins Genetics of influenza viruses[J]. Springer Verlag New York,1983,21-69.
[6] Chen W. A novel influenza A virus mitochondrial protein that induces cell death[J]. Nature medicine, 2001,7(12):1 306-1 312.
[7] Yuan P.Crystal structure of an avian influenza polymerase PAN reveals an endonuclease active site[J]. Nature,2009,458(7240): 909-913.
[8] Wilson I,Skehel J,Wiley D.Structure of the haemagglutinin membrane glycoprotein of influenza virus at 3 Å resolution[J]. Nature,1981,289(5796):366-373.
[9] Webster R,Reay P,Laver W. Protection against lethal influenza with neuraminidase[J]. Virology, 1988,164(1):230-237.
[10] Hu Y C.Dual expression of the HA protein of H5N2 avian influenza virus in a baculovirus system[J]. Journal of virological methods, 2006,135(1):43-48.
[11] Bullough P A.Structure of influenza haemagglutinin at the pH of membrane fusion[J]. Nature, 1994,371(6492):37-43.
[12] Ruat C.Vaccination of macaques with adjuvanted formalin-inactivated influenza A virus (H5N1) vaccines: protection against H5N1 challenge without disease enhancement[J]. Journal of virology, 2008,82(5):2 565.
[13] 陈声明,刘丽丽.微生物学研究法[M]. 北京:中国农业科技出版社,1996,127-128.

