不同温度和不同初始气体浓度对杨桃呼吸初值的影响
麦馨允,胡长鹰,,*,王志伟
(1.暨南大学食品科学与工程系,广东广州 510632;2.广东省普通高校产品包装与物流重点实验室,广东珠海 519070)
不同温度和不同初始气体浓度对杨桃呼吸初值的影响
麦馨允1,胡长鹰1,2,*,王志伟2
(1.暨南大学食品科学与工程系,广东广州 510632;2.广东省普通高校产品包装与物流重点实验室,广东珠海 519070)
以杨桃为实验对象,研究不同贮藏温度(5、15、25℃)和不同初始气体比例(O2:5%、13%、21%,CO2:0%、5%、13%、20%) 条件下密闭包装内杨桃呼吸初值的变化。结果表明:温度对呼吸初值的影响显著 (p<0.05),且遵循Arrhenius公式。O2和CO2的初始比例对呼吸初值的影响十分显著(p<0.05),初始气体中O2比例升高,杨桃呼吸初值增大;CO2比例升高,杨桃的呼吸初值减小。在高温条件下,O2和CO2初始比例对呼吸初值的影响比在低温条件下的影响大。将Arrhenius公式与无竞争型Michaelis-Menten模型结合,通过回归分析,建立了呼吸初值与贮藏温度、初始气体比例的关系模型。在12℃下,对所得模型进行了验证,实测值与模型预测值的Pearson相关系数>0.963,证明该模型可靠。
初始呼吸速率,初始气体比例,温度,模型,杨桃
杨桃果实采后还进行着强烈的呼吸,其货架期非常短,因此控制采后杨桃的呼吸速率对于采后保鲜非常重要。而呼吸初值是呼吸速率的一种重要参数,呼吸初值是指鲜果在采用气调保鲜时刻起,在适当的贮藏时间内(1~7h)表现出来的呼吸速率数值。研究呼吸初值的意义在于:a.根据果蔬呼吸初值大小差异来对果蔬呼吸强度进行等级划分,果蔬的呼吸初值与其耐贮性之间存在着负相关关系,呼吸初值越小,其保质期通常越长;b.呼吸初值与温度的关系体现了鲜果呼吸对温度变化的敏感性,在贮藏过程中,要控制好对温度比较敏感的果蔬的贮藏温度,避免因温度漂移和波动而造成的果蔬代谢紊乱和质量受损[1]。
再者,呼吸速率是温度、O2和CO2浓度的函数,一般来说,低温、低O2和高CO2含量可减少O2的吸收和CO2的释放,达到果蔬保鲜的效果。气调包装(Modified atmosphere packaging,MAP)主要应用于采后新鲜农产品的保鲜,MAP替换包装内的气体组分,使果蔬贮藏的包装内达到合适的贮藏气体氛围,从而降低采后果蔬的呼吸速率,延缓果蔬的衰老。MAP保鲜技术需要一个合适的MAP设计,要求建立一个呼吸速率和温度、气体浓度之间的数学模型[2-3]。
本文主要研究贮藏温度和初始气体浓度对杨桃呼吸初值的影响,尝试建立不同温度和不同初始气体浓度下杨桃呼吸初值的预测模型,以期为杨桃MAP保鲜提供实验依据。
1 材料与方法
1.1 材料与仪器
杨桃 采自珠海市某果园,品种为香蜜甜杨桃(潮州),果实质量和体型相似,表面洁净无破损,水果外观色泽符合Index 2的要求[4],即:果皮绿色,达到采收成熟,所有的水果采收后立即运回实验室;气体(N2、O2、CO2) 珠海市伟名发展有限公司,技术指标≥99.5%。
MAP-QT200扎口气调包装机 温州奔腾机械制造有限公司;森瑞真空包装机 温州奔腾机械制造有限公司;SPX-250BS-Ⅱ生化培养箱 上海新苗医疗器械制造有限公司;Pac325 CO2/O2浓度分析仪 美国Mocon(膜康)公司;硅胶密封垫 美国Mocon(膜康)公司;5mL一次性注射器 天津市双盛化工厂;JJ2000电子称 常熟双杰测试仪器厂;900mL塑料密封罐 珠海某大型超市。
1.2 实验方法
1.2.1 实验分组 将采收后的水果分4组,用清水清洗,其中3组水果随机分别放到5、15、25℃的生化培养箱(湿度:90%)内进行预冷处理(24h),第4组作为模型的验证实验。
1.2.2 实验设计 对影响杨桃呼吸速率的温度因素设置了3个水平(5、15、25℃),对初始气体浓度中O2浓 度 设 立 了3 个 水 平(5% 、13%和 21%v/v O2),CO2浓度设立了4个水平(0%、5%、13%和20%v/v CO2),以N2作为填充气体。该实验设计的温度和气体浓度基本上覆盖了采后杨桃果实气调包装和贮藏过程中所遇到的环境温度和气体比例。表1为每个温度下具体的初始气体浓度的设置。本实验一共48个处理,每个处理设3个重复。

表1 实验设计因素及水平表table 1 Factors and levels of experiment design
1.2.3 呼吸速率测定方法 采用密闭系统法测定测定杨桃果实的呼吸速率。将杨桃果实放入900mL的塑料密封罐内,然后利用气调包装机向包装内充入目标气体,密封后存放到各自生化培养箱中储藏,生化培养箱的温度事先设置好,分别为5、15、25℃。贮藏4h时,用CO2/O2顶空分析仪测定包装内O2和CO2的体积分数,并根据1.2.4所列的公式来计算呼吸初值。如果杨桃的呼吸商>1.3,即发生无氧呼吸[5]。
1.2.4 呼吸速率的计算 呼吸速率(RO2和RCO2)的计算方法按照式(1)和式(2)所示[6]。

式 中 :RO2、RCO2表 示 的 呼 吸 速 率(mL/(kg·h));在时间间隔为△t时,容器内O2、CO2的体积分数之差(%);△t表示两侧测量的时间间隔(h);Vf表示容器内自由体积(mL);M表示测量水果重量(kg)。
1.2.5 模型的选择 呼吸速率涉及了复杂的生理生化反应,这些反应都是在酶的催化作用下发生的,和微生物的呼吸代谢相类似,因此,Fishman等[7]在米氏方程的基础上,考虑了CO2对O2吸收速率的影响,将CO2看做是O2的非竞争性抑制剂,建立了无竞争型Michaelis-Menten模型(M-M U模型):
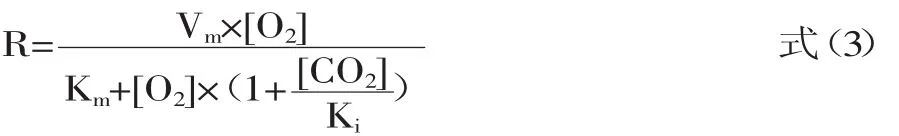
式中:R表示呼吸速率(mL/(kg·h));[O2]、[CO2]分别表示容器内O2和CO2的体积分数(%);Vm、Km和Ki为M-M U模型参数:Vm表示果蔬最大的呼吸速率(mL/(kg·h));Km表示米氏常数 (%O2,v/v);Ki表示CO2无竞争抑制系数(%CO2,v/v)。
此外,果蔬的呼吸速率随温度的变化规律遵循Arrhenius定理[8],该定理可以应用到模型的拟合中。

式中:Rref表示指前因子(mL/(kg·h));Ea表示表观 活 化 能(kJ/mol);Rgas表 示 理 想 气 体 常 数(8.314J/(mol·K));T表示绝对温度(K)。
1.2.6 模型的验证 为了验证所建立的初始呼吸速率模型在5~25℃内其他温度的预测性能,本文进行了验证实验,所用的温度为12℃。
1.2.7 数据统计 采用SPSS 13.0进行方差分析,差异显著性分析采用最小显著差数法(LSD法),利用1stOpt 1.5对实验数据进行非线性回归得出数学模型的参数。
2 结果与讨论
2.1 不同温度对杨桃呼吸初值的影响
不同温度和不同初始气体浓度下,杨桃初始RO2和RCO2的范围分别为1.25~26.10mL/(kg·h)和1.41~26.51mL/(kg·h)(图1、图2)。温度对杨桃的呼吸初值的影响显著(p<0.05),所有处理中,RO2和RCO2都随着温度的升高而增大,温度对呼吸初值的影响在高温(25℃)下更显著(p<0.01)。所有气调比例中,贮藏温度从5℃升高到25℃,初始RO2和RCO2增加了3~7倍。Nei[9],Torrieri[10]和Iqbal等[11]都发现 ,温度越 高 ,切 分的 甘 蓝丝、“Annurca”苹果和胡萝卜丝的呼吸速率越大。改变温度可以抑制杨桃一些相关酶的活性,从而限制果实的新陈代谢,因此可以通过冷藏显著降低果蔬的呼吸速率。

图1 温度和O2初始气体比例对呼吸初值RO2的影响Fig.1 Influence of temperature and initial O2concentration on initial O2depletion rates(RO2)
杨桃呼吸初值随温度的变化规律遵循Arrhenius定理,不同初始气体浓度下的拟合的Rref和Ea值见表2,拟合效果很好(0.912<r<0.999)。初始RO2和RCO2的Rref范围为4.95×106~3.37×109。对于一般的采后产品来说,Ea值的范围一般为29.0~92.9kJ/mol[12],本研究中初始 RO2和RCO2的 Ea值 范 围 为 31.31 ~49.81kJ/mol,初 始RO2和RCO2的Ea均值分别为39.46kJ/mol和36.49kJ/mol。不 同 的 初 始 气 体 浓 度 下 ,初 始 RO2和 RCO2的Rref和Ea值在统计学上无显著差异(p>0.05)。
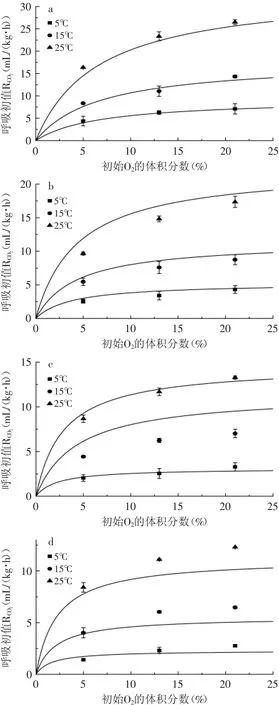
图2 温度和O2初始气体比例对呼吸初值RCO2的影响Fig.2 Influence of temperature and initial O2concentration on initial O2depletion rates(RCO2)
2.2 不同初始气体浓度对杨桃呼吸初值的影响
初始O2和CO2浓度对杨桃呼吸初值有显著的影响(p<0.05)。由图1、图2可知,初始气体中O2比例高,杨桃的呼吸初值随之增大;增加初始气体中CO2的比例,呼吸初值则下降。

表2 不同初始气体浓度的Arrhenius公式的参数估值Table 2 Pre-exponential factor(Rref)and apparent activation energy(Ea) of Arrhenius type equation for different initial gas concentration
图1可知,从不同的初始O2浓度来看,初始的O2浓度从21%下降到5%,可以显著的降低贮藏在5~25℃的杨桃的呼吸初值(p<0.05)。然而,初始的O2浓度从21%下降到13%,贮藏在5~25℃的杨桃的呼吸初值下低的效果不显著(p>0.05)。此外,初始的O2浓度从13%下降到5%,可显著降低贮藏在15和25℃条件下杨桃的呼吸初值(p<0.05),而对贮藏在5℃下的杨桃的呼吸初值的影响不显著(p>0.05)。
由以上分析可以得出,O2浓度从21%向13%、5%递减的时候,杨桃的初始呼吸作用受到的抑制并不是直线型的变化,在O2浓度下降到一定界限前,呼吸初值变化不大;一旦低于这一界限,呼吸初值显著下降(p<0.05);如果O2继续递减,则对呼吸作用的抑制效果不显著(p>0.05)。由此可知,在较高的贮藏温度下,降低初始O2的浓度,可以显著降低杨桃的呼吸初值。
由图2可知,初始CO2浓度对杨桃呼吸初值的影响和初始O2浓度对其的影响类似。从不同的初始CO2浓度来看,初始的CO2浓度从0%升高到5%,0%升高到13%和0%升高到20%,可以显著的降低贮藏在5~25℃的杨桃的呼吸初值(p<0.05)。但是,初始的CO2浓度从13%升高到20%,贮藏在5~25℃的杨桃的呼吸初值下降的效果不显著(p>0.05),由此可得,为了不必要的浪费,无需把初始CO2浓度提高到13%以上。此外,初始的CO2浓度从5%上升到13%,可显著降低贮藏在15和25℃条件下杨桃的呼吸初值(p<0.05),而对贮藏在5℃下的杨桃的呼吸初值的影响不显著(p>0.05)。
由以上分析可以得出,初始CO2浓度从21%向13%、5%递减的时候,杨桃的呼吸作用受到的抑制并不是直线型的变化,在CO2浓度下降到一定界限前,呼吸初值变化不大;一旦低于这一界限,呼吸初值显著下降(p<0.05);如果CO2继续递减,则对呼吸作用的抑制效果不明显(p<0.05)。由此可知,在较高的贮藏温度下,升高初始CO2的浓度,可以显著降低杨桃的呼吸初值。

表3 影响RO2因素的方差分析结果Table 3 Tests of between-subjects effect on RO2

表4 影响RCO2因素的方差分析结果Table 4 Tests of between-subjects effect on RCO2
2.3 呼吸初值影响因子的敏感性
因素水平的波动对实验结果的影响可以通过均方的大小来判断。由表3、表4可知,MS温度>MSCO2>MSO2,因此呼吸初值影响的因素的主次顺序为温度>CO2>O2。温度对杨桃呼吸初值的影响比初始气体浓度的影响要大,同样的现象也发生在他人研究上。例如番石榴,温度对其呼吸速率模型的影响达到51.41%[13]。 另 外 ,Fonseca等[14]也 曾 发 现 温 度 是 对Galega kale 的 呼 吸 速 率 影 响 最 大 的 因 素 :把 贮 藏温度从20℃降低到1℃,RCO2和RO2分别降低了90%和88%。
2.4 不同温度和不同初始气体浓度下杨桃呼吸初值的模型的建立
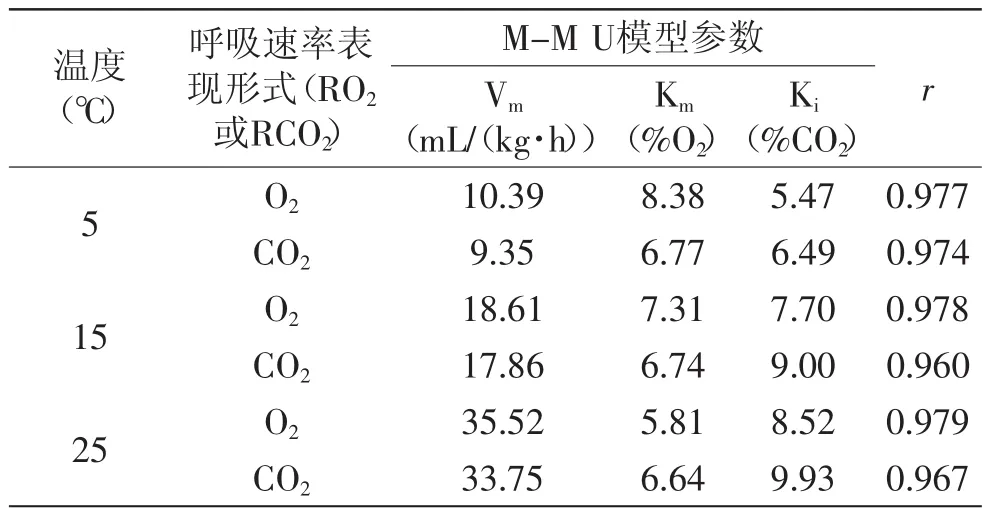
表5 不同温度下杨桃M-M U模型的参数估值Table 5 Model parameters for M-M U model at different storage temperatures for initial respiration rate of O2and CO2
利用杨桃呼吸的实验观测值对无竞争型M-M方程进行了回归分析,得到不同温度下M-M U模型的参数估计值(表5)及相应的Pearson相关系数值,r>0.960,可以看出,M-M U模型有很好的拟合效果。
Vm代表着果蔬的最大呼吸速率[15]。在本文中,不同温度下,RO2和RCO2的Vm分别是10.39~35.52mL/(kg·h)和9.35~33.75mL/(kg·h)。Vm随着温度的升高而升高,温度对果蔬的生理和生化反应有着很强的影响力,从而影响到果蔬的呼吸速率。
不 同 温 度 下 ,RO2和 RCO2的 Km值 分 别 是 5.81% ~8.38%和6.64%~6.77%。Km代表了果蔬对O2浓度的敏感性。Km值偏小,意味着降低O2的浓度更能减少果蔬的呼吸速率[16]。Km随温度变化的趋势和段华伟等的研究一致[17],Km随着温度的升高而降低,表明了随着温度的升高,杨桃果实对扩散有着较低的阻力[18],较低的O2浓度可以降低呼吸初值,尤其是在较高的贮藏温度下更显著。
不同温度下,RO2和 RCO2的 Ki值 分 别 是 5.47% ~8.52%和6.49%~9.93%。Ki是抑制常数,Ki值高,表明了对CO2有着更高的耐性[16]。小的Ki值意味着对呼吸速率的抑制作用低,可以忽略[19]。由表5可知,CO2的抑制作用随着温度的升高而升高,由此可得出,在较高的贮藏温度下,CO2对杨桃果实呼吸初值的抑制作用较大。
M-MU参数Vm,Km和Ki都对温度敏感,随着温度的升高,Vm和Ki值升高,Km值下降。Mangaraj等[20]建立的 山 榄 果的 呼吸 模 型 参 数 和Gomes等[21]建 立 的 鲜 切“Rocha”梨的呼吸模型参数随温度的变化趋势与本文有相似之处。由于M-M U模型参数对温度有很强的 依 赖 性 ,Ravindra 和 Goswami等[22]建 议 用 Arrhenius公式来表示模型参数,因此将三者的值分别与Arrhenius公式拟合,得出Arrhenius公式的估计参数值(表6),拟合效果好(0.954<r<0.987)。

表6 Arrhenius公式的参数估值Table 6 Pre-exponential foctor(Rref)and apparent activation energy(Ea) for Arrhenius-type equation for different model parameters of M-M U model
Vm值为正,而Km和Ki则不一定为正[23]。本研究中,Km(O2)和 Km(CO2)的 Ea分 别 为 -12.16、-0.66kJ/mol,为负值可能是因为随着温度的升高,扩散的阻力下降。
无论是M-M U模型的参数估值还是Arrhenius公式的参数估值,其相关系数均高于0.95,表明M-M U模型结合Arrhenius公式的呼吸速率综合模型能够很好的模拟杨桃的呼吸初值。从上面可以得到不同温度、不同初始气体比例下,杨桃呼吸初值的综合模型为:
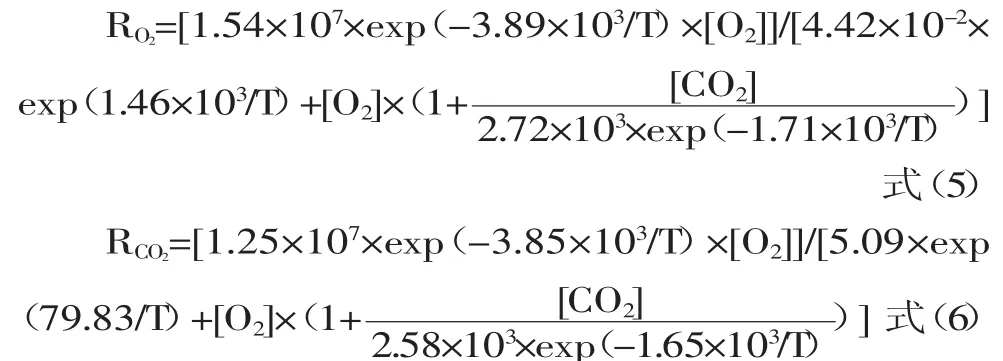

图3 杨桃在12℃、不同初始气体比例下RO2和RCO2实验值和预测值的相关性Fig.3 Relationship between experimental and predict initial respiration rate values of carambola
杨桃在12℃下的呼吸初值可通过式(1)、(2)得出实验观测值,而杨桃呼吸初值的预测值通过模型(5)、(6)计算得到,图3为12℃下杨桃RO2和RCO2的实验观测值与模型预测值,通过统计学分析,RO2和RCO2的实验观测值与模型预测值的Pearson相关系数分别为0.977和0.963(α=0.01)。因此,该模型能很好的预测不同温度、不同初始气体比例条件下杨桃的呼吸初值。
3 结论
3.1 采用密闭系统法测量杨桃的呼吸速率,影响杨桃的呼吸初值的因素有贮藏温度和初始气体组分的浓度,其中,这3个因素对杨桃呼吸初值影响的敏感程度为温度>CO2>O2,贮藏温度对杨桃呼吸初值的影响最大。
3.2 降低O2初始浓度或增加CO2初始浓度都会抑制杨桃的呼吸初值,在高温条件下降低O2初始浓度或增加CO2初始浓度,其影响更加明显。
3.3 利用无竞争型Michaelis-Menten模型和Arrhenius公式对杨桃建立了包含温度、不同O2初始浓度和CO2初始浓度的呼吸初值预测模型,经验证,该模型可靠。
[1] 段华 伟. 鲜果 气调包装的 理论与 实 验 研究[D]. 无 锡 :江 南大学,2010.
[2]Mahajan PV,Oliveira FAR,Montanez JC,et al.Development of user-friendly software for design of modified atmosphere packaging for fresh and fresh-cut produce[J].Innovative Food Science&Emerging Technologies,2007,8(1):84-92.
[3]Caleb OJ,Mahajan PV,Opara UL,et al.Modelling the respiration rates of pomegranate fruit and arils[J].Postharvest Biology and Technology,2012,64(1):49-54.
[4]Amirulah R,Mokji M,Ibrahim Z.Starfruit Color Maturity Classification Using Cr as Feature;proceedings of the Signal-Image Technology and Internet-Based Systems(SITIS),2010 Sixth International Conference on,F,2010[C].IEEE.
[5]Petracek PD,Joles DW,Shirazi A,et al.Modified atmosphere packaging of sweet cherry(Prunus avium L.,ev.‘Sams’) fruit:metabolic responses to oxygen,carbon dioxide,and temperature [J].Postharvest Biology and Technology,2002,24(3):259-270.
[6]CAMERON AC , BOYLAN-PETT W , Lee J.Design of modified atmosphere packaging systems:modeling oxygen concentrations within sealed packages of tomato fruits[J].Journal of Food Science,1989,54(6):1413-1416.
[7]Fishman S,Rodov V,Peretz J,et al.Model for Gas Exchange Dynamics in Modified-Atmosphere Packages of Fruits and Vegetables[J].Journal of Food Science,1995,60(5):1078-1083.
[8]Torrieri E,Perone N,Cavella S,et al.Modelling the respiration rate of minimally processed broccoli(Brassica rapa var.sylvestris)for modified atmosphere package design[J].International Journal of Food Science&Technology,2010,45(10):2186-2193.
[9]Nei D,Uchino T,Sakai N,et al.Prediction of sugar consumption in shredded cabbage using a respiratory model[J].Postharvest Biology and Technology,2006,41(1):56-61.
[10]Torrieri E,Cavella S,Masi P.Modelling the respiration rate of fresh-cut Annurca apples to develop modified atmosphere packaging[J].International Journal of Food Science&Technology,2009,44(5):890-899.
[11]Iqbal T,Rodrigues FA,Mahajan PV,et al.Mathematical modeling of the influence of temperature and gas composition on the respiration rate of shredded carrots[J].Journal of Food Engineering,2009,91(2):325-332.
[12]Exama A,Arul J,Lencki R,et al.Suitability of plastic films for modified atmosphere packaging of fruits and vegetables[J]. Journal of Food Science,1993,58(6):1365-1370.
[13]Wang Z-W,Duan H-W,Hu C-Y.Modelling the respiration rate of guava(Psidium guajava L.) fruit using enzyme kinetics,chemical kinetics and artificial neural network[J].European Food Research and Technology,2009,229(3):495-503.
[14]Fonseca SC,Oliveira FA,Frias JM,et al.Modelling respiration rate of shredded Galega kale for development of modified atmosphere packaging[J].Journal of Food Engineering,2002,54(4):299-307.
[15]Song Y,Kim HK,Yam KL.Respiration rate of blueberry in modified atmosphere at various temperatures[J].Journal of the American Society for Horticultural Science,1992,117 (6):925-929.
[16]Pandey SK,Goswami TK.Modeling of Respiration Rate of Capsicum at Various Temperatures[J].International Journal of Food Engineering,2011,7(5):1-18.
[17]Duan HW,Wang ZW,Hu CY.Development of a simple model based on chemical kinetics parameters for predicting respiration rate of carambola fruit[J].International Journal of Food Science&Technology,2009,44(11):2153-2160.
[18]Cliffe-Byrnes V,O’Beirne D.Effect of gas atmosphere and temperature on the respiration ratesofwhole and sliced mushrooms(Agaricus bisporus)—Implications for film permeability in modified atmosphere packages[J].Journal of Food Science,2007,72(4):197-204.
[19]Ratti C,Raghavan G,Gariepy Y.Respiration rate model and modified atmosphere packaging of fresh cauliflower[J].Journal of Food Engineering,1996,28(3):297-306.
[20]Mangaraj S,Goswami T.Modeling of respiration rate of litchi fruit under aerobic conditions[J].Food and Bioprocess Technology,2011,4(2):272-281.
[21]Helena Gomes M, Beaudry RM, Almeida DP, et al. Modelling respiration of packaged fresh-cut‘ Rocha’pear as affected by oxygen concentration and temperature[J].Journal of Food Engineering,2010,96(1):74-79.
[22]Ravindra MR,Goswami T.Modelling the respiration rate of green mature mango under aerobic conditions[J].Biosystems Engineering,2008,99(2):239-248.
[23]Granado-Lorencio F,Olmedilla-Alonso B,Herrero-Barbudo C,et al.Modified-atmosphere packaging(MAP) does not affect the bioavailability of tocopherols and carotenoids from broccoli in humans:A cross-over study[J].Food Chemistry,2008,106(3):1070-1076.
The influence of temperature and different initial gas concentrations on the initial respiration rate of carambola
MAI Xin-yun1,HU Chang-ying1,2,*,WANG Zhi-wei2
(1.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China;2.Key Laboratory of Product Packaging and Logistics of Guangdong Higher Education Institutes,Zhuhai 519070,China)
Initial respiration rate of carambola was measured at storage temperatures of 5℃ ,15℃ and 25℃under different gas composition of O2(5% ,13% ,21% ) and CO2(0% ,5% ,13% ,20% ) in this work.The results showed as below.Carambola initial respiration rate significantly increased with temperature (p<0.05),and this influence followed an Arrhenius-type relationship.Initial O2and CO2concentration significantly influenced initial respiration rate (p <0.05 ).Initial respiration rate was increased when initial O2concentration was increased ,while initial respiration rate was decreased when initial CO2concentration was increased.Initial respiration rate significantly decreased when the initial O2concentration was reduced or initial CO2concentration was increased at the higher temperatures (15 to 25℃ ) (p<0.05).The influence of initial gas composition on initial respiration rate was described by Michaelis-Menten uncompetitive model and the constants of this model followed an Arrhenius-type equation,and the modeling which contained initial respiration rate,temperature and initial gas concentration was established by analysis of regression.The model was confirmed with the experimental data at 12℃ ,and the Pearson correlation exceeded 0.963 that showed the fair agreement between experimental data and predicted data using this model.
initial respiration rate;gas concentration;temperature;respiration model;carambola
TS255.3
A
1002-0306(2014)22-0317-06
10.13386/j.issn1002-0306.2014.22.061
2013-08-28
麦馨允(1987-),女,硕士研究生,研究方向:果蔬贮藏。
* 通讯作者:胡长鹰(1968-),女,博士,教授,研究方向:食品安全。
广东省自然科学基金项目(10151063201000021);珠海市科技攻关项目(PC20061044)。

