抗CMV和ToMV RNAi载体的构建及加工番茄遗传转化
乔亚红,田桂英,郑银英,崔百明,李诗林,向本春
(石河子大学 农学院 农业生物技术重点实验室,新疆 石河子 832003)
病毒病是加工番茄生产中的主要病害之一。近年来,随着加工番茄的大面积种植和连续种植,连作和重茬增多,病毒病害也日趋严重。黄瓜花叶病毒(Cucumbermosaicvirus,CMV)和番茄花叶病毒(Tomatomosaicvirus,ToMV)是严重危害加工番茄的2种主要病毒[1-2]。其中,CMV属于雀麦花叶病毒科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus),是目前世界范围内危害蔬菜最严重的病毒之一。ToMV是与烟草花叶病毒(Tobaccomosaicvirus,TMV)关系最近的一种病毒,属于烟草花叶病毒属,其寄主范围广,能侵染茄科、禾本科、十字花科、豆科等许多植物。在实际生产中,这2种病毒往往是复合侵染加工番茄,使加工番茄枝条上出现严重的条斑坏死症状,果实表面则生成褐色斑块,僵小畸形,严重影响了加工番茄的产量和品质,给农业生产造成了较大的经济损失[3-6]。
RNAi 是生物体本身的一种RNA防御机制,普遍存在于植物、动物和真菌等大多数真核生物中[7-9]。植物体天然的 RNAi 系统不能完全抵御某种病毒的入侵,如果人为地将该病毒的某一段序列设计成含反向重复的结构双链,转入植物体内,使其在植物体内表达从而诱发RNAi 产生 dsRNA,可有效地强化植物体自身的 RNAi 抗病毒机制,获得较高抗性的转基因植物,达到延迟和减轻病毒病害的目的。目前,该技术已广泛应用于植物抗病毒方面的研究,并取得了很好的效果[10-12]。Waterhouse等[13]针对马铃薯 Y 病毒(PVY)蛋白酶基因片段构建 IRS 载体,用其转化烟草获得了抗性植株。Wang等[14]用大麦黄矮病毒(BYDV-PAV)多聚酶基因的反向重复序列载体转化大麦,获得了对BYDV免疫级抗性的转基因大麦植株。朱俊华等[15]将 PVYCP部分序列的反向重复序列载体转化烟草, 获得了对PVY免疫的转基因植株。颜培强等[16]利用 TMVCP和 CMVCP部分序列的融合基因片段构建载体转化烟草,获得了抗TMV、CMV的转基因烟草植株。但实际生产中,往往是多种病毒复合侵染同一寄主植物,利用RNAi技术,可以将多个病毒部分基因序列进行融合,构建抗多种病毒的载体,转化植株后即可获得具有抗多种病毒能力的植株。
本研究利用 RNAi 技术,分别选取新疆加工番茄 CMV 分离物 NS0-4 和 ToMV 分离物SCS-2,以二者的复制酶部分序列作为干扰片段,通过 T 克隆载体拼接,构建含反向重复结构拼接片段的 RNAi 表达载体 pBi35STC12, 以期获得抗这 2 种病毒的转基因加工番茄,为加工番茄病毒病的防治奠定基础。
1 材料与方法
1.1 材 料
1.1.1 毒源、植物、菌株及载体 供试毒源为黄瓜花叶病毒(CMV)分离物 NS0-4 和番茄花叶病毒(ToMV)分离物 SCS-2,均为石河子大学农业生物技术重点实验室保存。供试植物为加工番茄红番3号种子,为市售。菌株为大肠杆菌(Escherichiacoli)DH5α、农杆菌(Agrobacteriumtumefaciens)GV3101,均为石河子大学农业生物技术重点实验室保存。载体为中间载体 piRDG12 和表达载体 pBi35SDG12,均为石河子大学农业生物技术重点实验室保存。
1.1.2 主要试剂 逆转录酶试剂盒(AMV)、pGEM-T easy、T4DNA连接酶、Plant Genomic DNA Kit 植物基因组 DNA 提取试剂盒、Wizard DNA clean-up kit 凝胶回收试剂盒,均购自 Promega公司;TaqDNA 聚合酶和RNA prep pure plant kit,均购自TIANGEN 公司;限制性内切酶购自 Fermentas 公司;引物由北京六合华大基因科技股份有限公司合成。
1.1.3 培养基 1/2MS 液体培养基:1/2MS 大量元素+MS 微量元素+MS 铁盐+MS 有机物质+15 g/L 蔗糖,pH 5.8;分化培养基:MS+6-BA 2 mg/L+IAA 0.1 mg/L+植物凝胶 2 g/L,pH 5.8;共培养基:MS+6-BA 2 mg/L+IAA 0.1 mg/L+AS(乙酰丁香酮)100 μmol/L+植物凝胶 2 g/L,pH 5.8;筛选培养基:MS+ZT 0.5 mg/L+IAA 0.1 mg/L+Carb(羧苄青霉素) 300 mg/L+Kan(卡那霉素) 50 mg/L+植物凝胶2 g/L,pH 5.8;生根培养基:1/2 MS+IAA 0.1 mg/L+Carb 300 mg/L+Kan 50 mg/L+植物凝胶2 g/L,pH 5.8。
1.2 RNAi 载体的构建
1.2.1 毒源活化和总RNA提取 通过机械摩擦的方法,用NS0-4接种西方烟(Nicotianaoccidentalis),SCS-2接种心叶烟(Nicotianaglutinosa)。 NS0-4 在接种约 20 d 后出现症状,提取西方烟总 RNA1;SCS-2在接种第 3天出现症状后,提取心叶烟总 RNA2。具体操作方法依照 RNA prep pure plant kit说明书进行。
1.2.2 干扰片段的选择 根据 NS0-4 和 SCS-2 基因全序列,利用 Vector NTI 软件进行分析,选取NS0-4 1a复制酶第 1 051-1 350 bp 序列(300 bp)和 SCS-2 130/180 ku复制酶第 1 920-2 200 bp 序列(281 bp)的cDNA 作为干扰片段。
1.2.3 引物设计 根据干扰片段和pBi35SDG12载体Intron序列两端的限制性内切酶位点,设计2对引物,CR12SP:5′-CGGGATCCTGCCCACCCGAACTCATTCGA-3′(BamHⅠ),CR12ASP:5′-GGGGTACCGCAATATAATGATAATCGTT-AATATCGATGCGTT-3′(KpnⅠ);To12SP:5′-CGAGCTCGGATCCTGTTGCGCTAGCATTGC-AAGATTCT-3′(SacⅠ+BamHⅠ),To12ASP:5′-GAAGATCTTAAAGTTTTTCATTTGTTGAA-CTTTAAGAGGGC-3′(BglⅡ),下划线部分为酶切位点,酶切位点之前的碱基为保护碱基。
1.2.4 干扰片段的RT-PCR扩增 将总RNA1(NS0-4)和总RNA2(SCS-2)根据逆转录酶试剂盒(AMV)说明书分别合成cDNA1 和cDNA2 。以cDNA1为模板,用引物CR12SP和CR12ASP进行PCR扩增,得到1a复制酶第1 051-1 350 bp 316 bp大小的片段CR12;以cDNA2为模板,用引物To12SP和To12ASP进行PCR扩增,得到130/180 ku复制酶第1 920-2 200 bp约302 bp大小的片段To12。PCR产物经10 g/L琼脂糖电泳检测后,将CR12和To12分别克隆到pGEM-T easy载体,转化大肠杆菌E.coilDH5α,酶切鉴定正确后,重组质粒送北京六合华大基因科技股份有限公司进行测序。将构建的载体命名为pGEM-T-CR12和pGEM-T-To12。
1.2.5 干扰片段的拼接 将 pGEM-T-CR12 用BamHⅠ/PstⅠ酶切回收含 CR12 的小片段,pGEM-T-To12 用BglⅡ/PstⅠ酶切回收含 To12 的大片段,然后将回收的大小片段通过同位酶(BamHⅠ/BglⅡ)连接得到pGEM-T-TC12。转化大肠杆菌E.coilDH5α,酶切鉴定正确后,重组质粒送北京六合华大基因科技股份有限公司进行测序。干扰片段的拼接流程见图1。
1.2.6 中间载体的构建 用BamHⅠ/KpnⅠ双酶切 pGEM-T-TC12 质粒及piRDG12 载体质粒,回收含 CR12-To12 的正向片段和 piRDG12 载体的相应片段,将它们连接并转化大肠杆菌E.coilDH5α,酶切鉴定正确后,将构建的载体命名为 piRTC12_R。用SpeⅠ/SacⅠ双酶切 pGEM-T-TC12 质粒及 piRTC12_R 质粒,回收含CR12-To12 的反向片段和 piRTC12_R 的相应片段,将它们连接并转化大肠杆菌E.coilDH5α,酶切鉴定正确后,将构建的载体命名为 piRTC12。
1.2.7 RNAi载体的构建 用XbaⅠ/EcoRⅠ双酶切中间载体 piRTC12 及植物表达载体pBi35SDG12,回收目的片段,连接转化到大肠杆菌E.coilDH5α 中,酶切鉴定正确后,将构建正确的 RNAi 载体命名为 pBi35STC12。RNAi 载体的构建见图2。
1.3 加工番茄的遗传转化
将含有 pBi35STC12 质粒 DNA 的农杆菌 GV3101,在200 r/min、28 ℃ 振荡培养 1 d,然后将该菌液以 1∶10 比例扩大,在200 r/min、28 ℃ 振荡培养 6 h后于4 ℃ 、5 000 r/min离心15 min,回收菌体,用 1/2MS 液体培养基稀释到OD600为 0.6~0.8。切取发芽8~10 d的加工番茄幼苗子叶,置于分化培养基上,于 24 ℃ 黑暗条件下预培养3 d后,将子叶置于含菌体的1/2MS 液体培养基中侵染 20 min,捞出后用无菌滤纸吸去多余的农杆菌液,置于共培养基中共培养 2 d 后移至含 300 mg/L Carb(羧苄青霉素)和 50 mg/L Kan(卡那霉素)的筛选培养基上,进行抑菌﹑筛选培养,之后约 2 周左右换 1 次培养基进行继代培养 1 次,直至叶缘产生再生芽;当不定芽长到1.5~2 cm 时,从基部切下,插入生根培养基中诱导生根。待植株长到 6~8 cm 时进行驯化培养,1 周后移栽到盆中。

图1 CMV和ToMV RNA干扰片段的拼接
1.4 转基因加工番茄植株的 PCR 检测
取转基因加工番茄植株叶片,用方宣钧等[17]的方法提取基因组 DNA 进行 PCR 分析。根据拼接的干扰片段序列,采用Primer 软件,设计检测干扰片段正向序列的特异性引物,TC12SP:5′-CGGATCCTGTTGCGCTAGCATTGCAAGATTCT-3′ (BamHⅠ)和 TC12ASP: 5′-GCAATATAATGATAATCGTTAATATCGATGCGTT-3′(下划线部分为酶切位点,酶切位点之前的碱基为保护碱基),产物大小为 608 bp。PCR 产物用10 g/L琼脂糖电泳检测。
根据pBi35STC12载体的Intron序列和NOS终止子序列,设计检测干扰片段反向序列的特异性引物,SP/In-Nos:ACCCTAAATTTATCAAGACAAGGTT和ASP/In-Nos:AAGACCGGCAACAGGATTC,产物大小为762 bp。PCR产物用10 g/L琼脂糖电泳检测。
2 结果与分析
2.1 CMV和ToMV RNA干扰片段的 RT-PCR 扩增
以 cDNA1 为模板、CR12SP 和 CR12ASP 为引物进行 PCR 扩增,得到1条与预期大小一致的约316 bp 的片段 CR12;以 cDNA2 为模板、To12SP 和 To12ASP 为引物进行 PCR 扩增,得到1条与预期大小一致的约302 bp 的片段 To12 (图3)。将 CR12 和 To12 分别与 pGEM-T easy 连接,得到 pGEM-T-CR12 和 pGEM-T-To12,提取质粒,经酶切鉴定,所得序列正确。
2.2 RNAi 载体 pBi35STC12 的构建及鉴定
2.2.1 干扰片段的拼接 将质粒 pGEM-T-CR12 用BamHⅠ/PstⅠ酶切回收,得到含 CR12 的长约340 bp 的小片段;将 pGEM-T-To12 质粒用BglⅡ/PstⅠ酶切回收,得到含 To12 的长约 3 280 bp 的大片段(图4)。通过同位酶(BamHⅠ/BglⅡ)将回收的片段连接,得到pGEM-T-TC12,提取质粒,经酶切鉴定,所得序列正确(图5)。
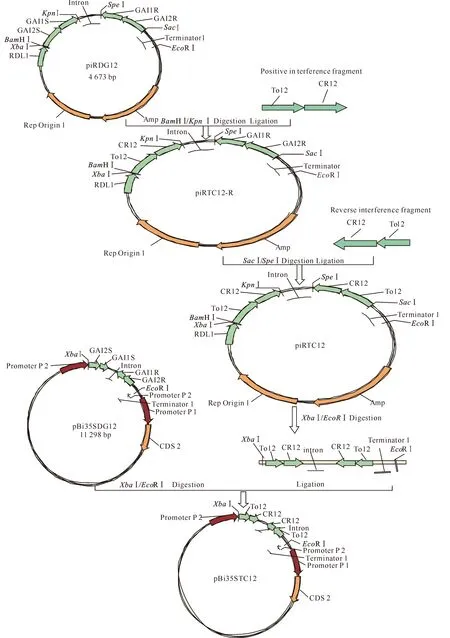
图2 CMV 和ToMV RNAi 载体的构建

图3 CMV和ToMV RNA干扰片段的RT-PCR扩增
2.2.2 中间载体 piRTC12 的构建及鉴定 重组质粒 pGEM-T-TC12 用BamHⅠ/KpnⅠ双酶切鉴定正确,回收含 CR12-To12 的长 597 bp 的正向片段; 用SpeⅠ/SacⅠ双酶切重组质粒pGEM-T-TC12 后,回收到含 CR12-To12 的长 597 bp 的反向片段(图5)。将回收的正向和反向片段连接到载体 piRDG12 的相应酶切位点,获得中间载体 piRTC12。经XbaⅠ/EcoR Ⅰ 双酶切鉴定正确(图6)。
2.2.3 pBi35STC12的构建及鉴定 将鉴定正确的中间载体 piRTC12,用XbaⅠ/EcoRⅠ双酶切,回收到长 1 752 bp 的目的片段(图6),连接到表达载体 pBi35SDG12 的相应位点,得到植物表达载体 pBi35STC12,对其进行XbaⅠ/EcoRⅠ双酶切,获得长1 752 bp 和 9 571 bp 的片段(图7)。

图4 pGEM-T-CR12和pGEM-T-To12干扰片段的融合酶切

图6 中间载体 piRTC12的酶切鉴定
2.3 转基因加工番茄植株的获得
以红番 3 号加工番茄为转化受体,利用农杆菌转化法对 1 500 个外植体进行侵染、转化,然后转入筛选培养基上培养,直至长出愈伤组织、分化出绿芽,待小芽长到 1.5~2 cm 后转入生根培养基。待植株长到 6~8 cm 时进行炼苗,然后再移入盆中,共移栽 33 株,成活了 33 株(图8)。

图8 转基因加工番茄植株的获得
2.4 转基因加工番茄植株的PCR检测
提取转基因加工番茄植株叶片总DNA,分别以 TC12SP、TC12ASP 和 SP/In-Nos、ASP/In-Nos 为引物,通过 PCR 检测干扰片段是否成功导入。PCR 检测结果显示,33 株加工番茄转基因再生植株中有19 株均含正向(图9)和反向干扰片段(图10),表明干扰片段已经成功整合到加工番茄的基因组中,转化率为 1.26%。

图9 部分转基因加工番茄植株正向干扰片段的PCR鉴定

图10 部分转基因加工番茄植株反向干扰片段的PCR鉴定
3 结论与讨论
近年来,随着 RNAi 技术的快速发展及其工作机理的不断阐明,其在植物基因工程研究方面得到了广泛的应用。但在研究中发现,RNAi 植物表达载体的结构、靶基因序列长度及其在靶基因中的位置,都对 RNAi 的效率和效果产生影响[18]。Wesley等[19]对几种不同的 RNAi 载体构建获得的抑制基因表达转基因植株进行了评价,结果显示,含有2个反向重复序列且中间夹1个内含子所形成的发夹 hpRNA 结构,能显著提高 RNA 沉默效果,且沉默效率平均高达 90% 以上。本研究在2个反向重复序列中间有一段大小约266 bp的 Intron 片段,这种结构保证了干扰片段可以按照完全相反的方向插入到目的载体,并在转化后形成发夹 RNA 结构(hpRNA)。在 RNAi 载体设计中,有关干扰序列长度以及靶标基因片段选择的位置尚存在争议,还有待于进一步深入研究。
目前,农杆菌介导的转化方法已被广泛地应用于烟草﹑棉花﹑番茄等作物上,其转化效果受外植体大小、外植体取材部位及培养基中凝胶种类和培养皿封口膜材料等的影响[20],且转化效率不高,仅为 1.4%~34%[21-23]。本研究中加工番茄遗传转化率仅为 1.26% ,比已报道的转化率低,这可能与试验中所选取材料的苗龄、外植体的种类和大小、接种方式、不同作物和品种及其基因型有关[24-25]。
本研究成功将含 CMV 和 ToMV 分离物复制酶部分基因的 RNAi 载体 pBi35STC12 转入到加工番茄红番 3 号,经过 PCR 检测获得了19 株转基因加工番茄植株,通过对 CMV 和 ToMV复制酶表达的干扰,影响这 2 种病毒的复制,从而达到抗这2种病毒的效果。至于其干扰效果还有待于进一步的检测验证。
[参考文献]
[1] 冯兰香,蔡少华,郑贵彬,等.我国番茄病毒病的主要毒源种类和番茄上烟草花叶病毒株系的鉴定 [J].中国农业科学,1987,20(3):60-66.
Feng L X,Cai S H,Zheng G B,et al.Identification of main causal viruses of tomato virus diseases and the TMV strains of tomato in China [J].Scientia Agricultura Sinica,1987,20(3):60-66.(in Chinese)
[2] 冯兰香,田如燕,杨翠荣,等.中国北方番茄主要病毒种类普查及TMV、CMV株系鉴定 [J].植物保护学报,1996,23(1):52-55.
Feng L X,Tian R Y,Yang C R,et al.A study and identification on tomato virus and TMV,CMV strains in Northern China [J].Journal of Plant Protection,1996,23(1):52-55.(in Chinese)
[3] 姜玉霞,向本春,安仙丽,等.新疆加工番茄上番茄花叶病毒的分子鉴定 [J].新疆农业科学,2008,45(3):484-489.
Jiang Y X,Xiang B C,An X L,et al.Identification on molecular of tomato mosaic virus of processing tomato in Xinjiang [J].Xinjiang Agricultural Sciences,2008,45(3):484-489.(in Chinese)
[4] 常 波,向本春,刘升学,等.新疆加工番茄条斑坏死病原黄瓜花叶病毒外壳蛋白基因的克隆和序列分析 [J].石河子大学学报:自然科学版,2006,24(4):410-414.
Chang B,Xiang B C,Liu S X,et al.Cloning and sequence analysis of coat protein gene of cucumber mosaic virus isolate from stripe and necrosis virus of processing tomatoes in Xinjiang [J].Journal of Shihezi University:Natural Science,2006,24(4):410-414.(in Chinese)
[5] 赵祥树,向本春,刘升学,等.新疆天山北部地区加工番茄上ToMV和CMV的动态分析 [J].石河子大学学报:自然科学版,2010,28(5):561-564.
Zhao X S,Xiang B C,Liu S X,et al.Population dynamics ofTomatomosaicvirusandCucumbermosaicvirusof processing tomato in the north of Tianshan mountains in Xinjiang [J].Journal of Shihezi University:Natural Science,2010,28(5):561-564.(in Chinese)
[6] 许文博,都业娟,黄家风.加工番茄CMV与ToMV的ELISA检测及其相关性分析 [J].石河子大学学报:自然科学版,2009,27(2):199-201.
Xu W B,Du Y J,Huang J F.Virus detection by ELISA and correlation analysis between ToMV and CMV [J].Journal of Shihezi University:Natural Science,2009,27(2):199-201.(in Chinese)
[7] Waterhouse P M,Graham M W,Wang M B.Virus resistance and gene silencing in plants can be induced by simultaneous expression of sense and anti-sense RNA [J].BMC Plant Biology,1998,95(23):13959-13964.
[8] Wianny F,Zernicka-Goetz M.Specific interference with gene fu-nction by double-stranded RNA in early mouse development [J].Nature Cell Biology,2000,2(2):70-75.
[9] Cogni C,Macino G.Gene silencing inNeurosporacrassarequires a protein homologous to RNA-dependent RNA polymerase [J].Nature,1999,399:166-169.
[10] 朱常香,宋云枝.多抗PVY、TMV和CMV转基因烟草的培育 [J].中国农业科学,2008,41(4):1040-1047.
Zhu C X,Song Y Z.Production of transgenic tobacco plants with multi-virus resistance via RNA-mediated virus resistance [J].Scientia Agricultura Sinica,2008,41(4):1040-1047.(in Chinese)
[11] Shuichiro Takahashi,Ken Komatsu,Satoshi Kagiwada,et al.The efficiency of interference of potato virus X infection depends on the target gene [J].Virus Research,2006,11:6214-6217.
[12] 李奇科,陶 刚,邱又彬,等.马铃薯Y病毒CP基因RNAi 载体构建与干涉效果测定 [J].基因组学与应用,2009,28(3):460-464.
Li Q K,Tao G,Qiu Y B,et al.RNAi vector targeting and interference effect determination of PVY CP gene [J].Genomics and Applied Biology,2009,28(3):460-464.(in Chinese)
[13] Waterhouse P M,Garham M W,Wang M B.Virus resistance and gene silencing in plants can be induced by simultaneous expression of sense and antisense RNA [J].Proc Natl Acad Sci USA,1998,95:13959-13964.
[14] Wang M B,Abbott D C,Waterhouse P M.A single copy of a virus-derived transgene encoding hairpin RNA gives immunity to barley yellow dwarf virus [J].Mol Plant Pathol,2000,1(6):347-356.
[15] 朱俊华,朱常香,温孚江,等.正向和反向重复RNA介导的抗马铃薯Y病毒基因工程比较研究 [J].植物病理学报,2004,34(2):133-140.
Zhu J H,Zhu C X,Wen F J,et al.Comparison of resistance to potato virus Y mediated by direct and inverted repeats of the coat protein gene segments in transgenic tobacco plants [J].Acta Phytopathologica Sinica,2004,34(2):133-140.(in Chinese)
[16] 颜培强,李丽杰,康 宏,等.应用RNAi技术培育抗2种病毒病的转基因烟草 [J].中国生物工程杂志,2007,27(11):27-31.
Yan P Q,Li L J,Kang H,et al.RNA interference mediated inhibition of TMV and CMV virus in tobacco [J].China Biotechnology,2007,27(11):27-31.(in Chinese)
[17] 方宣钧,孔 巍,金芜军.快速一步法(ROSE法)提取DNA应用于RAPD-PCR扩增 [J].高技术通讯,1997(10):40-43.
Fang X J,Kong W,Jin W J.Rapid one step DNA extraction for RAPD-PCR amplification [J].High Technology Letters,1997(10):40-43.(in Chinese)
[18] 张 恭,刘立峰,马峙英.RNA干扰及其植物抗病毒应用 [J].中国农学通报,2007,23(1):42-45.
Zhang G,Liu L F,Ma S Y.RNA interference and its application in plant anti-virus [J].Chinese Agricultural Science Bulletin,2007,23(1):42-45.(in Chinese)
[19] Wesley S V,Helliwell C A,Smith N A,et al.Construct design for efficient,effective and high-throughput gene silencing in plants [J].The Plant Journal,2001,27(6):581-590.
[20] Frary A,Earle E D.An examination of factors affecting the efficiency ofAgrobacterium-mediated transformation of tomato [J].Plant Cell Reports,1996,16:235-240.
[21] Carolina Cortina,Francisco A Culi’aez-Maci’a.Tomato tran-sformation and transgenic plant production [J].Plant Cell,Tissue and Organ Culture,2004,76:269-275.
[22] van Roekel J S C,Damm D,Melchers L S,et al.Factors influencing transformation frequency of tomato (Lycopersiconesculentum) [J].Plant Cell Reports,1993,12:644-647.
[23] Pozueta-Romero J,Houlne G,Canas L,et al.Enhanced regeneration of tomato and pepper seedling explants forAgrobacterium-mediated transformations [J].Plant Cell,Tissue and Organ Culture,2001,67:173-180.
[24] 彭细桥,戴良英,刘红艳.番茄离体再生体系优化研究 [J].湖南农业大学学报:自然科学版,2004,30(6):506-509.
Peng X Q,Dai L Y,Liu H Y.Study on regenerative system of tomato [J].Journal of Hunan Agricultural University:Natural Sciences,2004,30(6):506-509.(in Chinese)
[25] 于慧敏,石 竹,杨俊杰.番茄的不同基因型对组培植株再生能力的影响 [J].山东师范大学学报:自然科学版,2007,22(4):120-130.
Yu H M,Shi Z,Yang J J.Effects different tomato genotypes on the plant regeneration in tissue culture [J].Journal of Shandong Normal University:Natural Science,2007,22(4):120-130.(in Chinese)

